Refugialraum

Refugialräume (von lateinisch refugium = Zufluchtsort, engl.: refugia; auch Erhaltungsräume) sind im Allgemeinen Habitate, in die sich Tier- oder Pflanzenarten zurückziehen, weil in ihren ursprünglichen (meist viel größeren) Lebensräumen aus verschiedenen Gründen kein Überleben mehr möglich ist. Dies können entweder Ökoregionen sein, die sich durch klimatische, anthropogene oder andere massive Einflüsse deutlich verkleinert haben, oder solche, die durch die veränderten Bedingungen in anderen Klimazonen in ähnlicher Zusammensetzung neu entstanden sind (und die vormals dort typischen Ökosysteme verdrängt haben).
Die Bezeichnung wurde 1955 von dem Pollenkundler Calvin J. Heusser als Fachbegriff in die Ökologie eingeführt, als er die geschrumpften und verschobenen Verbreitungsgebiete von Pflanzenarten in Kanada während der letzten eiszeitlichen Vergletscherung beschrieb.[1]
Im engeren Sinne wird die Bezeichnung (zumeist als Eiszeit-, Glazial- oder pleistozänes Refugium → Abschnitt Klimarefugium) nach wie vor auf Gebiete angewandt, in denen eine bestimmte Art während eines vollständigen glazial/interglazialen-Zyklus überlebt hat.[2] Diese Theorie galt zunächst nur für Gebiete der nördlichen Hemisphäre, wurde später jedoch auch auf andere Klimazonen und Ökoregionen übertragen, so etwa 1961 von James Allen Keast auf die Vogelwelt Australiens, 1969 von Jürgen Haffer auf die tropischen Regenwälder im Amazonasbecken, 1966 von Reginald Ernest Moreau auf die Vogelwelt Afrikas und 1975 von Harry Godwin auf die Pflanzenwelt der britischen Inseln.[3]
Im weiteren Sinne wird die Bezeichnung heute auch auf einzelne Tiere und Pflanzen angewandt, die in einem (gegenwärtigen) Refugialraum „vor schädlichen und energieverbrauchenden Umwelteinflüssen relativ sicher“ sind:[4]
- Beispiel Fließgewässer: Die Selbstreinigung und die damit verbundene Selbstregulation führen zu einer Wiederherstellung des Ausgangszustandes des Fließgewässers nach einer starken Belastung (Hochwasser, viel Abwasser). Danach treten die Tiere aus den Refugialräumen hervor und besiedeln das Gebiet erneut, so dass das Ökosystem mit den abiotischen und biotischen Faktoren wiederhergestellt ist. Typische Refugialräume in Fließgewässern sind zum Beispiel das hyporheische Interstitial und strömungsberuhigte Uferbereiche.
Klimarefugium
[Bearbeiten | Quelltext bearbeiten]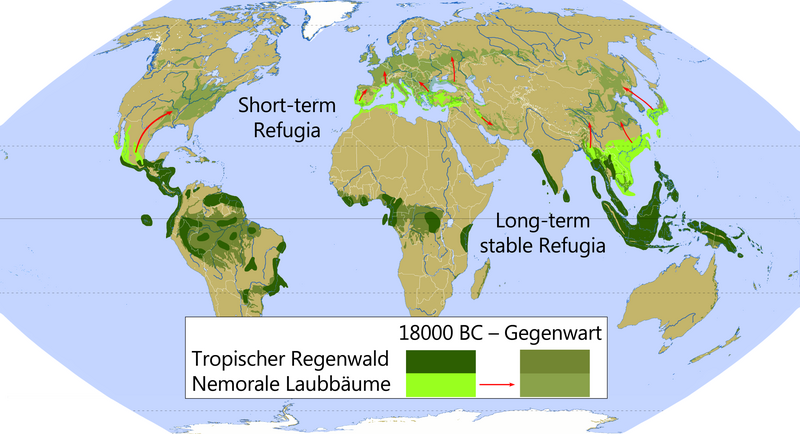
Durch globale Klimaänderungen (etwa während der Eiszeiten) entstanden immer wieder Refugialräume für zahlreiche Arten. Dabei wird (vor allem in der englischsprachigen Literatur) zwischen zwei verschiedenen Typen unterschieden:[5]
Short-term Refugia
[Bearbeiten | Quelltext bearbeiten]„Kurzzeit-Refugien“ sind solche Refugialräume, die durch die vorübergehend weitgehende Umwandlung von Ökosystemen durch die Einwanderung neuer Arten gekennzeichnet sind. Sie kommen vorwiegend in der (heutigen) gemäßigten Zone vor. In solchen Rückzugsgebieten herrschten etwa während der Eiszeiten lokale Klimata, die Pflanzen- und Tierarten das Überleben sicherten und so die postglaziale Rückkehr in ihre ursprünglichen Habitate ermöglichten. Im Gegensatz zu den Langzeit-Refugien gingen die ursprünglichen Lebensräume hier zeitweise komplett verloren.
In der Biogeographie der Gebirge unterscheidet man weiterhin Nunatakker (zum Teil eisfreie, isolierte Berggipfel innerhalb eines Gletschers), Periphere Refugien (Gebiete in unmittelbarer Gletschernähe) und Tieflandrefugien (Gebiete im Anschluss an die Gletscherregion, auch periglaziale Refugien genannt).[6]
Long-term (stable) Refugia
[Bearbeiten | Quelltext bearbeiten]„Langzeit(stabile) Refugien“ entstanden in den Kaltzeiten vorwiegend in den Tropen durch eine drastische Verkleinerung und Fragmentierung von großräumigen Ökosystemen (Wälder und Savannen) zu vielen kleineren „Inselhabitaten“. Dabei schrumpft der Lebensraum der dort beheimateten Arten, ohne jedoch ganz zu verschwinden wie bei den Kurzzeit-Refugien. Die Gebiete, die in der letzten Eiszeit „Inselrefugien“ waren, gehören demnach zu den ältesten Ökosystemen der Erde.
Die Übertragung der Refugien-Theorie auf tropische Gebiete in den 1960er und -70er Jahren erfreute sich lange Zeit großer Beliebtheit, da man glaubte, mit der Existenz dieser Langzeitrefugien die enorm große Artenvielfalt einiger Regenwälder zu erklären.
Sicher ist, dass die Entwicklungsgeschichte der tropischen Regenwälder Madagaskars, Australiens und Neukaledoniens in den Refugien ununterbrochen bis in die ausgehende Kreidezeit (Campanium) und in Südamerika und Afrika mindestens in das mittlere Eozän (Bartonium) zurückreicht.[7]
Die Hypothese der Waldrefugien hat sich jedoch im Laufe der Zeit geändert: Man stellte fest, dass die Refugien kleiner, weiter verstreut, von mehr unterschiedlichen anderen Vegetationstypen benachbart und vor allem weniger homogen besetzt waren als ursprünglich angenommen, da das Tropenklima während der Eiszeiten kälter, trockener und jahreszeitlich schwankender war als heute.[8]
In den letzten Jahrzehnten wurden Studien durchgeführt, die nahezu jeden Aspekt der Waldrefugien-Hypothese bestätigen und widerlegen. Der größte Streitpunkt beruht vor allem auf der noch unzureichenden Rekonstruktion der Ausmaße von Tropenwald- und Savannengebieten in den Kaltzeiten. Einig ist man sich nur über die Tatsache, dass die enorme Vielfalt nicht durch diesen einen Mechanismus erklärt werden kann, sondern durch eine ganze Reihe von Faktoren, deren Wirkungen und Anteile jedoch noch weitgehend ungeklärt sind (etwa die Gebirgsbildung, Änderungen der Flussläufen und Wasserständen oder die Domestikation von Arten durch den Menschen).[3]
Eiszeitrelikte
[Bearbeiten | Quelltext bearbeiten]Heutige Refugialräume für einige Lebewesen der eiszeitlichen Mammutsteppe befinden sich in polaren Tundren und Kältewüsten Europas,[9] Asiens und Nordamerikas. Die Artenzusammensetzung der Tundra entspricht nicht der Mammutsteppe (die eher den heutigen Hochlandsteppen Tibets glich), so dass sich hier die Phänomene Refugialraum und Glazialrelikt begegnen.
Homo sapiens
[Bearbeiten | Quelltext bearbeiten]Refugialräume während des Kältemaximums der letzten Eiszeit (glaziale Refugia) fanden sich für den Menschen besonders in der franko-kantabrischen Region.[10], für viele Tiere und Pflanzen der gemäßigten Zone am Mittelmeer (52 Regionen wurden identifiziert),[11] aber auch relativ nördlich gelegene Refugien wurden belegt, so die waldreiche Region der Karpaten im Grenzbereich zum Permafrost.[12]
Refugialräume für Unterarten
[Bearbeiten | Quelltext bearbeiten]Da glaziale Refugien zahlreiche Arten beherbergten, wurde vermutet, dass dies auch für diverse Unterarten galt. Man nahm an, dass so eine hohe Biodiversität auf engem Raum entstand. Untersuchungen konnten diese Annahme jedoch nicht stützen.[13][14]
Das Vorhandensein von mehreren Unterarten einer Art weist vielmehr auf ihre genetische Differenzierung durch die Trennung ihrer Habitate in unterschiedliche Refugialräume hin. Deren Populationen sind meist klein und daher bilden sich dort innerhalb begrenzter Zeiträume relativ homogene genetische Zusammensetzungen aus, sodass keine Unterarten entstehen können.[15] Sofern die Trennungszeiten lang genug andauern, entwickeln sich die Arten in jedem Refugium separat zu neuen Arten (allopatrische Artbildung).
Die Entdeckung und Beschreibung von Refugien und die Zuordnung daraus hervorgegangener Unterarten ermöglicht es, den zugrundeliegenden paläoklimatischen Verlauf chronologisch besser zu rekonstruieren.[16][17]
Siehe auch
[Bearbeiten | Quelltext bearbeiten]Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Calvin J. Heusser: Pollen Profiles from the Queen Charlotte Islands, British Columbia. In: Canadian Journal of Botany. Band 33, Nr. 5, 1955, S. 429–449, doi:10.1139/b55-036
- ↑ Godfrey M. Hewitt: Some genetic consequences of ice ages, and their role in divergence and speciation. In: Biological Journal of the Linnean Society. Band 58, Nr. 3, 1996, S. 247–276, DOI:10.1111/j.1095-8312.1996.tb01434.x
- ↑ a b Daniel Gomes da Rocha, Igor L. Käfer: What has become of the refugia hypothesis to explain biological diversity in Amazonia? in "Ecology and Evolution", 27. März 2019, online, Absätze 2 und 4.
- ↑ Glossar zu Unterrichtsmaterialien zum Thema Ein Bach ist mehr als Wasser..., S. 247 ( vom 26. November 2015 im Internet Archive). Im Original publiziert vom Hessischen Umweltministerium (PDF; 279 kB).
- ↑ E. G. Kauffman u. P. J. Harries (Autoren), M. B. Hart (Hrsg.): Biotic Recovery from Mass Extinction Events. Geological Society Special Publication No. 102, Geological Society of London, 1996, ISBN 1-897799-45-4, S. 22–23.
- ↑ Holderegger, R., Thiel-Egenter, C. (2009): A discussion of different types of glacial refugia used in mountain biogeography and phytogeography. Journal of Biogeography 36, 476-480. pdf-Version
- ↑ Jörg S. Pfadenhauer, Frank A. Klötzli: Vegetation der Erde: Grundlagen, Ökologie, Verbreitung. Springer Spektrum, Berlin/Heidelberg 2014, ISBN 978-3-642-41949-2. S. 87.
- ↑ Manfred Eggert: Der `Urwald´ als Lebens- und Projektionsraum: Das innere Zentralafrika*, in Svend Hansen, Michael Meyer (Hrsg.): Parallele Raumkonzepte, Walter de Gruyter, Berlin/Boston 2013, ISBN 978-3-11-029094-3. S. 43–44.
- ↑ P. Schönswetter, I. Stehlik, R. Holderegger, A. Tribsch: Molecular evidence for glacial refugia of mountain plants in the European Alps. In: Molecular Ecology. Band 14, Nr. 11, 2005, S. 3547–3555, doi:10.1111/j.1365-294X.2005.02683.x.
- ↑ A. Achili et al.: The molecular dissection of mtDNA haplogroup H confirms that the Franco-Cantabrian glacial refuge was a major source for the European gene pool. In: The American Journal of Human Genetics. Band 75, Nr. 5, 2004, S. 910–918, doi:10.1086/425590 (Volltext).
- ↑ Frédéric Médail, Katia Diadema: Glacial refugia influence plant diversity patterns in the Mediterranean Basin. In: Journal of Biogeography. Band 36, Nr. 7, 2009, S. 1333–1345, doi:10.1111/j.1365-2699.2008.02051.x.
- ↑ Petr Kotlík et al.: A northern glacial refugium for bank voles (Clethrionomys glareolus). In: PNAS. Band 103, Nr. 40, 2006, S. 14860–14864, doi:10.1073/pnas.0603237103.
- ↑ Rémy J. Petit et al.: Glacial refugia: hotspots but not melting pots of genetic diversity. In: Science. Band 300, Nr. 5625, 2003, S. 1563–1565, doi:10.1126/science.1083264.
- ↑ Alex Widmer, Christian Lexer: Glacial refugia: sanctuaries for allelic richness, but not for gene diversity. In: Trends in Ecology & Evolution. Band 16, Nr. 6, 2001, S. 267–269, doi:10.1016/S0169-5347(01)02163-2.
- ↑ K. Holder, R. Montgomerie, V. L. Friesen: A test of the glacial refuguim hypothesis using patterns of mitochondrial and nuclear DNA sequences variation in rock ptarmigan (Lagopus mutus). In: Evolution. 53, Nr. 6, Dezember 1999, S. 1936–1950, doi:10.2307/2640452.
- ↑ Andrea Grill et al.: Molecular phylogeography of European Sciurus vulgaris: refuge within refugia? In: Molecular Ecology. Band 18, Nr. 12, 2009, S. 2687–2699, doi:10.1111/j.1365-294X.2009.04215.x.
- ↑ S. A. Byun, B. F. Koop, T. E. Reimchen: North American black bear mtDNA phylogeography: implications for morphology and the Haida Gwaii glacial refugium controversy. In: Evolution. Band 51, Nr. 5, Oktober 1997, S. 1647–1653, Volltext (PDF).