Neopentan
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
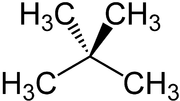
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Neopentan | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | C5H12 | ||||||||||||||||||
| Kurzbeschreibung |
farbloses Gas[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 72,15 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
gasförmig | ||||||||||||||||||
| Dichte |
0,60 g·cm−3 (flüssig, am Siedepunkt)[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
9,5 °C[1] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
praktisch unlöslich in Wasser (33 mg·l−1 bei 20 °C)[1] | ||||||||||||||||||
| Brechungsindex |
1,3476 (6 °C)[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| MAK |
1000 ml·m−3, 3000 mg·m−3[1] | ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Neopentan ist der Trivialname von 2,2-Dimethylpropan, neben n-Pentan und Isopentan eines der drei Strukturisomere der Pentane mit der Summenformel C5H12. Neopentan ist der einfachste Kohlenwasserstoff mit einem quartären Kohlenstoffatom. Bei Raumtemperatur und atmosphärischen Druck ist Neopentan ein farbloses, hochentzündliches Gas. Kommerziell wird es verflüssigt in Druckgasflaschen vertrieben.
Darstellung und Gewinnung
[Bearbeiten | Quelltext bearbeiten]Neopentan kommt in der Natur nur in sehr geringen Mengen in Erdöl oder Erdgas vor, so dass eine Gewinnung daraus sich nicht lohnt.[4] Die Synthese gelingt durch Methylierung von tert-Butylverbindungen wie tert-Butyliodid mittels Dimethylzink oder tert-Butylmagnesiumiodid mittels Dimethylsulfat, sowie durch die Hydrolyse von Neopentylmagnesiumchlorid mittels Wasser.[4]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Physikalische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]
Neopentan zeigt im Vergleich zu den anderen Pentanen einen wesentlich höheren Schmelzpunkt bei −16,6 °C. Zusätzlich wird bei −132,7 °C ein polymorpher Phasenübergang mit einer Umwandlungsenthalpie von 2,6305 kJ·mol−1 beobachtet.[5] Hier erfolgt der Übergang von der kristallinen zu einer plastisch kristallinen Form.[6] Das bedeutet, die Verbindung liegt oberhalb dieser Temperatur bis zum Schmelzpunkt in einem mesomorphen Zustand vor. Das Verhalten ist analog zu ähnlichen "kugelförmigen" Molekülen wie Tetramethylbutan, Cuban oder Adamantan, die ähnliche Mesophasen bilden. Die Verbindung siedet unter Normaldruck bei 9,5 °C. Es ist in Wasser mit 33 mg/l nur sehr schlecht löslich.[4] Gut löslich ist die Verbindung in Ethanol, Diethylether, Tetrachlorkohlenstoff[4] sowie in den meisten aliphatischen Kohlenwasserstoffen.
Thermodynamische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Die Dampfdruckfunktion ergibt sich nach Antoine entsprechend log10(P) = A−(B/(T+C)) (P in bar, T in K) mit A = 3,28533, B = 695,152 und C = −70,679 im Temperaturbereich von 205,6 K bis 293,2 K,[7] mit A = 3,86373, B = 950,318 und C = −36.329 im Temperaturbereich von 268 K bis 313,2 K.[8] bzw. mit A = 4,61616, B = 1478,868 und C = 41.256 im Temperaturbereich von 343 K bis 433 K.[9]
| Eigenschaft | Typ | Wert [Einheit] | Bemerkungen |
|---|---|---|---|
| Standardbildungsenthalpie | ΔfH0liquid ΔfH0gas |
−190,3 kJ·mol−1[10] −167,9 kJ·mol−1[10] |
als Flüssigkeit als Gas |
| Verbrennungsenthalpie | ΔcH0liquid | −3492,4 kJ·mol−1[10] | als Flüssigkeit |
| Wärmekapazität | cp | 163,89 J·mol−1·K−1 (5,8 °C)[11] | als Flüssigkeit |
| Tripelpunkt | Ttripel ptripel |
256,75 K[5] 268,47 Torr[5] |
|
| Kritische Temperatur | Tc | 433.8 K[12] | |
| Kritischer Druck | pc | 32,0 bar[12] | |
| Kritisches Volumen | Vc | 0,307 l·mol−1[12] | |
| Kritische Dichte | ρc | 3,26 mol·l−1[12] | |
| Schmelzenthalpie | ΔfH0 | 3,26 kJ·mol−1[13] | beim Schmelzpunkt |
| Verdampfungsenthalpie | ΔVH0 | 22,39 kJ·mol−1[14] | beim Normaldrucksiedepunkt |
Die Temperaturabhängigkeit der Verdampfungsenthalpie lässt sich entsprechend der Gleichung ΔVH0=A·e(−βTr)(1−Tr)β (ΔVH0 in kJ/mol, Tr =(T/Tc) reduzierte Temperatur) mit A = 36,76 kJ/mol, β = 0,2813 und Tc = 433,8 K im Temperaturbereich zwischen 264 K und 303 K beschreiben. [14]
Sicherheitstechnische Kenngrößen
[Bearbeiten | Quelltext bearbeiten]Die Verbindung bildet leicht entzündliche Gas-Luft-Gemische. Für flüssiges Neopentan wurde ein Flammpunkt kleiner als −7 °C bestimmt.[1] Der Explosionsbereich liegt zwischen 1,3 Vol.‑% (40 g/m3) als untere Explosionsgrenze (UEG) und 7,5 Vol.‑% (230 g/m3) als obere Explosionsgrenze (OEG).[1] Die Zündtemperatur beträgt 450 °C.[1] Der Stoff fällt somit in die Temperaturklasse T2.
Chemische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Neopentan ist wenig reaktiv. Neopentylkationen, die durch Säureeinwirkung aus Neopentylalkohol erhältlich sind, gehen Wagner-Meerwein-Umlagerungen ein.
Verwendung
[Bearbeiten | Quelltext bearbeiten]Die Verbindung kann als Standard in der NMR-Spektroskopie verwendet werden.[4] Selten wird Neopentan als Bestandteil von Treibgasen in Sprühdosen oder als Kältemittel (R601b) eingesetzt.
Weblinks
[Bearbeiten | Quelltext bearbeiten]Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e f g h i j k l Eintrag zu Neopentan in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Februar 2023. (JavaScript erforderlich)
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Organic Compounds, S. 3-386.
- ↑ Eintrag zu Neopentane im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ a b c d e Eintrag zu 2,2-Dimethylpropan. In: Römpp Online. Georg Thieme Verlag, abgerufen am 28. Dezember 2014.
- ↑ a b c H. Enokido, T. Shinoda, Y.-I. Mashiko: Thermodynamic Properties of Neopentane from 4 K to the Melting Point and Comparison with Spectroscopic Data. In: Bull. Chem. Soc. Jap. 42, 1969, S. 84–91, doi:10.1246/bcsj.42.84.
- ↑ J. Timmermans: Plastic crystals: A historical review. In: J. Phys. Chem. Solids. Band 18, Nr. 1, 1961, S. 1–8, doi:10.1016/0022-3697(61)90076-2.
- ↑ A. Hopfner, N. Parekh, Ch. Horner, A. Abdel-Hamid: Der Dampfdruck-Isotopie-Effekt von deuterierten Neopentanen. In: Ber. Bunsen-Ges. Phys. Chem. Band 79, 1975, S. 216–222.
- ↑ A. G. Osborn, D. R. Douslin: Vapor-Pressure Relations for 15 Hydrocarbons. In: J. Chem. Eng. Data. Band 19, Nr. 2, 1974, S. 114–117, doi:10.1021/je60061a022.
- ↑ P. P. Dawson, Jr., I. H. Silberberg, J. J. McKetta: Volumetric Behavior, Vapor Pressures, and Critical Properties of Neopentane. In: J. Chem. Eng. Data. Band 18, 1973, S. 7–15, doi:10.1021/je60056a007.
- ↑ a b c W. D. Good: The enthalpies of combustion and formation of the isomeric pentanes. In: J. Chem. Thermodyn. Band 2, 1970, S. 237–244, doi:10.1016/0021-9614(70)90088-1.
- ↑ J. G. Aston, G. H. Messerly: Heat capacities and entropies of organic compounds. II. Thermal and vapor pressure data for tetramethylmethane from 13.22°K to the boiling point. The entropy from its Raman spectrum. In: J. Am. Chem. Soc. Band 58, 1936, S. 2354–2361, doi:10.1021/ja01303a002.
- ↑ a b c d T. E. Daubert: Vapor-Liquid Critical Properties of Elements and Compounds. 5. Branched Alkanes and Cycloalkanes. In: J. Chem. Eng. Data. 41, 1996, S. 365–372, doi:10.1021/je9501548.
- ↑ E. S. Domalski, E. D. Hearing: Heat Capacities and Entropies of Organic Compounds in the Condensed Phase. Volume III. In: J. Phys. Chem. Ref. Data. 25, 1996, S. 1–525, doi:10.1063/1.555985.
- ↑ a b V. Majer, V. Svoboda: Enthalpies of Vaporization of Organic Compounds: A Critical Review and Data Compilation. Blackwell Scientific Publications, Oxford 1985, S. 300.


