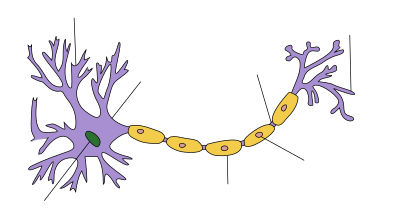
Axon
| Aufbau einer Nervenzelle |
|---|
Das Axon, selten der Axon (von altgr. ὁ ἄξων ho axōn ‚Achse‘), auch Neuraxon oder Achsenzylinder genannt,[1] ist ein oft langer schlauchartiger Nervenzellfortsatz, ein Neurit, der in einer Hülle von Gliazellen verläuft und zusammen mit dieser Umhüllung als Nervenfaser bezeichnet wird. Seitliche Abzweigungen des Axons werden auch dessen Kollaterale genannt[2] und können sich wie das terminale Axon in mehrere Endästchen aufzweigen.
Die meisten Neuronen haben ein einziges Axon. Es gibt aber auch Nervenzellen, die kein Axon besitzen, z. B. verschiedene Amakrinzellen der Netzhaut.[3]
Während ein Axon einen Impuls von der Zelle weiterleitet, empfangen Dendriten Signale von anderen Zellen.
Anatomie des Axons
[Bearbeiten | Quelltext bearbeiten]Ein Axon ist der von einer Gliahülle umgebene Fortsatz einer Nervenzelle, über den Signale zumeist in Form von Aktionspotentialen gerichtet weitergeleitet werden. In dessen Verlauf lassen sich die folgenden Abschnitte unterscheiden:[4]
- Der Ursprungskegel oder Axonhügel geht als pyramidenförmige Vorwölbung unmittelbar aus dem Perikaryon hervor; dieser von Nissl-Substanz freie Bereich markiert den Beginn eines Nervenzellfortsatzes, der zum Axon wird.
- Das Initialsegment ist das anschließende kurze Segment des Fortsatzes und stets ohne Hülle. Da die Erregungsschwelle des Axolemms im Anfangssegment außerordentlich niedrig ist, kann hier leicht ein Aktionspotential initiiert werden, das als Erregung fortgeleitet wird.
- Die Hauptverlaufsstrecke eines Axons kann unterschiedlich lang sein und unterwegs auch Abzweigungen aufweisen, die als Kollaterale bezeichnet werden.
- Als Endverzweigung ist ein Axon an seinem Ende mitunter baumartig zum Telodendron aufgezweigt. Durch dieses Endbäumchen kann eine Nervenzelle mit mehreren anderen Nervenzellen bzw. Effektoren in Verbindung stehen. Die Telodendrien, die auch bei Kollateralen vorkommen können, enden in einer Vielzahl von Endabschnitten als präsynaptische Endigungen, auch Axonterminale, Endknöpfchen oder Boutons genannt, die jeweils den präsynaptischen Teil einer Synapse darstellen.
Das Zytoplasma eines Axons wird Axoplasma genannt und unterscheidet sich in manchem von dem des Nervenzellkörpers (Perikaryon bzw. Soma). Zwar finden sich auch im Axon Mitochondrien und Vesikel, doch nur ausnahmsweise Ribosomen oder ein raues endoplasmatisches Retikulum. Erhalt und Funktion des Axons sind deshalb von der Proteinsynthese im Zellkörper abhängig. Bei Durchtrennung kommt es zum Absterben des abgetrennten Zellfortsatzes.[3]
Sowohl Neuriten wie Dendriten enthalten ein Zytoskelett aus Neurofilamenten und Neurotubuli. Meistenfalls wird der Signale vom Zellkörper fortleitende Neurit von Glia umhüllt zum Axon. In diesem Fall unterscheidet sich ein axonaler Mikrotubulus von einem dendritischen zum einen durch die je assoziierten Proteine und zum anderen durch seine Orientierung: die axonalen Mikrotubuli sind dann mit ihrem Plus-Ende (dem wachsenden Ende) zum Axonende hin orientiert. Bei den dendritischen kann das Plus-Ende auch im Zellkörper liegen.
Bei Menschen gibt es Axone von weniger als einem Millimeter Länge und über einen Meter lange, so etwa die Fortsätze von motorischen Nervenzellen im Rückenmark, welche die Zehenmuskeln innervieren.[3] Der Durchmesser eines Aktionspotentiale leitenden Axons kann hierbei zwischen 0,08 µm und 20 µm betragen und bleibt über die gesamte Länge relativ konstant.[2] Die mit etwa 0,05 µm feinsten Neuriten wurden bei Amakrinzellen in den Lamina des visuellen Systems von Fruchtfliegen gefunden[5] und leiten graduierte Potentialänderungen als Signale. Zu den dicksten Axonen mit einem Durchmesser von bis zu einem Millimeter (1000 µm) zählen die Riesenaxone von Kalmaren; sie innervieren die den Sipho umgebende Muskulatur, deren Kontraktion rasche Fluchtbewegungen durch Wasserrückstoß erlaubt. Diese Axone leiten Aktionspotentiale, sind jedoch nicht derart von einer Myelinscheide umhüllt, dass eine saltatorische Erregungsleitung möglich wird.
Ein solches Axon eines Tintenfischs ist 50- bis 1000-mal dicker als eines von Säugetieren. Durch den größeren Axonquerschnitt wird der Längswiderstand des Axons (Innenwiderstand) deutlich geringer, sodass der elektrotonische Stromfluss vom erregten zu noch unerregten Arealen leichter erfolgen kann, was eine raschere Weiterleitung ermöglicht. Doch ist die Geschwindigkeit der Erregungsleitung trotz des großen Axondurchmessers noch niedriger als bei hundertfach dünneren Axonen, wenn diese myelinisiert sind.
Myelinisierung
[Bearbeiten | Quelltext bearbeiten]Eine Myelinhülle um Axone wird von den Gliazellen des Nervensystems gebildet, im zentralen Nervensystem (ZNS) von den Oligodendrozyten und im peripheren Nervensystem (PNS) von den Schwann’schen Zellen. Mit der Myelinisierung wird eine andere, sprunghafte Weiterleitung elektrischer Signale über das Axon möglich, welche deutlich weniger Energie benötigt, ein dünneres Axon erlaubt (Platz- und Material-Ersparnis) und zudem schneller ist als die kontinuierliche Weiterleitung.
Die Einheit aus Axon einer Nervenzelle und Hüllstrukturen von Gliazellen, samt verstärkter Basallamina in peripheren Nerven, nennt man Nervenfaser. Nervenfasern, bei denen Gliazellen sich mehrfach um den Achsenzylinder gewickelt haben, sodass eine myelinreiche Einscheidung gebildet wird, heißen myelinisiert oder auch markhaltig. Nach Dicke der Myelin- oder Markscheide werden markreiche und markarme Fasern unterschieden; marklos oder nicht myelinisert sind Nervenfasern ohne eine als Markscheide ausgebildete Umhüllung, z. B. wenn Axone in einfachen Falten von Gliazellen verlaufen.
Erst mit der Ausbildung einer Myelinscheide kann ein Axon auch elektrisch so von seiner Umgebung isoliert werden, dass Signale über längere Abschnitte ohne erhebliche Abschwächung elektrotonisch rasch weitergeleitet werden können und nur mehr in den Lücken zwischen aufeinanderfolgenden Gliazellen – an den sogenannten Ranvier-Schnürringen – wieder aufgefrischt werden müssen. Diese sprunghafte (saltatorische) Weiterleitung von Aktionspotentialen macht deutlich höhere Leitungsgeschwindigkeiten möglich, sie ist beispielsweise bei einem Fünfzigstel des Durchmessers von Riesenaxonen noch sechsfach schneller.
Die Markscheidendicke hängt jeweils von der Anzahl der Wicklungen seitens der Gliazelle ab und ist vollausgebildet je auf den Axondurchmesser abgestimmt. Dickere Axone besitzen so dickere Markscheiden, mit bis zu rund hundert Lamellenschichten. Die Breite der Ranvier-Schnürringe oder -Knoten variiert wenig, der Abstand zwischen diesen Knoten, das Internodium, kann zwischen 0,1 mm und 1,5 mm betragen. Die Länge eines Internodiums entspricht je einer Schwann-Zelle bei einem peripheren Nerv. Da sich deren Anzahl entlang einer Nervenfaser später beim wachsenden Körper nicht ändert, nimmt mit dem Wachstum die Internodienlänge zu.[6] Bei größerem Durchmesser des myelinisierten Axons ist auch bei markhaltigen Nervenfasern die Geschwindigkeit der Erregungsleitung höher, sodass eine Einteilung von Nervenfasern allein nach der Leitungsgeschwindigkeit meist ungefähr auch eine nach der Faserdicke liefert (siehe Einteilung nach Leitungsgeschwindigkeit nach Erlanger/Gasser und Nervenleitgeschwindigkeit).
Myelinisierte Axone werden zur Art der Erregungsleitung passend umgebaut. So zeigt die Zellmembran einer Nervenzelle im Verlauf des Axons, das Axolemm, dann abwechselnd kurze Abschnitte mit dichterer Ionenkanalausstattung im Bereich der Ranvier-Knoten (nodal) und längere Abschnitte mit spärlicherem Besatz (internodales Axolemm).
Wachstum und Entwicklung
[Bearbeiten | Quelltext bearbeiten]Das Axonwachstum beginnt direkt mit der Aggregation. Sowohl wachsende Axone als auch Dendriten besitzen einen Wachstumskegel mit fingerartigen Ausläufern (Filopodien). Diese Ausläufer „suchen tastend“ nach dem Weg.
Diese Hypothese geht von chemotrophen Faktoren aus, die von den Zielzellen emittiert werden. Das Phänomen wurde zuerst am Nervus opticus (Sehnerv) des Frosches nachgewiesen.[7]
Diese beruht auf Signalen, die von Axonen emittiert werden und sorgt dafür, dass nachwachsende Axone eine Affinität für denselben Weg aufweisen.
Aufgaben
[Bearbeiten | Quelltext bearbeiten]Das Axon leitet elektrische Nervenimpulse vom Zellkörper (Perikaryon oder Soma) weg. Die Weitergabe von Nervenzelle zu Nervenzelle bzw. an das Erfolgsorgan erfolgt jedoch meist nicht elektrisch, sondern chemisch. Am Endknopf werden Neurotransmitter als chemische Botenstoffe ausgeschüttet, die an einen Rezeptor binden, darüber die Membrandurchlässigkeit für bestimmte Ionen beeinflussen und so eine Spannungsänderung in der zugeordneten Membranregion der nachgeschalteten Zelle hervorrufen.
Nach der Richtung der Erregungsleitung wird unterschieden in afferente und efferente Axone.[2] Bezogen auf das Nervensystem als Ganzes leiten afferente Neuriten Erregung von den Sinnesorganen zum ZNS hin. Man unterscheidet diese Afferenzen in somatische (von der Körperoberfläche) und viszerale (aus den Eingeweiden). Efferente Neuriten dagegen leiten Impulse vom ZNS zu den peripheren Effektoren (z. B. Muskeln oder Drüsen); auch hier werden somatische (von motorischen Neuronen zur Skelettmuskulatur, z. B. des Fußes) und viszerale Efferenzen (für glatte Muskulatur und Herzmuskulatur sowie Drüsen) unterschieden.
Axonaler Transport
[Bearbeiten | Quelltext bearbeiten]Neben der Weiterleitung elektrischer Signale findet im Axon auch ein Stofftransport statt. Man unterscheidet einen langsamen axonalen Transport, der nur in einer Richtung, vom Zellkörper (Soma) zum peripheren Ende des Axons, verläuft, und schnellen axonalen Transport, der in beiden Richtungen stattfindet – sowohl anterograd wie auch retrograd, vom terminalen Axon zum Soma.
Geschichte
[Bearbeiten | Quelltext bearbeiten]Nachdem erkannt worden war, dass Nerven trotz ähnlichem Aussehen keine Sehnen sind, die Muskeln und Knochen verbinden (altgr. νεῦρον neuron ‘Flechse, Sehne’), sondern einen Zusammenhang bilden, der den gesamten Körper durchzieht, wurden für ihre Aufgaben verschiedene Modelle entwickelt. So auch mechanistische wie das von René Descartes 1632 in seiner „Abhandlung über den Menschen“ (Traité de l’homme; postum De homine 1662), nach dem ihre Fasern kraft Wärme durch mechanischen Zug Bewegungen hervorzubringen imstande wären, ähnlich einer Maschine. Die im 17. Jahrhundert weiterentwickelten Lichtmikroskope erlaubten zunehmend feinere Einblicke in die Struktur des Gewebes, und die Entdeckung galvanischer Ströme gegen Ende des 18. Jahrhunderts machte andere Vorstellungen seiner Funktionsweise möglich.
Doch Untersuchungen mit intrazellulären Ableitungen von einzelnen Neuronen im Nervensystem konnten erst in den 1930ern von K. Cole and H. Curtis durchgeführt werden. Zuvor wurden periphere Nerven untersucht, die darin gebündelteten Nervenfasern näher betrachtet und ihr Verlauf nachvollzogen. Dem deutschen Anatomen Otto Deiters war 1860 „der Uebergang eines Axencylinders ächter Natur in einen Ganglienzellenfortsatz“[8] schon bekannt; ihm wird angerechnet als erster den einzigen „Hauptzellfortsatz“ von weiteren „Protoplasmafortsätzen“ unterschieden zu haben, für welche der Schweizer Anatom Wilhelm His später den Begriff „Dendriten“ prägte. Der Schweizer Albert von Kölliker und der Deutsche Robert Remak waren die ersten, die das Initialsegment des Axons identifizierten und beschrieben.
Am Riesenaxon eines Tintenfischs wurde von Alan Lloyd Hodgkin und Andrew Fielding Huxley die Bildung und Leitung von Aktionspotentialen untersucht und 1952 als Hodgkin-Huxley-Modell quantitativ beschrieben.
Krankheiten und Verletzungen
[Bearbeiten | Quelltext bearbeiten]Axotomie und Degeneration
[Bearbeiten | Quelltext bearbeiten]Unter Axotomie versteht man die Durchtrennung eines Axons. Das kann infolge eines Unfalls passieren oder ist Teil von kontrollierten Tierexperimenten. Die kontrollierte Durchtrennung von Axonen führte zur Identifikation von zwei Arten neuronaler Degeneration (siehe auch Neuronale Plastizität, Apoptose, Nekrose).
- Anterograde Degeneration
Diese Degeneration des abgeschnittenen fernen (distalen) Anteils des betroffenen Neurons, also des terminalen Axons und mancher Kollateralen, tritt schnell ein, da der distale Abschnitt auf die metabolische Versorgung durch das Soma angewiesen ist.
- Retrograde Degeneration
Falls die durchtrennte Stelle nahe dem Zellkörper gelegen ist, kann es auch zur Degeneration des nahen (proximalen) Segments kommen. Diese verläuft langsamer und äußert sich nach zwei bis drei Tagen durch degenerative oder regenerative Veränderungen des Neurons. Der Verlauf hängt entscheidend davon ab, ob das Neuron den synaptischen Kontakt mit einer Zielzelle wiederaufnehmen kann.
Im schlimmsten Fall können auch angrenzende Neurone degenerieren. Je nach Lage der dann zusätzlich betroffenen Neurone spricht man hier von anterograder bzw. retrograder transneuraler Degeneration.
Regeneration
[Bearbeiten | Quelltext bearbeiten]Die ursprüngliche Fähigkeit des zielgenauen Axonwachstums während der Entwicklung des Nervensystems geht im ausgereiften menschlichen Gehirn verloren. Neuroregeneration findet im ZNS in der Regel nicht statt. Abgestorbene Neurone werden durch Gliazellen (meist Astrozyten) ersetzt und es entstehen sogenannte Glianarben.[9]
Die Neuroregeneration im PNS beginnt in der Regel zwei bis drei Tage nach Verletzung des Axons und hängt wesentlich von der Art der Verletzung des Neurons ab:[9]
- Sind die Myelinscheiden noch intakt (beispielsweise nach Quetschung), so kann das Axon darin wieder nachwachsen zum ursprünglichen Zielort mit einer Geschwindigkeit von etwa 2–3 mm pro Tag (völlige funktionale Regeneration).
- Sind die durchtrennten Enden noch nahe beieinander, so ist ebenfalls ein Nachwachsen in den Myelinscheiden möglich, allerdings dann nicht selten auch zum falschen Zielort (schwierige funktionale Regeneration)
- Sind die durchtrennten Enden weit voneinander entfernt bzw. liegt eine großflächige Schädigung vor, so ist allermeistens ohne operative Eingriffe keine funktionelle Regeneration möglich und selbst nach diesen in vielen Fällen nur eine unvollständige.
Demyelinisierende Erkrankungen
[Bearbeiten | Quelltext bearbeiten]Demyelinisierende Erkrankungen (Entmarkungskrankheiten) führen dazu, dass die Axone im ZNS Teile ihrer Myelinscheide verlieren und somit Markscheidenabschnitte zerstört sind. Das ist z. B. bei Multiple Sklerose (MS), der Baló-Krankheit, akute disseminierte Enzephalomyelitis (ADEM) oder Neuromyelitis optica (Devic-Syndrom) der Fall.
Weblinks
[Bearbeiten | Quelltext bearbeiten]- Axon – Artikel bei Wissenschaft-Online.de
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Axon. In: Lexikon der Neurowissenschaft. Abgerufen am 27. November 2015. – Bezeichnungen bei Spektrum.de.
- ↑ a b c Clemens Kirschbaum: Biopsychologie von A bis Z. Springer-Lehrbuch, ISBN 3540396039, S. 30/31 Lemma „Axon (afferent/efferent)“.
- ↑ a b c Luiz Carlos Junqueira (Autor), José Carneiro (Autor), Manfred Gratzl (Herausgeber): Histologie: Neue Approbationsordnung. 6., neu übersetzte, überarbeitete und aktualisierte Auflage. Springer, Berlin / Heidelberg / New York 2004, ISBN 3-540-21965-X, S. 112 f.
- ↑ Theodor H. Schiebler, Horst-W. Korf: Anatomie: Histologie, Entwicklungsgeschichte, makroskopische und mikroskopische Anatomie, Topographie. Steinkopff; Auflage: 10., vollst. überarb. Aufl. (21. September 2007), ISBN 3798517703, Seite 72.
- ↑ Aldo Faisal et al.: Ion-Channel Noise Places Limits on the Miniaturization of the Brain’s Wiring. In: CurrentBiology, Volume 15, Ausgabe 12, Juni 2005, S. 1147.
- ↑ Renate Lüllmann-Rauch: Taschenlehrbuch Histologie. 3. Auflage. Thieme Verlag, 2009, ISBN 978-3-13-129243-8, S. 191.
- ↑ Clemens Kirschbaum: Biopsychologie von A bis Z. Springer-Lehrbuch, ISBN 3540396039, S. 49 Lemma „Chemoaffinitätshypothese“.
- ↑ Otto Deiters (Max Schultze (Hrsg.)): Untersuchungen über Gehirn und Rückenmark des Menschen und der Säugethiere, Vieweg, Braunschweig 1865, Seite 2.
- ↑ a b John P. J. Pinel, Paul Pauli: Biopsychologie, PEARSON STUDIUM; Auflage: 6., aktualis. Aufl. (29. Mai 2007), S. 327.