Dichlormonoxid
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
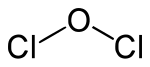
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Dichlormonoxid | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | Cl2O | ||||||||||||||||||
| Kurzbeschreibung |
gelbbraunes Gas[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 86,90 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
gasförmig[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
2,0 °C[2] | ||||||||||||||||||
| Löslichkeit |
gut in Tetrachlormethan[3] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Dichlormonoxid ist eine chemische Verbindung aus der Gruppe der Oxide und wurde 1842 erstmals von Gay-Lussac durch die Umsetzung von Chlor mit Quecksilber(II)-oxid erhalten.[3]
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Dichlormonoxid kann durch Reaktion von Quecksilber(II)-oxid mit Chlor gewonnen werden.[1]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Dichlormonoxid ist ein gelbbraunes (als Flüssigkeit tiefbraun), unangenehm heftig riechendes Gas, das in Wasser unter Bildung von Hypochloriger Säure gut löslich ist. Es kann nur flüssig oder fest bei bzw. unterhalb von −78 °C aufbewahrt werden. Es ist stoßempfindlich und zersetzt sich im Licht. Es explodiert beim Berühren mit organischen Stoffen.[1] Mit Laugen bildet es Hypochlorite. Beim Verdünnen einer gesättigten Lösung bildet sich Hypochlorige Säure.[5]

Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band I, Ferdinand Enke, Stuttgart 1975, ISBN 3-432-02328-6, S. 310.
- ↑ a b J. A. Wojtowicz: Dichlorine Monoxide, Hypochlorous Acid, and Hypochlorites. In: Kirk-Othmer Encyclopedia of Chemical Technology. 16. April 2004, doi:10.1002/0471238961.0409030823151020.a01.pub2 (englisch).
- ↑ a b G. H. Cady: Chlorine(I) compounds (A. Chlorine(I) oxide). In: Therald Moeller (Hrsg.): Inorganic Syntheses. Band 5. McGraw-Hill, Inc., 1957, S. 156–158 (englisch).
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9, S. 492.
