Mutation



Als Mutation (von lateinisch mutatio, von mutare „ändern/verändern, verwandeln“) wird in der Biologie eine spontan auftretende, dauerhafte Veränderung des Erbgutes bezeichnet.[1] Die zuerst von Hugo de Vries und Thomas Hunt Morgan als „Mutation“ bezeichnete[2] Veränderung betrifft zunächst das Erbgut nur einer Zelle, wird aber an deren Tochterzellen weitergegeben.[3] Bei mehrzelligen Tieren unterscheidet man Keimbahn-Mutationen, die durch Vererbung an die Nachkommen weitergegeben werden können, von Mutationen in somatischen Zellen, die nicht in den Keimzellen (Gameten), sondern nur in den übrigen Geweben des Körpers vorliegen. Ein Organismus mit einem neuen, durch Mutation entstandenen Merkmal wird als Mutant, das neue Merkmal als Mutante bezeichnet.
Eine Mutation kann Auswirkungen auf die Merkmale eines Organismus haben oder auch nicht (stille Mutation). Abweichende Merkmalsausprägungen können negative, positive oder auch gar keine Folgen hinsichtlich der Lebensfähigkeit und/oder des Fortpflanzungsvermögens haben. Prägt sich eine Mutation als deutlich unterschiedener Phänotyp aus, der in einer Population zu einem gewissen Anteil (über 1 %) stabil erhalten bleibt, spricht man in der Biologie auch von Polymorphismus.[4] Polymorphismus ist eine wesentliche Voraussetzung für die Entstehung neuer Arten (Biodiversität).
Manchmal wird das unerwartete phänotypische Auftreten sehr seltener rezessiver Erbanlagen, die von unauffälligen mischerbigen (heterozygoten) Vorfahren (als Konduktoren) an den gemeinsamen Nachkommen vererbt wurden, fälschlich für eine Mutation gehalten.
Echte Mutationen können spontan (stochastisch) auftreten oder durch äußere Einflüsse verursacht werden, wie beispielsweise mutagene Strahlung (z. B. UV-Strahlung oder ionisierende Strahlung) oder erbgutverändernde Chemikalien (Mutagene).[5][6]
In der klassischen Zytogenetik werden Mutationen nach ihrem Umfang eingeteilt: Genommutationen sind Veränderungen der Anzahl der Chromosomen, Chromosomenmutationen sind Veränderungen der Chromosomenstruktur, die bei Chromosomenpräparaten lichtmikroskopisch erkennbar sind. Genmutationen sind dagegen an solchen Präparaten mikroskopisch nicht erkennbar und können nur durch DNA-Analyse festgestellt werden.[7][8] Eine Genmutation kann darin bestehen, dass neue Nukleotidsequenzen entstehen oder dass zuvor vorhandene Erbinformation verloren geht oder beides.
Mutationen in Genen, deren Genprodukte für die Aufrechterhaltung einer intakten DNA erforderlich sind, zum Beispiel Tumorsuppressorgene, können weitere Mutationen nach sich ziehen (Mutatorphänotyp).
Der Begriff der Mutation wurde von dem Botaniker Hugo de Vries, der auch die Lehre von den Mutationen begründete,[9] 1901 geprägt.[10]
Arten der Mutation
[Bearbeiten | Quelltext bearbeiten]Unterscheidung nach Erblichkeit
[Bearbeiten | Quelltext bearbeiten]- Keimbahnmutationen
- sind Mutationen, die an die Nachkommen über die Keimbahn vererbt werden; sie betreffen Eizellen oder Spermien sowie deren Vorläufer vor und während der Oogenese bzw. Spermatogenese. Diese Mutationen spielen eine bedeutende Rolle in der Evolution, da sie von einer Generation zur nächsten übertragbar sind. Auf den Organismus, in dem sie stattfinden, haben Keimbahnmutationen in der Regel keine direkten Auswirkungen.
- Somatische Mutationen
- sind Mutationen, die somatische Zellen betreffen. Sie haben Auswirkungen auf den Organismus, in dem sie stattfinden, werden aber nicht an die Nachkommen vererbt. So können sich unter anderem normale Körperzellen in ungebremst wuchernde Krebszellen umwandeln. Auch beim Altern eines Organismus spielen somatische Mutationen eine Rolle. Sie haben daher Bedeutung für die Medizin.
Unterscheidung nach Ursache
[Bearbeiten | Quelltext bearbeiten]- Spontanmutationen
- sind Mutationen ohne besondere äußere Ursache, etwa der chemische Zerfall eines Nukleotids (z. B. kann aus Cytosin durch spontane Desaminierung Uracil entstehen) oder der Tunneleffekt (Protonen-Tunneln in DNA[11]).
- Induzierte Mutationen
- sind durch Mutagene (mutationsauslösende Stoffe oder Strahlen) erzeugte Mutationen.
Unterscheidung nach Mechanismus
[Bearbeiten | Quelltext bearbeiten]- Fehler bei der Replikation
- DNA-Polymerasen bauen nach Vorlage mit unterschiedlich hohen Fehlerraten einen komplementären DNA-Strang auf.
- Unzureichende Proof-reading-Aktivität
- Manche DNA-Polymerasen haben die Möglichkeit, Fehleinbauten selbstständig zu erkennen und zu korrigieren (englisch proof-reading ‚Korrekturlesen‘). Jedoch besitzt z. B. die DNA-Polymerase α der Eukaryoten keine Proof-reading-Aktivität.
- Fehler bei prä- und postreplikativen Reparaturmechanismen
- Beim Auffinden eines ungewöhnlichen Nukleotids, etwa von Uracil in der DNA, wird dieses entfernt. Bei einer Fehlpaarung zwischen zwei DNA-typischen Nukleotiden trifft das Reparatur-Enzym eine Entscheidung mit 50-prozentiger Fehlerwahrscheinlichkeit.
- Ungleichmäßiges Crossing-over
- Zu Fehlpaarungen bei der Meiose kann es kommen durch benachbarte ähnliche oder identische Sequenzen auf dem Strang, wie etwa Satelliten-DNA oder Transposons.
- Non-Disjunction
- Die Fehlsegregation oder Non-Disjunction (englisch disjunction ‚Trennung‘) von Chromosomen führt zur fehlerhaften Verteilung auf die Tochterzellen und so zu Trisomien und Monosomien.
- Integration oder Herausspringen von Transposons oder Retroviren
- Diese Elemente können in Gene oder genregulatorische Bereiche integrieren oder desintegrieren und dadurch die Aminosäuresequenz eines Proteins oder die Ablesehäufigkeit eines Proteins verändern.
Unterscheidung nach Größe und Ort der Veränderung
[Bearbeiten | Quelltext bearbeiten]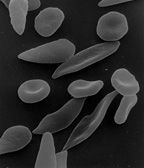
- Genmutation
- eine erbliche Änderung, die nur ein Gen betrifft. Beispiele sind Punkt- und Rastermutationen. Bei der Punktmutation wird lediglich eine organische Base im genetischen Code verändert (mutiert). Eine Frameshift-Mutation, also eine Insertion (Einschub) oder Deletion (Entfernen) einer Anzahl von Basen, die kein Vielfaches von drei ist, verändert jedoch aufgrund der Triplettcodierung im genetischen Code die gesamte Struktur eines Gens und hat deshalb meist weit größere Auswirkungen. Eine weitere mögliche Folge ist alternatives Spleißen. Zu den Genmutationen zählen auch Deletionen von längeren Sequenzen sowie Genduplikationen, bei denen sich ein bestimmter Abschnitt eines Chromosoms verdoppelt oder vervielfacht.
- Chromosomenmutation oder strukturelle Chromosomenaberrationen
- vererbbare Änderung der Struktur einzelner Chromosomen. Der im Lichtmikroskop sichtbare Bau eines Chromosoms ist verändert. So können Chromosomenstücke verloren gehen oder Teile eines anderen Chromosoms eingebaut sein. Ein Beispiel ist das Katzenschrei-Syndrom, bei dem ein Abschnitt des Chromosoms 5 verloren gegangen ist. Dadurch fehlen zahlreiche Gene, die zu einer starken Veränderung und Schädigung im Phänotyp führen.
- Genommutation oder numerische Chromosomenaberration
- eine Änderung, bei der ganze Chromosomen oder gar Chromosomensätze vermehrt werden (Aneuploidie, Polyploidie) oder verloren gehen. Ein bekanntes Beispiel beim Menschen ist das Downsyndrom. Hier ist das Chromosom 21 dreifach vorhanden.
Unterscheidung nach Folgen für das Protein
[Bearbeiten | Quelltext bearbeiten]- Trunkierende Mutationen
- Mutationen eines für ein Protein codierenden Genomabschnitts, in dessen Folge ein verkürztes Genprodukt (Protein) entsteht.
- Gain-of-function-Mutationen (GOF)
- Hierbei gewinnt das Genprodukt (Protein) an Aktivität und wird dann auch als hypermorph bezeichnet. Entsteht durch die Mutation ein komplett neuer Phänotyp, dann bezeichnet man das Allel auch als neomorph. Eine Gain-of-function-Mutation, die einen sichtbaren Phänotyp hervorruft, wird als ‚dominant‘ bezeichnet. Wenn ein Gain-of-function-Allel einen Phänotyp ausschließlich im homozygoten Zustand zeigt, spricht man jedoch von einer rezessiven Gain-of-function-Mutation.[12]
Für Gain-of-function-Mutationen bei Viren und Bakterien in vitro siehe
- Loss-of-function-Mutationen (LOF)
- Hierbei wird das Genprodukt (Protein) durch eine Mutation in dem Gen funktionslos. Ist der Funktionsverlust vollständig, spricht man von Nullallel oder einem amorphen Allel. Bleibt ein Teil der Wildtypfunktion erhalten, bezeichnet man es als hypomorphes Allel.
Loss-of-function-Mutationen sind kodominant oder (meistens) rezessiv, wenn ein anderes Allel den Funktionsverlust eines Gens auffangen kann.[13][14] - Haploinsuffiziente Mutationen
- Loss-of-function-Mutationen in einem Gen, dass keine Haploinsuffizienz verträgt, d. h. bei dem eine Halbierung der exprimierten Gendosis (mRNS) bereits ausreicht, um einen veränderten Phänotyp hervorzurufen. (Das betrifft nur diploide Organismen bei heterozygotem (monoallelischem) Genotyp der Mutation).
- Dominant negative Mutationen
- Wie bei Loss-of-function-Mutationen verliert das Genprodukt durch die Mutation seine Funktion. Das mutierte Protein ist jedoch außerdem noch in der Lage, die Funktion des verbliebenen zweiten (wildtyp) Allels zu unterdrücken, was ein bloßes Loss-of-function-Allel üblicherweise nicht tut bzw. nicht kann. Viele trunkierende Mutationen sind dominant negativ. (Das betrifft nur diploide Organismen bei heterozygotem (monoallelischem) Genotyp der Mutation.)
Unterscheidung nach Folgen für den Organismus
[Bearbeiten | Quelltext bearbeiten]- Neutrale Mutationen
- können den Phänotyp verändern, haben aber keine Fitnesskonsequenzen.
- Stille Mutationen
- sind Mutationen, bei denen das gebildete Protein unverändert bleibt. Trotzdem kann es zu Veränderungen im Organismus kommen, da die mRNA sich bei Verlassen des Zellkerns faltet. Dabei kann unterschiedliche Faltung die Menge des gebildeten Proteins beeinflussen.
- Konditional-letale Mutationen
- Mutationen, deren Veränderung des Genprodukts einen Organismus nur bei bestimmten Wachstumsbedingungen tötet.
- Letale Mutationen
- Mutationen, die nach ihrem Auftreten einen Organismus unabhängig von seiner jeweiligen Lebensphase in jedem Falle töten.
Häufigkeit von Mutationen
[Bearbeiten | Quelltext bearbeiten]Beim Menschen hat man die Zahl von Neumutationen (De-novo-Mutationen) durch Sequenzierung der DNA von Vater, Mutter und dem entsprechenden Kind bestimmt. Im Durchschnitt fand man 45 Neumutationen, wobei etwa 80 % der Mutationen aus den Spermien des Vaters stammen. Da die Spermienbildung (Spermatogenese) beim Mann kontinuierlich verläuft und somit die Zahl der Replikationen der DNA mit dem Alter zunimmt, ist es nicht erstaunlich, dass die Zahl der Neumutationen mit dem Alter des Vaters ansteigt. Ein junger Vater von 20 Jahren trägt 20 Mutationen bei, während ein älterer Vater von 40 Jahren 40 Mutationen beisteuert. Obwohl die Eizellen der Frau schon alle in der Embryonalentwicklung vor der Geburt ausgebildet sind und somit keine weitere Replikation der DNA stattfindet, konnte bei Frauen von 40 Jahren im Vergleich zu 20-jährigen Frauen ein Anstieg der Neumutationen von 7 auf 12 beobachtet werden. Offensichtlich treten die Neumutationen nicht nur bei der Replikation der DNA auf.[15]
Die große Häufigkeit an Mutationen wurde in einer Sequenzanalyse der proteincodierenden DNA des Menschen bei 60.706 Personen aufgezeigt. Die Studie deckte 7,4 Millionen Varianten auf, was im Schnitt einer Mutation an jedem 8. Basenpaar der DNA des Menschen entspricht.[16]
Folgen
[Bearbeiten | Quelltext bearbeiten]Keine Folgen – neutrale Mutationen
[Bearbeiten | Quelltext bearbeiten]Viele Mutationen führen zu Veränderungen in DNA-Abschnitten, die keine Konsequenzen für den Organismus nach sich ziehen. Dies ist der Fall, wenn die mutierte Stelle im Genom nicht für genetisch relevante Information benutzt wird (siehe Pseudogen, nichtcodierende DNA). Auch wenn die veränderte Stelle benutzt wird, kann es sein, dass der Informationsgehalt des Gens sich nicht verändert hat, da eine Reihe von Aminosäuren identisch codiert sind (siehe genetischer Code). Daher werden diese Mutationen stille oder stumme Mutationen genannt. Selbst Mutationen, die die Aminosäurensequenz eines Proteins verändern, können neutral oder fast neutral sein, wenn sich hierdurch die Struktur des Proteins kaum ändert.
Neutrale Mutationen tragen dazu bei, dass innerhalb einer Gruppe von Organismen funktional gleiche Gene unterschiedliche genetische „Buchstaben“ innerhalb ihrer Nukleotid-Sequenz besitzen. Diese Unterschiede, die Polymorphismen heißen, lassen sich ausnutzen, um Verwandtschaftsbeziehungen zwischen Individuen abzuleiten, oder auch um eine durchschnittliche Mutationsrate abzuschätzen.
Zusätzlich kommt noch zum Tragen, dass nicht nur beim diploiden Chromosomensatz oft mehrere Gene die gleichen genetischen Eigenschaften codieren, so dass sich eine Mutation aus diesem Grunde nicht sofort bemerkbar machen muss.
Die neutrale Theorie der molekularen Evolution besagt, dass die meisten genetischen Änderungen neutraler Art sind. Diese Hypothese ist umstritten und Gegenstand aktueller Forschung.
Negative Folgen
[Bearbeiten | Quelltext bearbeiten]Besonders größere Veränderungen im Erbgut führen oft zu nachteiligen Veränderungen im Stoffwechsel oder auch zu Fehlbildungen und anderen Besonderheiten.
Es gibt verschiedene Erbkrankheiten, die entweder vererbt sind oder durch Mutation neu auftreten können. Beispiele dafür sind:
- Sichelzellenanämie: Bei dieser Blutkrankheit ist die äußere Form der roten Blutkörperchen verändert und die Sauerstoffaufnahme verringert
- Phenylketonurie: gestörter Abbau der Aminosäure Phenylalanin, der das kindliche Gehirn schädigen kann
- Albinismus
- Mukoviszidose (zystische Fibrose): die häufigste genetisch bedingte Krankheit Nordeuropas. Das CFTR-Gen, das die Konsistenz der Drüsensekrete steuert, ist defekt. Wenn das Sekret zu zäh ist, kann es (je nach Drüse) die Atemwege oder die Ausführungsgänge der Drüsen verstopfen.
- Formen von Minderwuchs, bei denen die Arme und Beine ungewöhnlich kurz sind, während der Körper ansonsten wie üblich gebaut ist
- Rot-Grün-Schwäche
- Bluterkrankheit: gestörte Blutgerinnung
Positive Folgen
[Bearbeiten | Quelltext bearbeiten]Mutationen sind einer der Evolutionsfaktoren und damit für die Entwicklung des Lebens und der Artenvielfalt auf der Erde mitverantwortlich. Zwar sind Mutationen mit positiven Folgen der Wahrscheinlichkeit ihres Eintretens nach wesentlich seltener als solche neutraler oder negativer Auswirkung. Doch wenn eine positive Mutation auftritt, kann natürliche Selektion dazu beitragen, dass diese sich in einer Population ausbreiten kann. So sind beispielsweise die Folgen der Malaria bei heterozygoten Merkmalsträgern einer Sichelzellenanämie weniger schlimm. Diese Mutation ist daher in von Malaria betroffenen Gebieten häufiger verbreitet.
Der Mensch macht sich den genomverändernden Effekt ionisierender Strahlen zunutze, um Mutationen künstlich auszulösen. Dass durch Röntgenstrahlung Mutationen ausgelöst werden können, hatte Hermann Joseph Muller 1927 experimentell nachgewiesen.[17] Eine Anwendung besteht in der Bestrahlung von Blumen- und Pflanzensamen, um bisher unbekannte Formen zu erzeugen und wirtschaftlich zu nutzen. Das Verfahren hat aufgrund der breitgestreuten, zu umfangreichen und ungezielten Veränderung des Erbmaterials meist eine sehr geringe Erfolgsquote.
Beispiele
[Bearbeiten | Quelltext bearbeiten]
- Manx-Katzen sind durch Genmutation infolge extremer Inzucht entstanden. Neben der Schwanzlosigkeit bestehen Skelettmissbildungen und weitere Fehlbildungen. Manx-Katzen sind in diesem mutierten Gen M nie reinerbig, es liegt also bei ihnen die Kombination Mm vor, d. h., es besteht ein autosomal unvollkommen dominanter Erbgang mit variabler Expressivität (Ausprägung). Bei Tieren mit der reinerbigen Gen-Kombination MM sterben die Feten schon im Mutterleib.
- Die Sphynx-Katze hat keinerlei Fell. Diese Rasse wird seit 1966 aus einer in Kanada geborenen, natürlich mutierten Katze vom Menschen weitergezüchtet.
- Nacktmäuse, auch thymusaplastische Mäuse oder athymische Mäuse genannt, sind genetische Mutanten der Hausmaus mit fehlendem Thymus. Sie entstanden 1961 in Glasgow infolge einer Spontanmutation bei Albino-Mäusen und sind für die Forschung ein außerordentlich wichtiger Modellorganismus.
- Beim Escherichia coli-Langzeitexperiment von Lenski wurden Bakterien über zwei Jahrzehnte unter konstanten Bedingungen gehalten und die auftretenden Veränderungen im Genom regelmäßig dokumentiert. Als Kohlenstoffquellen befanden sich im Glasgefäß nur Glucose und Citrat. E. coli verwendet Glucose als natürliche Nahrungsquelle; Citrat als Kohlenstoffquelle kann der Wildtyp von E. coli nicht metabolisieren. 2003 zeigten sich plötzlich E. coli-Mutanten, die auch Citrat verstoffwechseln können.[18][19]
- Laktose-Toleranz beim Menschen: Genetisch determiniert sind die meisten Menschen wie alle Säugetiere im Erwachsenenalter laktose-intolerant, können also dann milchzuckerhaltige Nahrung nur noch schlecht oder gar nicht mehr verdauen. Nach Ansicht von Genetikern ist vor etwa 8.000 bis 10.000 Jahren bei einem Menschen im kaukasischen Raum eine Mutation aufgetreten, die die natürliche Laktosetoleranz des Säuglings und Kindes über die Stillzeit hinaus auf die gesamte Lebensspanne ausdehnte. Somit zeigen alle Nachkommen dieses Menschen zeit ihres Lebens keine gesundheitliche Beeinträchtigung beim Verzehr von Milch bzw. Milchzucker, wohingegen solche Nahrungsmittel beispielsweise von erwachsenen Asiaten oder Afrikanern nicht vertragen werden, die von dieser Mutation nicht betroffen sind (siehe Laktoseintoleranz).
- Gehirnentwicklung des Menschen: Die Gene Microcephalin und ASPM steuern beim Menschen das Größenwachstum des Gehirns. Forscher um Bruce Lahn vom Howard Hughes Medical Institute der University of Chicago (USA) haben herausgefunden, dass zwei Mutationen sich in der jüngeren Stammesgeschichte des Menschen als vorteilhaft erwiesen haben. Die Haplogruppe D als Ergebnis einer Mutation des Microcephalins entstand vor 37.000 Jahren im menschlichen Genom und verbreitete sich etwa gleichzeitig mit den ältesten Funden, die von der Beschäftigung des Menschen mit Kunst, Musik und Religion zeugen. Diese Mutation findet man heute bei etwa 70 % aller Menschen. Bei einer anderen Mutation entstand vor etwa 5.800 Jahren die Haplogruppe D des ASPM, etwa zeitgleich mit der ersten Zivilisation in Mesopotamien, von der auch die ältesten Schriftfunde der Menschheitsgeschichte stammen. Diese zweite Mutation hat sich bis heute bei 30 % der Weltbevölkerung durchgesetzt. Zusätzlich gibt es auch regionale Unterschiede. So kommt die Haplogruppe D des ASPM-Gens besonders in Europa und den angrenzenden Gebieten Asiens und Afrikas vor. Die Parallelität der beschriebenen Ereignisse wird von den Wissenschaftlern dahingehend interpretiert, dass beide Mutationen einen evolutionären Vorteil bieten müssen.[20]
- Erkrankungsrisiko bei Brustkrebs: Im Sommer 2006 haben Forscher um Naznee Rahman vom britischen Institut of cancer research in Surrey ein neues Brustkrebsgen mit der Bezeichnung BRIP-1 identifiziert. Dieses Gen codiert ein Protein, welches an der Reparatur von DNA-Schäden beteiligt ist. Eine zugleich entdeckte, selten vorkommende Mutation dieses Gens bewirkt, dass das BRIP-1-Protein diese Schutzfunktion nicht mehr ausführen kann. Bei einem Vorliegen dieser Mutation haben Frauen ein doppelt so hohes Brustkrebsrisiko wie andere mit einer normalen Version dieser Erbanlage. Mutationen der schon länger bekannten Gene BRCA1 und BRCA2 erhöhen dagegen das Erkrankungsrisiko um den Faktor 10 bis 20.[21]
Gartenbau
[Bearbeiten | Quelltext bearbeiten]Im Gartenbau wird eine Mutation, aus der eine neue Sorte entsteht, auch „Abart“ oder „Sport“ genannt.
Literatur
[Bearbeiten | Quelltext bearbeiten]- Wilfried Janning, Elisabeth Knust: Genetik: allgemeine Genetik, molekulare Genetik, Entwicklungsgenetik. Georg Thieme Verlag, Stuttgart/ New York 2004, ISBN 3-13-128771-3.
- Raymond Devoret: Mutation. In: Encyclopedia of Life Sciences. 2001, doi:10.1038/npg.els.0001882 (Volltextzugriff)
- Dennis Drayna: Genspuren der Menschheitsgeschichte. In: Spektrum der Wissenschaft. Januar 2006, S. 30 ff.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Herder Lexikon der Biologie 2004: Mutation w [von latein. mutatio = Veränderung; Verb mutieren], spontane, d. h. natürlich verursachte, oder durch Mutagene induzierte Veränderung des Erbguts (Veränderung der Basensequenz), die sich möglicherweise phänotypisch (Phänotyp; z. B. in Form einer „Degeneration“) manifestiert.
- ↑ Ernst Klee: Deutsche Medizin im Dritten Reich. Karrieren vor und nach 1945. S. Fischer, Frankfurt am Main 2001, ISBN 3-10-039310-4, S. 28–30 (Anfänge der Genetik).
- ↑ Rolf Knippers: Molekulare Genetik. Thieme, 1997, ISBN 3-13-477007-5: Mutationen sind vererbbare Veränderungen der genetischen Informationen.
- ↑ Douglas J. Futuyma: Evolutionsbiologie. Birkhäuser, Basel/ Boston/ Berlin 1990, S. 105.
- ↑ W. Seyffert: Genetik. 2. Auflage. Spektrum, 2003, ISBN 3-8274-1022-3
- ↑ Pschyrembel Klinisches Wörterbuch (online), abgerufen am 30. September 2009: Definition 1.(genet.): Veränderung des genetischen Materials (DNA oder RNA), die ohne erkennbare äußere Ursache (Spontanmutation) oder durch exogene Einflüsse (induzierte M.) entstehen kann;…
- ↑ Werner Buselmaier, Gholamali Tariverdian: Humangenetik. Begleittext zum Gegenstandskatalog. Springer Verlag Berlin/ Heidelberg/ New York 1991, ISBN 3-540-54095-4.
- ↑ William Hovanitz: Textbook of Genetics. Elsevier Press, Houston/ New York 1953, S. 190.„(…) if a change in structure (of chromosomes) is large enough to be visible in cytological preparations it is considered a chromosomal mutation. If it is too small to be readily observed, is known only from the genetic results of segregation and can be localized on a chromosome, it is known as a gene mutation. There is no sharp dividing line between gene mutations and chromosomal mutations. Eventually all gene mutations in their ultra-fine structure will be found to be structural, if only in the molecular arrangement of which the gene is composed.“
- ↑ Paul Diepgen, Heinz Goerke: Aschoff/Diepgen/Goerke: Kurze Übersichtstabelle zur Geschichte der Medizin. 7., neubearbeitete Auflage. Springer, Berlin/Göttingen/Heidelberg 1960, S. 54.
- ↑ Bernhard Kegel: Epigenetik. Köln 2010, S. 35.
- ↑ P.-O. Löwdin: Proton Tunneling in DNA and its Biological Implications. In: Reviews of Modern Physics. 35 (3), 1963, S. 724–732, doi:10.1103/RevModPhys.35.724.
- ↑ Ying Wang: Organisation of the cytoskeleton of the Drosophila oocyte. Köln 2007, DNB 988300672, Fundstelle: Letzter Satz im Abstract, urn:nbn:de:hbz:38-22940 (Dissertation, Universität Köln).
- ↑ Theodor Dingermann, Rudolf Hänsel, Ilse Zündorf: Pharmazeutische Biologie: Molekulare Grundlagen und klinische Anwendung. Springer, 2002, ISBN 3-540-42844-5, S. 425.
- ↑ B. Alberts u. a.: Molecular Biology of the Cell. 4. Auflage. 2002, S. 527.
- ↑ A. Goriely: Decoding germline de novo point mutations. In: Nat Genet. 48(8), 2016, S. 823–824, doi:10.1038/ng.3629, S. a. freien Volltext am Institut der Autorin (PDF, 302 KB, abgerufen am 15. September 2020)
- ↑ M. Lek u. a.: Analysis of protein-coding genetic variation in 60,706 humans. In: Nature. 536(7616), 2016, S. 285–291. doi:10.1038/nature19057
- ↑ Paul Diepgen, Heinz Goerke: Aschoff/Diepgen/Goerke: Kurze Übersichtstabelle zur Geschichte der Medizin. 7., neubearbeitete Auflage. Springer, Berlin/Göttingen/Heidelberg 1960, S. 63.
- ↑ Z. D. Blount, C. Z. Borland, R. E. Lenski: Historical contingency and the evolution of a key innovation in an experimental population of Escherichia coli. In: Proceedings of the National Academy of Sciences of the United States of America. Band 105, Nummer 23, Juni 2008, S. 7899–7906, doi:10.1073/pnas.0803151105. PMID 18524956, PMC 2430337 (freier Volltext).
- ↑ R. E. Lenski: Evolution in action: a 50,000-generation salute to Charles Darwin. In: Microbe. 6, 2011, S. 30–33, doi:10.1128/microbe.6.30.1 (freier Volltext).
- ↑ University of Chicago researchers find human brain still evolving. September 2005.
- ↑ Sheila Seal, Deborah Thompson u. a.: Truncating mutations in the Fanconi anemia J gene BRIP1 are low-penetrance breast cancer susceptibility alleles. In: Nature Genetics. 38, 2006, S. 1239–1241, doi:10.1038/ng1902.

