Microsporidia
| Microsporidia | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
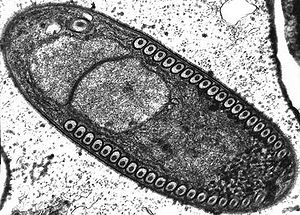
Fibrillanosema crangonycis | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Microsporidia | ||||||||||||
| Balbiani |
Die Microsporidia, auch Microspora oder Microsporea, sind einzellige, zu den Pilzen gehörende Parasiten und Erreger der Mikrosporidiasis. Sie können eine Größe von wenigen µm erreichen (2–12 µm). Microspora parasitieren meist intrazellulär bei Vertretern vieler Tierstämme, seltener in anderen Protisten aus der Sar genannten Klade der Eukaryoten. Eine Übertragung erfolgt durch Aufnahme einzelliger Sporen (meist oral, d. h. durch den Mund).
Lebenszyklus
[Bearbeiten | Quelltext bearbeiten]Mikrosporidien sind obligate Parasiten. Sie leben im Zellinneren einer Zelle ihres Wirts. Anders als viele andere Zellparasiten leben sie nicht in einer abgetrennten Vakuole, sondern direkt im Cytoplasma. Die Infektion erfolgt aus einer Spore, dem einzigen außerhalb der Wirtszelle vorkommenden Stadium. Das Cytoplasma (Sporoplasma genannt) des Parasiten ist von demjenigen der Wirtszelle durch seine Zellmembran getrennt, die oft noch eine Hülle vor allem aus komplexen Kohlenhydraten, Glycocalyx genannt, umgibt. Der Parasit schädigt in diesem Stadium die Wirtszelle zunächst nicht merklich (gelegentlich kommt es in Muskelfasern zu Funktionseinschränkungen), er vermehrt sich parallel zur Wirtszelle durch Zellteilung (Merogonie), das Stadium wird auch Meront genannt. Durch die Position innerhalb der Zelle ist er für das Immunsystem des Wirts unsichtbar. Die Parasitenzelle ist in ihrem Aufbau extrem reduziert und in basalen Zellfunktionen vollständig von der Wirtszelle abhängig. Sie enthält zunächst nur einen Zellkern (selten verdoppelt, Dikaryon), dicht gepackte Ribosomen und diverse, nicht zu Organellen organisierte Membranbestandteile, weder ein Golgi-Apparat noch funktionsfähige Mitochondrien sind erkennbar. Mitosomen genannte Organellen stellen reduzierte Relikte von Mitochondrien dar, in denen nur noch etwa 20 funktionale Proteine nachweisbar sind (normale Mitochondrien enthalten etwa 1000). Sie besitzen kein eigenständiges Genom mehr. Auch das Genom des Kerns der Mikrosporidien-Zelle ist hochgradig reduziert. Es sind nur noch etwa 2000 Gene vorhanden, so dass viele Stoffwechselprodukte aus der Wirtszelle übernommen werden müssen. So fehlen die Gene für die Nukleotid-Synthese und viele wesentliche Bestandteile der Atmungskette. Sie sind sogar teilweise auf den direkten Import von Adenosintriphosphat (ATP) aus der Wirtszelle zur Energieversorgung angewiesen, deren Stoffwechsel sie zu diesem Zweck anheizen. Obwohl auch die Ribosomen im Funktionsumfang reduziert sind, besitzt der Parasit extrem viele davon. Diese ermöglichen ihn ein sehr rasches Wachstum auf Kosten seines Wirts. Dessen Fähigkeit, sich gegen die Infektion durch programmierten Zelltod (Apoptose) zu wehren, wird durch Signalstoffe gezielt sabotiert. Im Ergebnis schwillt die infizierte Wirtszelle auf ein Vielfaches ihrer normalen Größe an. Einige Mikrosporidien (vor allem Fischparasiten) bilden im Inneren der, oft zu einem Syncytium verschmolzenen Wirtszellen riesige, mit Sporen gefüllte Einschlusskörper, die Xenosoma genannt werden.
Sehr schnell, oft innerhalb von drei Tagen nach der Infektion, beginnen die Mikrosporidien innerhalb der Wirtszelle mit der Produktion neuer Sporen. Das sporenbildende Stadium innerhalb der Zelle wird auch Sporont genannt. Bei den Gruppen, bei denen eine Meiose vorkommt, tritt diese unmittelbar vor der Sporenbildung auf. Die Sporen der Mikrosporidia dienen sowohl dazu, neue Zellen innerhalb des Wirts zu infizieren, als auch zur Infektion neuer Wirte. Für den Infektionsvorgang haben sie einen spezifischen Mechanismus entwickelt. Die Infektion neuer Zellen erfolgt über einen dünnen Infektionsschlauch, der, verglichen mit der Zelllänge, ungewöhnliche Länge erreichen kann (bis über 100 Mikrometer). Der Infektionsschlauch kann, wie eine Injektionsspritze, in Gewebe und Zellen eindringen, wo der Sporeninhalt durch einen massiven Druckanstieg innerhalb der Spore in den neuen Wirt überführt wird. Es werden normalerweise immer zwei Sporenarten gebildet, eine, die sehr schnell neue Zellen infiziert, und eine weitere, die dies erst zeitverzögert tut, bei einigen Mikrosporidienarten sind diese auch morphologisch unterscheidbar.
Die kompakt gebaute, meist runde, ovale, birnen- oder stäbchenförmige Spore besitzt eine dicke Zellwand, die zweilagig aufgebaut ist. Die innere (endospore) Lage besteht aus Proteinen und Chitin, die äußere nur aus Proteinen. Dabei dient die innere Lage vermutlich vor allem dazu, den extremen Druck, der bei der Infektion aufgebaut wird, zu widerstehen (es werden mehr als 7 Megapascal erreicht), die äußere dient zum Zellkontakt, zum Beispiel zur Wirtserkennung. Dazu besitzen sie oft stachelartige Fortsätze. Im Inneren der Spore befindet sich, neben dem Zellkern und wenig Cytoplasma, vor allem der Injektionsapparat, der den Infektionsschlauch ausbildet, und eine Polaroplast genannte Speicherorganelle für Membranbestandteile. Der Überdruck bei der Infektion wird durch eine Vakuole im hinteren Abschnitt erzeugt, die dazu rasch an Größe zunimmt und so Druck aufbaut. Der Infektionsschlauch am vorderen Ende der Spore wirkt fadenförmig, daher auch Polarfilament genannt, er ist meist schleifenartig aufgerollt. Beim Bienenparasiten Nosema apis ist die Spore 5 Mikrometer lang, der Injektionsschlauch (Polarfilament) in ihrem Inneren erreicht 300 Mikrometer Länge. Etwa ein Fünftel der Mikrosporidien-Gattungen besitzen stattdessen einen kurzen, stabartigen Injektionsschlauch, der nur etwa Sporenlänge erreicht. Bei ihnen ist er in einer pilzförmigen Struktur, der Polkappe, verankert. Hauptbestandteil des Infektionsschlauchs ist ein PTP1 genanntes Protein. Dieses erweist sich bei Wirten (auch beim Menschen) als starkes Antigen, so dass die gegen es gerichtete Immunantwort den Wirt resistent gegen Infektionen machen kann. Beim Infektionsvorgang wird der Zellinhalt durch die expandierende Vakuole in der Spore in den Schlauch gedrückt. Der Polaroplast, der im Ruhezustand vor allem aus eingefalteter Membran besteht, stellt das notwendige Material für die neue Zellmembran im Schlauch zur Verfügung. Der Infektionschlauch durchdringt angrenzendes Gewebe und andere Hindernisse, unter Einschluss möglicher anderer Mikrosporidien-Sporen, die im Weg wären.
Zahlreiche Arten von Mikrosporidien erzeugen mehrere Sporenformen, meist zwei (dimorph), selten drei oder mehr (polymorph). Unterschiedliche Formen dienen entweder alternativ der schnellen Infektion innerhalb eines Wirts und der verzögerten Keimung zur Infektion neuer Wirte, oder es werden bei verschiedenen Wirtsarten unterschiedliche Sporenformen ausgebildet. Bei anderen sehen alle Sporen gleich aus und unterscheiden sich nur in der Schnelligkeit der Keimbereitschaft. Neue Wirte werden durch langsam keimende Sporen infiziert, meist nach Aufnahme über den Mund und Verdauungstrakt (oral). Bei wasserlebenden Mikrosporidien gibt es hyperparasitische Arten, bei denen der Infektionsschlauch die Körper- oder Darmwand des Wirts durchdringt, um den im Inneren lebenden Parasiten zu parasitieren.
Die neu gebildeten Sporen gelangen meist durch den Kot, den Urin, oder erst nach dem Tod des Wirtes ins Freie. Bei vielen Wirten, darunter den meisten Wirbeltieren, verläuft die Infektion chronisch, so dass über lange Zeiträume Sporen ausgeschieden werden. Bei Insekten kommt es, nach verzögertem und oft relativ symptomlosen Beginn, auch zu schwerer verlaufenden Infektionen, die mit dem Tod des Wirts enden können. Auch bei den chronisch verlaufenden Infektionen ist meist die Lebensdauer und der Allgemeinzustand der Wirtsarten beeinträchtigt.
Wirtsbindung
[Bearbeiten | Quelltext bearbeiten]Die meisten Mikrosporidien-Arten sind wirtsspezifisch, sie befallen nur eine einzige Wirtsart oder wenige nahe verwandte Arten. Innerhalb des Wirts sind sie in der Regel auf bestimmte Gewebe spezialisiert. Mikrosporidien der Gattung Nosema, die Erreger der Nosemose, sind nicht nur spezialisiert auf Honigbienen der Gattung Apis, sondern befallen in diesen ausschließlich Zellen des Mitteldarms. Oft besitzen nahe verwandte Wirtsarten ihre jeweils eigenen, ebenso nahe verwandten Parasiten (genannt „Ko-Kladogenese“). In vielen Fällen ist die Wirtsspezifität durch Umweltfaktoren vorgegeben, d. h. unter experimentellen Bedingungen, im Labor, können auch Arten infiziert werden, bei denen dies im Freiland nie auftritt. Andere Arten besitzen ein weites Wirtsspektrum, z. B. alle Säugetiere, die sie opportunistisch nutzen.
Mikrosporidien-Infektionen gehören zu den häufigsten parasitischen Erkrankungen im Tierreich. Bei etwa der Hälfte der Stämme des Tierreichs wurden Mikrosporidien als Parasiten registriert. Besser untersucht sind aber nur die, relativ wenigen, Tiergruppen, bei denen die Infektion zu wirtschaftlichen oder gesundheitlichen Schäden führen, die für den Menschen bedeutsam sind. Es wird daher angenommen, dass weitaus die meisten Arten bis heute unentdeckt und unbeschrieben sind. Die meisten bekannten Wirtsarten gehören zu den Insekten und den Krebstieren. Mikrosporidien können erhebliche Schäden anrichten: Die Pébrine-Krankheit durch Nosema bombycis führte etwa Mitte des 19. Jahrhunderts zum Zusammenbruch der europäischen Seidenraupen-Zucht. Andere Arten, etwa Parasiten von Stechmücken besitzen aber als Regulatoren oder im Rahmen der biologischen Schädlingsbekämpfung auch positive Wirkungen für den Menschen. Etwa 160 Arten aus 17 Gattungen infizieren Fischarten. Beim Menschen als Wirt wurden 14 Mikrosporidien registriert, davon keine einzige wirtsspezifische. Arten der Gattung Endoreticulatus sind etwa opportunistische Erreger, die sowohl bei Menschen und anderen Wirbeltieren als auch bei Insekten-Arten vorkommen.
Wichtige Parasiten und ihre Wirte
[Bearbeiten | Quelltext bearbeiten]- Enterocytozoon bieneusi bei Schweinen und Menschen
- Glugea spp. bei Fischen
- Glugea anomala bei Stichlingen
- Glugea heraldi bei Seenadeln
- Nosema apis bei Bienen
- Septata sp. bei Menschen mit Immunschwäche
- Encephalitozoon cuniculi bei Kaninchen, Hunden und Mäusen
- Encephalitozoon intestinalis bei Menschen
- Encephalitozoon hellem bei Menschen
- Telohania contejani bei Crustacea
- Trachipleistophora hominis bei Menschen
- Vittaforma corneae bei Menschen
- Pleistophora spp. bei Fischen und Menschen
- Microsporidium ceylonenisis und Microsporidium africanum
- Brachioloa vesicularum bei Menschen
Microsporidiose ist der Oberbegriff für Krankheitsbilder durch diese Organismen.
Systematik und Nomenklatur
[Bearbeiten | Quelltext bearbeiten]Der nomenklatorische Status der Microsporidia ist nicht eindeutig. Sie wurden als Stamm nach den Internationalen Regeln für die Zoologische Nomenklatur (ICZN) behandelt (damals den Sporozoa zugeordnet), es herrscht jedoch Unklarheit über die Autor-Zitierung. Auch ist fraglich, ob der Name nach dem Internationalen Code der Botanischen Nomenklatur (ICN) gültig ist. Die Zugehörigkeit der Microsporidia zu den Pilzen und daher auch die Zuständigkeit des ICN hat sich 2007 ergeben. Die Zuordnung zu Balbiani (C. R. Acad. Sci Paris 95: S. 1168, 1882) ist daher vorläufig,[1] aber bis heute üblich.
Phylogenie
[Bearbeiten | Quelltext bearbeiten]Die Abteilung (oder Stamm, Phylum) Microsporidia bilden mit einer Klade von wenig bekannten Organismen um die Gattung Rozella (als Rozellida oder Cryptomycota bezeichnet) und den Aphelidea, einer artenarmen Gruppe von Parasiten einzelliger Algen, eine Gruppe, die Opisthosporidia benannt worden ist,[2][3] sie wird im klassischen System als Überstamm (Superphylum) eingeordnet. Die Opisthosporidia gehören zur Gruppe der Pilze (im weiteren Sinne).
Inzwischen wurde eine Reihe von Protisten gefunden, die zahlreiche Merkmale mit den Microsporidia gemeinsam hat, aber in einigen Merkmalen von diesen abweicht. Unter anderem existieren darin Vertreter mit weniger stark reduziertem Genom, die auch funktionsfähige Mitochondrien aufweisen. Zu dieser Gruppe zählen die Gattungen Mitosporidium, Paramicrosporidium und Nucleophaga. Eine weitere Gruppe, unter anderem Amphiamblys und Amphiacantha, als „Metchnikovelliden“ zusammengefasst, sind Hyperparasiten in, selbst parasitischen, Einzellern der Apicomplexa. Genetisch ähnlich sind zudem zahlreiche, bisher noch unbekannte Organismen, von denen nur ihre aus Umwelt-DNA gewonnene Basensequenz bekannt ist, ohne dass der zugehörige Organismus und dessen Biologie bisher bekannt geworden wäre; diese sind in Umweltproben teilweise sehr häufig. Fast die gesamte Gruppe, oft als Rozellomycota oder Cryptomycota zusammengefasst, erwies sich bei neueren Analysen als näher mit den Microsporidia als mit Rozella verwandt, so dass eine erweiterte Gruppe der Microsporidia unter Einschluss dieser Gruppen vorgeschlagen worden ist.[4]
Die Gliederung der Microsporidia in Gruppen ist nach bisherigem Wissensstand ungeklärt. Ein Vorschlag, sie, auch gestützt auf genetische Daten, in drei Klassen der Aquasporidia (vor allem im Süßwasser), Marinosporidia (vor allem marin) and Terresporidia (vor allem in terrestrischen Habitaten) einzuteilen[5] hat, aufgrund abweichender neuere Daten dazu, letztlich keine Akzeptanz gefunden.
Forschungsgeschichte
[Bearbeiten | Quelltext bearbeiten]In den 1850er Jahren verwüstete die Pébrine-Krankheit die europäische Seidenraupenzucht. Der Schweizer Forscher Carl Wilhelm von Nägeli entdeckte im Jahr 1857 darin infektiöse „Globuli“, die er als Nosema bombycis beschrieb. Ihre Lebensweise wurde dann 1870, vor allem durch den berühmten Louis Pasteur aufgeklärt und Gegenmaßnahmen empfohlen, so dass sich die Industrie erholte. Nägeli ordnete seinen Fund in die „Spaltpilze“ oder Schizomycetes, eine heute aufgegebene Zusammenfügung untereinander nicht näher verwandter „niederer“ Pilze und Bakterien, ein. Édouard-Gérard Balbiani stellte 1882 Nosema und Verwandte in die Gruppe der Sporozoa und prägte die Bezeichnung Microsporidia („microsporidies“). Er stellte für sie eine Gruppe der „Cnidosporidia“ auf, die außerdem einige nach heutiger Kenntnis nicht verwandte Gruppen, unter anderem die Myxozoa (nach heutiger Kenntnis Nesseltiere) umfasste.
Weitere Erkenntnisse zu den Microsporidia gelangen dann erst nach Erfindung der Elektronenmikroskopie in den 1950er Jahren. Nun wurde klar, dass den Microsporidia zahlreiche Merkmale fehlen, die sonst innerhalb der Tiere fast universell verbreitet sind. So kommen in den Zellen weder Mitochondrien noch ein Golgi-Apparat oder Peroxisomen vor, in keinem Lebensstadium existieren begeißelte Zellen mit Flagellum oder davon ableitbare Strukturen. Thomas Cavalier-Smith entwickelt daraufhin die Hypothese, die Microsporidia gehörten zu einer (paraphyletischen) Gruppe urtümlicher Eukaryoten, die sich vom gemeinsamen Stammbaum abgespalten hätten, noch bevor diese Strukturen evolviert seien. Diese „Archezoa“ genannte Gruppierung wurde auch von den ersten genetischen Analysen gut unterstützt. Mitte der 1990er Jahre entdeckten dann zahlreiche Arbeitsgruppen dicht nacheinander Merkmale vor allem verschiedener Proteinfamilien, die stattdessen eine nähere Verwandtschaft der Microsporidia mit den Pilzen nahelegten. Letztlich erwies sich die Unterstützung für die Archezoa durch bessere genetische Methoden als sogenanntes „Long-branch attraction“-Artefakt, bei dem sehr stark von den übrigen Gruppen abweichende DNA-Sequenzen vom Sortieralgorithmus irrtümlich nach außen abgedrängt werden und so eine basale Stellung vortäuschen. Eine Zeitlang war nun unklar, ob die Microsporidia als Schwestergruppe der Pilze aufgefasst werden sollten, oder ob sie zu den Pilzen zugehörig seien. Die neue Position wurde erst nach 2010, durch weiter verbesserte Analysemethoden und neu entdeckte Organismen der Verwandtschaftsgruppe, geklärt.[6]
Siehe auch
[Bearbeiten | Quelltext bearbeiten]Literatur
[Bearbeiten | Quelltext bearbeiten]- Jiří Vávra, Julius Lukeš: Microsporidia and ‘The Art of Living Together’. Chapter 4 in D. Rollinson, D. (Editor): Advances in Parasitology 82. Academic Press (Elsevier), 2013. S 253–320, ISBN 978-0-12-407706-5.
- Marianne Abele-Horn: Antimikrobielle Therapie. Entscheidungshilfen zur Behandlung und Prophylaxe von Infektionskrankheiten. Unter Mitarbeit von Werner Heinz, Hartwig Klinker, Johann Schurz und August Stich, 2., überarbeitete und erweiterte Auflage. Peter Wiehl, Marburg 2009, ISBN 978-3-927219-14-4, S. 292 f.
- Heinz Mehlhorn: Grundriss der Zoologie; Kapitel: Stämme und Baupläne. Spektrum Berlin Nachdruck 2001; S. 71 ff.
- Alexander Mathis et al.: Zoonotic Potential of the Microsporidia. Clinical Microbiology Reviews, July 2005, p. 423–445, Vol. 18, No. 3 PMID 16020683.
- Eva Heinz et al. „The Genome of the Obligate Intracellular Parasite Trachipleistophora hominis: New Insights into Microsporidian Genome Dynamics and Reductive Evolution.“ In: PLoS Pathogens 8.10 (2012): e1002979. doi:10.1371/journal.ppat.1002979
- Louis M. Weiss, James J. Becnel (Hrsg.): Microsporidia: Pathogens of Opportunity. [728-seitiges Referenzwerk]. Wiley-Blackwell, 2014, ISBN 978-1-118-39522-6 (Print), ISBN 978-1-118-39526-4 (E-Book).
Weblinks
[Bearbeiten | Quelltext bearbeiten]- Microsporidia Infection (Microsporidiosis), auf: Medic8
- Edward G. LeBrun et al.: Pathogen-mediated natural and manipulated population collapse in an invasive social insect. In: PNAS, Band 119, Nr. 14, 28. März 2022, e2114558119; doi:10.1073/pnas.2114558119. Dazu:
Jan Osterkamp: Invasive Arten: Winziges Mittel gegen unbesiegbare Ameisen, auf: spektrum.de vom 29. März 2022
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ D. S. Hibbett et al.: A higher-level phylogenetic classification of the Fungi. In: Mycological research, Mai 2007; 111(5): 509-547. Epub 2007 13. März 2007. PMID 17572334
- ↑ Sergey A. Karpov, Maria A. Mamkaeva, Vladimir V. Aleoshin, Elena Nassonova, Osu Lilje Frank H. Gleason (2014): Morphology, phylogeny, and ecology of the aphelids (Aphelidea, Opisthokonta) and proposal for the new superphylum Opisthosporidia. Frontiers in Microbiology 5:112. doi:10.3389/fmicb.2014.00112
- ↑ Sina M. Adl et al. (2018): Revisions to the Classification, Nomenclature, and Diversity of Eukaryotes. Journal of Eukaryotic Microbiology 66: 4–119. doi:10.1111/jeu.12691
- ↑ David Bass, Lucas Czech, Bryony A. P. Williams, Cedric Berney, Micah Dunthorn, Frederic Mahe, Guifre Torruella, Grant D. Stentiford, Tom A. Williams (2018): Clarifying the Relationships between Microsporidia and Cryptomycota. Journal of Eukaryotic Microbiology 65: 773–782. doi:10.1111/jeu.12519
- ↑ Charles R. Vossbrinck & Bettina A. Debrunner-Vossbrinck (2005): Molecular phylogeny of the Microsporidia: ecological, ultrastructural and taxonomic considerations. Folia Parasitologica 52: 131–142.
- ↑ Abschnitt nach: Nicolas Corradi & Patrick J. Keeling (2009): Microsporidia: a journey through radical taxonomical revisions. Fungal Biology Reviews 23: 1-8. doi:10.1016/j.fbr.2009.05.001