„COVID-19-Impfstoff“ – Versionsunterschied
| [gesichtete Version] | [gesichtete Version] |
→Einleitung: Die breite Bevölkerung kennt die Impfstoffe unter diesen Namen. Sorgt sonst nur für Verwirrung. |
|||
| Zeile 5: | Zeile 5: | ||
Man unterscheidet zwischen [[Impfung|Aktiv-Impfstoffen]], die nach ein bis zwei Wochen eine längerfristige Immunantwort gegen das Virus im Geimpften auslösen und [[Immunserum|Passiv-Impfstoffen]] mit [[Antikörper]]n, die (meist zu [[Therapie|therapeutischen]] Zwecken) sofort und direkt gegen COVID-19 [[Immunität (Medizin)|immunisieren]], aber nur wenige Wochen vor einer Erkrankung schützen. |
Man unterscheidet zwischen [[Impfung|Aktiv-Impfstoffen]], die nach ein bis zwei Wochen eine längerfristige Immunantwort gegen das Virus im Geimpften auslösen und [[Immunserum|Passiv-Impfstoffen]] mit [[Antikörper]]n, die (meist zu [[Therapie|therapeutischen]] Zwecken) sofort und direkt gegen COVID-19 [[Immunität (Medizin)|immunisieren]], aber nur wenige Wochen vor einer Erkrankung schützen. |
||
Wie alle [[Arzneimittel]] werden auch COVID-19-Impfstoffe vor ihrer Anwendung einer umfassenden [[Klinische Studie|klinischen Prüfung]] unterzogen, bevor die [[Arzneimittelzulassung]] beantragt werden kann. Obwohl dieser Prozess bei den Corona-Impfstoffen schneller als üblich erfolgte, wurde hierbei kein Prüfschritt ausgelassen, verkürzt oder vereinfacht. Der Grund für die Schnelligkeit lag stattdessen insbesondere in neuer, verbesserter Technologie, bereits bestehendem Vorwissen durch [[SARS-CoV|SARS-CoV-1]], erheblicher finanzieller Unterstützung und der parallelen Durchführung der Prüfphasen (siehe auch [[Arzneimittelzulassung#Notfallverfahren|''Rolling-Review''-Verfahren]]). Erst, wenn eine signifikante [[Impfstoffwirksamkeit|Wirksamkeit]] bzw. [[Immunogenität]] nachgewiesen wurde und schwere [[Nebenwirkung]]en ausgeschlossen werden können, erfolgt die Zulassung.<ref name=":1">[https://www.ema.europa.eu/en/events/public-stakeholder-meeting-development-authorisation-safe-effective-covid-19-vaccines-eu ''Public stakeholder meeting: development and authorisation of safe and effective COVID-19 vaccines in the EU''], EMA, 11. Dezember 2020.</ref><ref name=":2">{{Internetquelle |url=https://www.quarks.de/gesundheit/medizin/so-lange-braucht-die-entwicklung-eines-coronavirus-impfstoffs/ |titel=Corona: Wann gibt es einen Impfstoff? |werk=quarks.de |datum=2020-12-17 |abruf=2020-12-20 |sprache=de-DE}}</ref> Mit Stand vom 2. Dezember 2020 waren weltweit 51 Vakzine in der klinischen Prüfung, davon 13 in der abschließenden [[Klinische Studie#Phasen einer Arzneimittelstudie|Phase-III-Studie]], darunter auch die [[Viraler Vektor#Impfstoffe|Vektorimpfstoffe]] [[AZD1222]] und [[Ad26.COV2.S]].<ref>{{Internetquelle |autor=WHO |url=https://www.who.int/docs/default-source/blue-print/novel-coronavirus_landscape_covid-19abff2b57-1a18-47d2-933f-ac9745f9954f.pdf?sfvrsn=4c05a230_1&download=true |titel=Draft landscape of COVID-19 candidate vaccines |titelerg=(PDF) |werk=Website der [[World Health Organization]] (WHO) |hrsg=WHO |datum=2020-12-02 |abruf=2020-12-03 |format=PDF |sprache=en |kommentar=Spezifikationen und Links zu weiteren Infos über alle von der WHO aufgelisteten Impfstoffkandidaten}}</ref> |
Wie alle [[Arzneimittel]] werden auch COVID-19-Impfstoffe vor ihrer Anwendung einer umfassenden [[Klinische Studie|klinischen Prüfung]] unterzogen, bevor die [[Arzneimittelzulassung]] beantragt werden kann. Obwohl dieser Prozess bei den Corona-Impfstoffen schneller als üblich erfolgte, wurde hierbei kein Prüfschritt ausgelassen, verkürzt oder vereinfacht. Der Grund für die Schnelligkeit lag stattdessen insbesondere in neuer, verbesserter Technologie, bereits bestehendem Vorwissen durch [[SARS-CoV|SARS-CoV-1]], erheblicher finanzieller Unterstützung und der parallelen Durchführung der Prüfphasen (siehe auch [[Arzneimittelzulassung#Notfallverfahren|''Rolling-Review''-Verfahren]]). Erst, wenn eine signifikante [[Impfstoffwirksamkeit|Wirksamkeit]] bzw. [[Immunogenität]] nachgewiesen wurde und schwere [[Nebenwirkung]]en ausgeschlossen werden können, erfolgt die Zulassung.<ref name=":1">[https://www.ema.europa.eu/en/events/public-stakeholder-meeting-development-authorisation-safe-effective-covid-19-vaccines-eu ''Public stakeholder meeting: development and authorisation of safe and effective COVID-19 vaccines in the EU''], EMA, 11. Dezember 2020.</ref><ref name=":2">{{Internetquelle |url=https://www.quarks.de/gesundheit/medizin/so-lange-braucht-die-entwicklung-eines-coronavirus-impfstoffs/ |titel=Corona: Wann gibt es einen Impfstoff? |werk=quarks.de |datum=2020-12-17 |abruf=2020-12-20 |sprache=de-DE}}</ref> Mit Stand vom 2. Dezember 2020 waren weltweit 51 Vakzine in der klinischen Prüfung, davon 13 in der abschließenden [[Klinische Studie#Phasen einer Arzneimittelstudie|Phase-III-Studie]], darunter auch die [[Viraler Vektor#Impfstoffe|Vektorimpfstoffe]] ''[[AZD1222]]'' und ''[[Ad26.COV2.S]]''.<ref>{{Internetquelle |autor=WHO |url=https://www.who.int/docs/default-source/blue-print/novel-coronavirus_landscape_covid-19abff2b57-1a18-47d2-933f-ac9745f9954f.pdf?sfvrsn=4c05a230_1&download=true |titel=Draft landscape of COVID-19 candidate vaccines |titelerg=(PDF) |werk=Website der [[World Health Organization]] (WHO) |hrsg=WHO |datum=2020-12-02 |abruf=2020-12-03 |format=PDF |sprache=en |kommentar=Spezifikationen und Links zu weiteren Infos über alle von der WHO aufgelisteten Impfstoffkandidaten}}</ref> |
||
Bereits im August 2020 wurde in Russland der Impfstoff [[Gam-COVID-Vac]] („Sputnik V“) zugelassen; hier jedoch noch vor Abschluss aller Prüfungsphasen. Für die passive Immunisierung wurden in den USA Notfallzulassungen für drei Antikörper-Präparate erteilt. |
Bereits im August 2020 wurde in Russland der Impfstoff [[Gam-COVID-Vac]] („Sputnik V“) zugelassen; hier jedoch noch vor Abschluss aller Prüfungsphasen. Für die passive Immunisierung wurden in den USA Notfallzulassungen für drei Antikörper-Präparate erteilt. |
||
Im Dezember 2020 erhielten die [[RNA-Impfstoff]]e ''[[BNT162b2]]'' von [[BioNTech]] / [[Pfizer]] (u. a. in Großbritannien, den USA, Kanada und Israel)<ref>{{Internetquelle |url=https://www.deutsche-apotheker-zeitung.de/news/artikel/2020/12/14/biontech-pfizer-erhalten-notfallzulassung-fuer-ersten-covd-19-impfstoff-in-den-usa |titel=Biontech/Pfizer erhalten Notfallzulassung für ersten COVID-19-Impfstoff in den USA |werk=Deutsche Apotheker Zeitung |datum=2020-12-14 |abruf=2020-12-20}}</ref> und ''[[mRNA-1273]]'' von [[Moderna]] (in den USA)<ref>{{Internetquelle |url=https://www.stern.de/gesundheit/notfallzulassung--moderna-impfstoff-wird-in-den-usa-ausgeliefert-9539988.html |titel=Notfallzulassung erteilt: Moderna-Impfstoff wird in den USA ausgeliefert |werk=Stern |abruf=2020-12-20 |sprache=de}}</ref> eine [[Arzneimittelzulassung#Notfallverfahren|Notfallzulassung]]. |
Im Dezember 2020 erhielten die [[RNA-Impfstoff]]e ''[[BNT162b2]]'' von [[BioNTech]] / [[Pfizer]] (u. a. in Großbritannien, den USA, Kanada und Israel)<ref>{{Internetquelle |url=https://www.deutsche-apotheker-zeitung.de/news/artikel/2020/12/14/biontech-pfizer-erhalten-notfallzulassung-fuer-ersten-covd-19-impfstoff-in-den-usa |titel=Biontech/Pfizer erhalten Notfallzulassung für ersten COVID-19-Impfstoff in den USA |werk=Deutsche Apotheker Zeitung |datum=2020-12-14 |abruf=2020-12-20}}</ref> und ''[[mRNA-1273]]'' von [[Moderna]] (in den USA)<ref>{{Internetquelle |url=https://www.stern.de/gesundheit/notfallzulassung--moderna-impfstoff-wird-in-den-usa-ausgeliefert-9539988.html |titel=Notfallzulassung erteilt: Moderna-Impfstoff wird in den USA ausgeliefert |werk=Stern |abruf=2020-12-20 |sprache=de}}</ref> eine [[Arzneimittelzulassung#Notfallverfahren|Notfallzulassung]]. Beide gelten als sehr wirksam, sicher und gut verträglich.<ref>{{Literatur |Autor=Fernando P. Polack et al. |Titel= Safety and Efficacy of the BNT162b2 mRNA Covid-19 Vaccine |Hrsg= |Sammelwerk=The New England Journal of Medicine |Band=|Nummer= |Datum=2020-12 |DOI=10.1056/NEJMoa2034577 |Seiten=}}</ref> In der Schweiz erhielt das Vakzin ''BNT162b2'' im Dezember 2020 die erste reguläre Impfstoffzulassung,<ref name="swissmedic-2020-12-19">{{Internetquelle |url=https://www.swissmedic.ch/swissmedic/de/home/news/coronavirus-covid-19/covid-19-impfstoff_erstzulassung.html |titel=Swissmedic erteilt Zulassung für den ersten Covid-19-Impfstoff in der Schweiz |hrsg=Swissmedic |datum=2020-12-19 |abruf=2020-12-19}}</ref> am 21. Dezember 2020 folgte die (bedingte) Zulassung in der gesamten EU.<ref name=":3">{{Internetquelle |autor= |url=https://www.bundesregierung.de/breg-de/themen/coronavirus/eu-impfstoff-zulassung-1830812|titel=EU-Kommission erteilt Zulassung für erste Corona-Impfung |titelerg= |werk= |hrsg=bundesregierung.de |datum= |abruf=2020-12-22}}</ref><ref>[https://www.aerztezeitung.de/Politik/Corona-Impfstoff-wohl-noch-vor-Heiligabend-zugelassen-415634.html ''Corona-Impfstoff: Zulassung wohl noch vor Heiligabend.''] … für den ersten COVID-19-Impfstoff in Westeuropa. Auf: ''aerztezeitung.de''; abgerufen am 15. Dezember 2020.</ref> |
||
In der Schweiz erhielt das Vakzin ''BNT162b2'' im Dezember 2020 die Impfstofferstzulassung.<ref name="swissmedic-2020-12-19"> |
|||
{{Internetquelle |url=https://www.swissmedic.ch/swissmedic/de/home/news/coronavirus-covid-19/covid-19-impfstoff_erstzulassung.html |titel=Swissmedic erteilt Zulassung für den ersten Covid-19-Impfstoff in der Schweiz |hrsg=Swissmedic |datum=2020-12-19 |abruf=2020-12-19}}</ref> am 21. Dezember 2020 folgte die bedingte Marktzulassung in der EU.<ref name=":3">{{Internetquelle |autor= |url=https://www.bundesregierung.de/breg-de/themen/coronavirus/eu-impfstoff-zulassung-1830812|titel=EU-Kommission erteilt Zulassung für erste Corona-Impfung |titelerg= |werk= |hrsg=bundesregierung.de |datum= |abruf=2020-12-22}}</ref><ref>[https://www.aerztezeitung.de/Politik/Corona-Impfstoff-wohl-noch-vor-Heiligabend-zugelassen-415634.html ''Corona-Impfstoff: Zulassung wohl noch vor Heiligabend.''] … für den ersten COVID-19-Impfstoff in Westeuropa. Auf: ''aerztezeitung.de''; abgerufen am 15. Dezember 2020.</ref> |
|||
Das Wissenschaftsmagazin ''[[Science]]'' erklärte die Entwicklung von Impfstoffen gegen das SARS-CoV-2 in nie dagewesener Geschwindigkeit zum [[Breakthrough of the Year]], dem wissenschaftlichen Durchbruch des Jahres.<ref>{{Internetquelle |autor=Jon Cohen |url=https://vis.sciencemag.org/breakthrough2020/ |titel=Science's Breakthrough of the Year 2020: shots of hope in a pandemic-ravaged world |werk=sciencemag.org |hrsg=Science |datum=2020-12-17 |abruf=2020-12-18 |sprache=en}}</ref> |
Das Wissenschaftsmagazin ''[[Science]]'' erklärte die Entwicklung von Impfstoffen gegen das SARS-CoV-2 in nie dagewesener Geschwindigkeit zum [[Breakthrough of the Year]], dem wissenschaftlichen Durchbruch des Jahres.<ref>{{Internetquelle |autor=Jon Cohen |url=https://vis.sciencemag.org/breakthrough2020/ |titel=Science's Breakthrough of the Year 2020: shots of hope in a pandemic-ravaged world |werk=sciencemag.org |hrsg=Science |datum=2020-12-17 |abruf=2020-12-18 |sprache=en}}</ref> |
||
Version vom 24. Dezember 2020, 02:09 Uhr

Ein SARS-CoV-2-Impfstoff (auch als COVID-19-Impfstoff, SARS-Coronavirus-2-Impfstoff oder nur als Corona-Impfstoff bezeichnet) ist ein Impfstoff (Vakzin) gegen das Virus SARS-CoV-2. Ziel der Impfstoffentwicklung ist es, durch Impfung eine adaptive Immunantwort im Geimpften zu erzeugen, die vor einer Infektion mit dem Virus und damit vor der Erkrankung COVID-19 schützt.
Man unterscheidet zwischen Aktiv-Impfstoffen, die nach ein bis zwei Wochen eine längerfristige Immunantwort gegen das Virus im Geimpften auslösen und Passiv-Impfstoffen mit Antikörpern, die (meist zu therapeutischen Zwecken) sofort und direkt gegen COVID-19 immunisieren, aber nur wenige Wochen vor einer Erkrankung schützen.
Wie alle Arzneimittel werden auch COVID-19-Impfstoffe vor ihrer Anwendung einer umfassenden klinischen Prüfung unterzogen, bevor die Arzneimittelzulassung beantragt werden kann. Obwohl dieser Prozess bei den Corona-Impfstoffen schneller als üblich erfolgte, wurde hierbei kein Prüfschritt ausgelassen, verkürzt oder vereinfacht. Der Grund für die Schnelligkeit lag stattdessen insbesondere in neuer, verbesserter Technologie, bereits bestehendem Vorwissen durch SARS-CoV-1, erheblicher finanzieller Unterstützung und der parallelen Durchführung der Prüfphasen (siehe auch Rolling-Review-Verfahren). Erst, wenn eine signifikante Wirksamkeit bzw. Immunogenität nachgewiesen wurde und schwere Nebenwirkungen ausgeschlossen werden können, erfolgt die Zulassung.[1][2] Mit Stand vom 2. Dezember 2020 waren weltweit 51 Vakzine in der klinischen Prüfung, davon 13 in der abschließenden Phase-III-Studie, darunter auch die Vektorimpfstoffe AZD1222 und Ad26.COV2.S.[3]
Bereits im August 2020 wurde in Russland der Impfstoff Gam-COVID-Vac („Sputnik V“) zugelassen; hier jedoch noch vor Abschluss aller Prüfungsphasen. Für die passive Immunisierung wurden in den USA Notfallzulassungen für drei Antikörper-Präparate erteilt.
Im Dezember 2020 erhielten die RNA-Impfstoffe BNT162b2 von BioNTech / Pfizer (u. a. in Großbritannien, den USA, Kanada und Israel)[4] und mRNA-1273 von Moderna (in den USA)[5] eine Notfallzulassung. Beide gelten als sehr wirksam, sicher und gut verträglich.[6] In der Schweiz erhielt das Vakzin BNT162b2 im Dezember 2020 die erste reguläre Impfstoffzulassung,[7] am 21. Dezember 2020 folgte die (bedingte) Zulassung in der gesamten EU.[8][9]
Das Wissenschaftsmagazin Science erklärte die Entwicklung von Impfstoffen gegen das SARS-CoV-2 in nie dagewesener Geschwindigkeit zum Breakthrough of the Year, dem wissenschaftlichen Durchbruch des Jahres.[10]
Vorgeschichte
Impfstoffe sind die effektivsten präventiven Maßnahmen gegen Infektionskrankheiten.[11] Bereits seit Jahren wird daher an Impfstoffen gegen Coronaviren geforscht, unter anderem gegen HCoV-HKU1, HCoV-NL63, HCoV-OC43, HCoV-229E, SARS-CoVund MERS-CoV. Es gibt verschiedene verfügbare Impfstoffe für Tiere gegen Coronaviren, beispielsweise gegen das Aviäre Coronavirus (bei Vögeln)[12], das Canine Coronavirus (bei Hunden)[13] und das Feline Coronavirus (bei Katzen)[14]. Für die humanpathogenen Coronaviren SARS-CoV[15] und MERS-CoV[16] existieren experimentelle Impfstoffe, die im Tierversuch getestet wurden.[17][18] Gegen SARS-CoV[17][18] und gegen MERS-CoV[19] wurden bis 2019 insgesamt vier Impfstoffe am Menschen mit abgeschlossenen klinischen Studien untersucht.[20][21][22][23] Alle vier Impfstoffe waren sicher und immunogen.[24] Sechs weitere Impfstoffe befanden sich 2019 in klinischen Studien.[24] Keiner hat jedoch bisher eine Arzneimittelzulassung für den Menschen.[25] Gründe dafür liegen beim MERS-CoV im Fehlen kostengünstiger Tiermodelle, im nur noch sporadischen und lokalen Vorkommen des Virus und in der daraus resultierenden fehlenden Investitionsbereitschaft.[25] Bei SARS-CoV traten nach 2004 keine neuen Infektionen mehr auf.[25] Erst mit der COVID-19-Pandemie ab 2020 wurden Coronavirusimpfstoffe wieder dringlich. Dank der oben genannten, bereits erfolgten Forschung konnte hierbei auf bestehendem Wissen aufgebaut und so schnell ein Impfstoff auch gegen SARS-CoV-2 entwickelt werden. Hierbei wurde auch auf die neue Technologie der RNA-Impfstoffe gesetzt, die aus einer Messenger-RNA (mRNA) bestehen, die für eines oder mehrere virale Proteine codieren. Dadurch wird die Immunabwehr des Geimpften im Falle einer tatsächlichen Infektion vor dem natürlichen Erreger geschützt.[26] Deren Entwicklung und Herstellung kann wesentlich schneller vonstatten gehen als bei herkömmlichen Impfstoffen.
Immunologie

Zentrale Antigene des SARS-CoV-2 (also die „Andockstellen“ für die Antikörper) bei der Impfstoffentwicklung sind zwei Proteine der Virushülle, das S-Glykoprotein (Spike-Glykoprotein, das virale Andockprotein auf der Oberfläche des SARS-CoV-2) und das Membranprotein (M) sowie das Nukleokapsidprotein im Virusinneren.
Das Virus gehört zur Ordnung Nidovirales, Familie der Coronaviren (Coronaviridae), der Unterfamilie der Orthocoronavirinae sowie dem Subgenus der Sarbecoviren (ebenso wie SARS-CoV). Es handelt sich somit um ein behülltes, nicht-segmentiertes RNA-Virus.[27] Gegen zwei Proteine der Virushülle (S-Glykoprotein und Membranprotein) des SARS-CoV wurden neutralisierende Antikörper beschrieben.[27] Neutralisierende Antikörper gegen das S-Glykoprotein sind hauptsächlich für einen Schutz vor Infektion durch SARS- oder MERS-CoV verantwortlich, jedoch ist die Ursache für einen Schutz vermutlich vom Impfstofftyp, den verwendeten Antigenen, den Tiermodellen und der Applikationsform abhängig.[28] Konservierte Epitope wurden im S-Glykoprotein und im Nukleokapsidprotein identifiziert, die sich für breitenwirksame Impfstoffe eignen könnten.[29] Es gibt in Mäusen eine Kreuzreaktivität von neutralisierenden Antikörpern gegen das S-Glykoprotein, die sowohl den Zelleintritt von SARS-CoV als auch von SARS-CoV-2 hemmen.[30] Beide SARS-assoziierte Viren verwenden den gleichen Rezeptor zum Zelleintritt, das Angiotensin-konvertierende Enzym 2 (ACE2), während MERS-CoV die Dipeptidylpeptidase 4 (CD26) verwendet.[31] Zahlreiche ACE-2-Rezeptoren finden sich beim Menschen auch im Darmbereich, in Gefäßzellen, in der Herzmuskulatur sowie in der Niere. Das S-Glykoprotein wird in zwei Untereinheiten unterteilt, S1 und S2. S1 enthält die Rezeptorbindungsdomäne und bedingt die Bindung an die Wirtszelle. S2 ist für die Fusion mit der Zellmembran verantwortlich. Die Bindungsaffinität des SARS-CoV-2 zum ACE-2-Rezeptor ist etwa 10 bis 20 mal so stark wie die des SARS-CoV.[32] Es gab im März 2020 keine monoklonalen Antikörper gegen die Rezeptor-bindende Proteindomäne (RBD) des S-Glykoproteins von SARS-CoV, die nennenswerte Bindungsaffinität gegen SARS-CoV-2 aufwiesen.[33] Im S-Glykoprotein des SARS-CoV-2 wurden 13 Epitope für MHC I (erzeugen eine zelluläre Immunantwort) und 3 für MHC II (erzeugen eine humorale Immunantwort) identifiziert.[34]
Ein Problem bei der Impfstoffentwicklung ist die hohe Mutationsrate von einigen RNA-Viren, wodurch der Impfstoff wie beim Influenzaimpfstoff fortlaufend an die sich verändernden zirkulierenden Virusstämme angepasst werden muss oder nur einen Teil der zirkulierenden Virusstämme abdeckt.[35] Die Rezeptor-bindende Proteindomäne des S-Glykoproteins (als Antigen zur Erzeugung neutralisierender Antikörper) ist der variabelste Teil des SARS-CoV-2.[35] Der Stamm D614G ist mit etwa 85 % der im November 2020 dominierende globale SARS-CoV-2 Stamm.[36] Fast alle Stämme mit dieser D614G-Mutation zeigen auch Mutationen in Replikationsproteinen wie beispielsweise ORF1ab P4715L und RdRp P323L. Diese wiederum sind die Angriffspunkte für einige Medikamente wie Remdesivir und Favipiravir.[37]
Ein weiteres Problem ist, dass bei SARS-CoV und MERS-CoV infektionsverstärkende Antikörper (gegen Proteine in der Virushülle) beschrieben wurden,[38] die unerwünscht sind und bei SARS-CoV-2 vermutet werden können.[35] Zur Vermeidung infektionsverstärkender Antikörper gegen das S-Glykoprotein kann vermutlich mit verkürzten Varianten immunisiert werden, wie die RBD oder die S1-Untereinheit des S-Glykoproteins.[28] Ein drittes Problem ist, dass bei einem Impfstoff gegen SARS-CoV eine Immunpathogenese der Lungenbläschen durch die Einwanderung von Eosinophilen und Typ-2-T-Helferzellen beobachtet wurde, die bei SARS-CoV-2-Impfstoffen vermutet werden kann.[39] Die Immunpathogenese konnte bei einem SARS-CoV-Impfstoff durch Zugabe eines bestimmten Adjuvans (ein delta-Inulin-basiertes Polysaccharid) vermieden werden.[40][28] Daher sind Kriterien für die Impfstoffentwicklung von SARS-CoV-2-Impfstoffen: die Minimierung unerwünschter Immunreaktionen, eine Eignung für die Impfung erwachsener Mitarbeiter im Gesundheitssystem, eine Eignung für die Impfung von Menschen mit Risikofaktoren (Menschen über 60 Jahren oder mit Diabetes mellitus oder Bluthochdruck) und eine Eignung zur Bevorratung,[41] wie sie in der Priorisierung der COVID-19-Impfmaßnahmen diskutiert werden.
Beginn der Entwicklung
Ab Ende Januar 2020 begannen unter anderem das Chinesische Zentrum für Krankheitskontrolle und Prävention,[42][43] die Universität Hongkong (nasal angewendet),[44] das Shanghai-Ost-Krankenhaus[44] und verschiedene andere Universitäten wie die Washington University in St. Louis[45] mit der Entwicklung eines Impfstoffes. Sechs Impfstoffentwickler wurden im März 2020 von der Coalition for Epidemic Preparedness Innovations (CEPI) unterstützt, darunter Curevac,[46] Moderna (zusammen mit dem National Institute of Allergy and Infectious Diseases),[47][48] Inovio Pharmaceuticals (zusammen mit dem Wistar Institute und Beijing Advaccine Biotechnology),[48] die University of Queensland (zusammen mit dem Adjuvantienhersteller Dynavax),[48] die University of Oxford[48] und Novavax.[48] Anfang März 2020 kündigte CEPI die Bereitstellung von zwei Milliarden US-Dollar zur Entwicklung von SARS-CoV-2-Impfstoffen an, die durch verschiedene öffentliche und private Organisationen finanziert werden, darunter unter Beteiligung von Deutschland, Dänemark, Finnland, Großbritannien und Norwegen.[49] Anfang März 2020 wurde berichtet, dass die ersten klinischen Studien der Phase 1 eines SARS-CoV-2-Impfstoffs des Biotechnologieunternehmens Moderna voraussichtlich bald beginnen würden.[50][51]
Stand der Entwicklung (klinische Studien: Phase 3)
Europa/USA
Impfstoffe auf Basis von Boten-RNA
Sowohl der von BioNTech und Pfizer entwickelte Impfstoff BNT162b2 als auch das von Moderna entwickelte Vakzin mRNA-1273 geben den Körperzellen eine mRNA-Vorlage zur Herstellung des Spike-Proteins von SARS-CoV-2 (siehe RNA-Impfstoff).
Im Vergleich zu den Proteinen oder Proteinfragmenten, aus denen herkömmliche Impfstoffe häufig bestehen, spaltet sich der Impfstoff leicht bei Raumtemperatur. Die Impfstoffdosen müssen deshalb für den Transport eingefroren und dann zur Verwendung aufgetaut werden. Der von Moderna entwickelte Impfstoff verträgt – im Gegensatz zu dem von BioNTech/Pfizer entwickelten Impfstoff, der bei −70 °C gelagert werden muss – auch Temperaturen über −20 °C; diese Lagertemperatur ist Standard für die meisten in Krankenhäusern und Apotheken verwendeten Gefrierschränke. Auch in Ländern und Regionen, in denen es an ultrakalten Gefriergeräten mangelt, wären Verteilung und Lagerung eines solche Impfstoffes, wie des von Moderna entwickelten, deshalb einfacher möglich. Tatsächlich sind die Temperaturanforderungen für Lagerung und Transport dieser RNA-Impfstoffe nach Aussage von Barney Graham – dem Impfstoffforscher am US-amerikanischen National Institute of Allergy and Infectious Diseases, der die von Moderna und Pfizer/BioNTech verwendete mRNA entwickelt hat – jedoch noch unklar.[52]
BNT162b2 (BioNTech/Pfizer)

Die deutsche Firma BioNTech entwickelte den Impfstoff BNT162b2 auf Basis von Boten-RNA (mRNA). Dabei kooperierte BioNTech mit der amerikanischen Firma Pfizer und dem Unternehmen Fosun Pharma, einem Mainzer Start-up, das von China insgesamt 120 Mio. Euro für die Forschung und Entwicklung eines Impfstoffes gegen Covid-19 erhielt.[53] Für den Schutz gegen eine Infektion mit dem Corona-Virus SARS-CoV-2 sind zwei Dosen des Impfstoffs im Abstand von drei Wochen notwendig. Herstellerangaben zufolge soll bereits 28 Tage nach der ersten Impfung ein Schutz von 95 Prozent erreicht werden.[54]
Im April 2020 erhielt der Impfstoff die benötigten Genehmigungen des Paul-Ehrlich-Instituts sowie der Ethik-Kommission der Landesärztekammer Baden-Württemberg für die klinische Prüfung bzw. die First-in-human-Studie in Deutschland.[55][48][56][57] Die Notfallzulassung in den USA wurde am 20. November 2020 beantragt. Auch weiteren Arzneimittelbehörden weltweit sollen die Studienergebnisse zur Verfügung gestellt werden.[58] Nachdem die Europäische Arzneimittel-Agentur (EMA) die Überprüfung von BNT162b2 Anfang Oktober 2020 in einem „Rolling-Review“-Verfahren begonnen hatte,[59] stellten Biontech/Pfizer am 1. Dezember einen Zulassungsantrag in der EU.[60] Das „Rolling-Review“-Verfahren steht der EMA als Notfallverfahren im Bereich der öffentlichen Gesundheit zur Verfügung, um die Daten vielversprechender Arzneimittel zu bewerten, sobald diese auf fortlaufender Basis verfügbar sind. In Einzelfällen kann die EMA eine bedingte Zulassung empfehlen, noch bevor die Daten der klinischen Prüfung vollständig vorliegen. Der Ausschuss für Humanarzneimittel (CHMP) der EMA hatte angekündigt, am 21. Dezember 2020 seine wissenschaftliche Beurteilung abschließen zu wollen.[61][62] Nachdem er eine Zulassungsempfehlung abgegeben hatte, erteilte die EU-Kommission noch am selben Tag die Zulassung, anstatt wie üblich erst nach 67 Tagen.[63][8]
Am 2. Dezember 2020 erhielt BNT162b2 von der britischen Gesundheitsbehörde Medicines and Healthcare products Regulatory Agency (MHRA) die erste Notfallzulassung.[64][65] Die Impfkampagne in Großbritannien begann am frühen Morgen des 8. Dezember 2020: Die 90-jährige Magaret Keenan war die erste Britin, die mit dem neu entwickelten Vakzin geimpft wurde.[66] Der National Health Service (NHS) begann in 70 Krankenhäusern mit dem Impfprogramm. Die ältesten Britten werden im Rahmen der Impfkampagne zuerst geimpft; dafür stehen 800.000 Impfstoffdosen zur Verfügung. Da zwei Dosen des Impfstoffs pro Person benötigt werden reichen diese für 400.000 Menschen. Die Verteilung des Impfstoffs an Altersheime ist jedoch schwierig, weil dieser vor bei −70° Celsius gelagert werden muss.[67]
In der Schweiz erhielt BNT162b2 am 19. Dezember 2020 eine bedingte Marktzulassung.[68]
Am 10. Dezember 2020 stimmte in den USA das Impfstoff-Beratungsgremium der FDA, Vaccines and Related Biological Products Advisory Committee, für die Notfallzulassung des Impfstoffkandidaten BNT162b2 (BioNTech/Pfizer).[69] Die endgültigen Entscheidungen für die Zulassung trafen die Beamten der FDA im Center for Biologics Evaluation and Research (deutsch Zentrum für Bewertung und Forschung von Biologika) am 11. Dezember.[70]
mRNA-1273 (Moderna)
mRNA-1273 ist ein Corona-Impfstoff der amerikanischen Firma Moderna. Die Vereinigten Staaten kooperieren mit dem in Cambridge (Massachusetts) ansässigen Biotechnologieunternehmen bei der Herstellung eines Impfstoffes gegen die Spikes des Coronavirus auf Basis von Boten-RNA (mRNA). Die klinischen Studien am Impfstoffkandidaten mRNA-1273 begannen im Mai 2020.[71] Am 16. November 2020 gab Moderna bekannt, dass ihr Impfstoff mRNA-1273 eine Wirksamkeit von mehr als 94 Prozent habe.[72] mRNA-1273 könnte – laut einem von der naturwissenschaftliche Fachzeitschrift Science am 16. November 2020 veröffentlichten Artikel – genauso gut funktionieren wie der Impfstoffkandidat BNT162b2 von BionTech/Pfizer. Bedenken hinsichtlich der für Lagerung und Transport jeweils notwendigen Temperatur könnten die Einführung jedoch verlangsamen.[73]
Am 17. Dezember 2020 empfahl der beratende Ausschuss Vaccines and Related Biological Products Advisory Committee der Food and Drug Administration (FDA) die Notfallzulassung für die USA,[74] die am Folgetag erteilt wurde.[75] Über die am 1. Dezember 2020 in der EU beantragten Zulassung will die europäische Arzneimittelagentur EMA, die den Impfstoff seit November 2020 im „Rolling-Review“-Verfahren prüft,[76] am 6. Januar 2021 entscheiden.[77] In der Schweiz ist ein Zulassungsverfahren zu mRNA-1273 anhängig (Stand November 2020).[78] Die Herstellung soll dort vom Schweizer Unternehmen Lonza erfolgen.[79]
CVnCoV (Curevac)
Das Tübinger Unternehmen Curevac entwickelte den RNA-Impfstoff CVnCoV gegen das neuartige Corona-Virus[46] (vorgeschlagener INN: Zorecimeran[80]). Der seit Ostern 2020 in Produktion befindliche Impfstoff könne nach Unternehmensangaben ab Mitte 2021 verteilt werden, soweit die Ende September begonnene Phase-2-Studie sowie die ab dem 4. Quartal 2020 geplante Phase-3-Studie erfolgreich verläuft.[81] Das Mittel ist bei Kühlschranklagerung stabil.[82] Am 14. Dezember 2020 begann Curevac mit der globalen, zulassungsrelevanten Phase-2b/3-Studie für seinen COVID-19-Impfstoffkandidaten.[83] Mit ersten Ergebnissen rechnet der Hersteller gegen Ende des ersten Quartals 2021.[84]
Impfstoff auf Basis von Vektorviren
AZD1222 (AstraZeneca/Oxford)
Am 23. November 2020 stellte der internationale Pharmakonzern AstraZeneca ein Zwischenergebnis des in Kooperation mit der Universität von Oxford auf Basis eines nicht-replizierenden viralen Vektors, einer Vektorvire, entwickelten Impstoffs AZD1222 vor. Der Pressemitteilung des Unternehmens zufolge würde im Schnitt eine Wirksamkeit von 70 Prozent, je nach Dosierungsschema sogar eine Effektivität von 90 Prozent erreicht.[85] Es gab auch Hinweise darauf, dass der Impfstoff nicht nur Erkrankungen an COVID-19, sondern auch Ansteckungen mit dem Coronavirus SARS-CoV-2 verhindern solle.[86] Drei Tage später wurde bekannt, dass es Unstimmigkeit bei der Errechnung des Wirkungsgrades gegeben hatte. Der Chef von AstraZeneca, Pascal Soriot, kündigte daraufhin eine „zusätzliche Studie“ an, bei der die Wirksamkeit des Vakzins validiert werden soll. Probanden hatten in den vorangegangenen klinischen Studien zunächst eine halbe Dosis und einen Monat später eine volle Dosis des Impfstoffes erhalten. Dabei zeigte das Vakzin, wie jenes von BioNTech/Pfizer, eine Wirksamkeit von 90 Prozent. Andere Testpersonen hatten zwei Mal den vollen Wirkstoff erhalten, die Wirksamkeit des Vakzins lag dabei jedoch nur bei 62 Prozent.[87]
Anfang Oktober 2020 startete die EMA das „Rolling-Review“-Verfahren zur Überprüfung des Corona-Impfstoffkandidaten AZD1222.[88][89] In der Schweiz ist ein Zulassungsverfahren zu AZD1222 anhängig (Stand November 2020).[78]
Ad26.COV2.S (Janssen Pharmaceutica)
Die EMA begutachtet seit dem 1. Dezember 2020 das von der belgischen Firma Janssen Pharmaceutica entwickelten Impfstoffkandidaten Ad26.COV2.S – auch bekannt unter der Bezeichnung JNJ-78436735 – im Rahmen eines Roling-Review-Verfahrens. Bei Ad26.COV2.S handelt es sich um einen viralen Vektor auf Basis eines Adenovirus. Aktuell befindet sich das Vakzin in Phase-3 der klinischen Studien zur Beurteilung der Sicherheit, Immunogenität und Wirksamkeit.[90][91]
China
Die Volksrepublik China teilte in der dritten Septemberwoche 2020 mit, einen der Testimpfstoffe ihrer staatseigenen Sinopharm-Konzerngruppe an die Vereinigten Arabischen Emirate zu liefern. Bis dahin hatten bereits Teile des Militärs und anderes Regierungspersonal in China den Impfstoff erhalten. Auch dieser Impfstoff hatte, wie der russische Gam-COVID-Vac („Sputnik V“), die Phase III zu diesem Zeitpunkt noch nicht abgeschlossen. Phase-III-Tests mit dem chinesischen Wirkstoff waren bis dahin mit Argentinien, Bahrain, Brasilien, Bangladesch, Ägypten, Indonesien, Jordanien, Marokko, Peru, Russland und Saudi-Arabien vereinbart.[92] Im November 2020 teilte der Firmenchef von Sinopharm mit, dass über ein Notfallprogramm bereits fast eine Million Menschen geimpft worden sind.[93] Die brasilianische Behörde ANVISA informierte im November 2020 über die Unterbrechung von klinischen Studien mit einem Impfstoff des chinesischen Herstellers Sinovac, nachdem es einen negativen Vorfall gegeben habe.[94]
Russland
Am 1. August 2020 erhielt der kombinierte Vektorimpfstoff Gam-COVID-Vac („Sputnik V“) als weltweit erster COVID-19-Impfstoff in Russland eine Notfallzulassung. Das Vakzin basiert auf zwei rekombinanten Adenovirus-Typen, dem Adenovirus Typ 26 (rAd26) für die Prime-Impfung und dem Adenovirus Typ 5 (rAd5) für die Boost-Impfung. Beide Vektoren tragen das Gen für das Spike-Protein von SARS-CoV-2. Die Massenimpfungen starteten in Moskau am 5./6. Dezember 2020 auf freiwilliger Basis.[95][96] Obwohl die Phase-III-Studie noch nicht abgeschlossen waren, hatten sich bis Mitte September 2020 Indien, Brasilien, Mexiko und Kasachstan für die Nutzung von Gam-COVID-Vac entschieden,[92] während zugleich Zweifel an der Richtigkeit der Studienergebnisse laut wurden.[97]
Zugelassene Impfstoffe
Einige Länder haben Impfstoffen bereits eine vorläufige Zulassung oder Notfallzulassung erteilt:
| Name mit Link zu weiterführenden Informationen |
Impfstoffklasse | Entwickler | Zugelassen in |
|---|---|---|---|
| Gam-COVID-Vac („Sputnik V“) | Nichtreplizierender viraler Vektor |
| |
| BBIBP-CorV | Inaktiviertes Virus (Totimpfstoff) |
| |
| EpiVacCorona | Peptid-Impfstoff | ||
| BNT162b2 | RNA[104] |
| |
| MRNA-1273 | RNA |
|
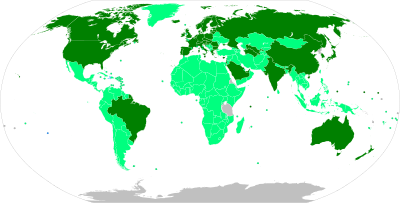
Impfstoffkandidaten
Am 13. März 2020 verzeichnete die WHO 41 Impfstoffe,[122] am 4. April 60 Impfstoffe,[123] am 13. August 167 Impfstoffe[124] und am 11. November 234 Impfstoffe in der Entwicklung. Davon werden 39 Impfstoffe in klinischen Studien geprüft. Zehn Impfstoffe sind bereits in klinischen Phase-III-Studien.[125] Am 16. März 2020 wurde erstmals ein SARS-CoV-2-Impfstoff (namens mRNA-1273) an 45 Menschen getestet.[126]
Bei den Impfstoffkandidaten ist die Arzneimittelsicherheit und die Impfstoffwirksamkeit zu klären.[127] Jeder der verschiedenen Ansätze zur Entwicklung eines SARS-CoV-2-Impfstoffs hat Vor- und Nachteile und es ist nicht voraussehbar, welcher Ansatz schneller oder erfolgreicher sein wird.[128] Nicht alle Kandidaten erreichen die Marktreife. Allgemein betrug zwischen 2006 und 2015 in den USA die Erfolgsquote in der Impfstoffentwicklung – gemessen am Anteil der Phase-I-Kandidaten, die es durch alle Studienphasen hindurch bis zur Zulassung schafften – 16,2 Prozent.[129]
Die Internationale Koalition der Arzneimittelbehörden (ICMRA) appellierte im November 2020 an Pharmaunternehmen und Forscher, Phase-III-Studien mit Covid-19-Impfstoffen auch über den primären Endpunkt hinaus fortzusetzen, um mehr Daten zu Sicherheit und Wirksamkeit zu generieren.[130]
In klinischer Prüfung
| Name mit Link zu weiterführenden Informationen |
Impfstoffklasse | Typ | Entwickler | Fortschritt | Studienteilnehmer | Publikationen |
|---|---|---|---|---|---|---|
| AZD1222 | Nichtreplizierender viraler Vektor[123] | Modifizierter Schimpansen-Adenovirus-Vektor (ChAdOx1 nCoV-19) | Phase 3[131] | Phase 1/2: 1.112 in UK[132]
Phase 3: 30.000[131] |
Phase 1/2 doi:10.1016/S0140-6736(20)31604-4 | |
| mRNA-1273 | RNA[123] | Liposom-umhüllte mRNA | Phase 3[133] Zulassung in der EU beantragt[134] |
Phase 3: 30.000[135] | Phase 1 doi:10.1056/NEJMoa2022483 | |
| CoronaVac | Inaktiviertes Virus[123] | mit Adjuvans (Aluminiumsalz) | Phase 3[136] | Phase 3: 8.870[137] | Phase 2 doi:10.1101/2020.07.31.20161216 | |
| Inaktiviertes Virus[123] | Phase 3[138] | Phase 3: 15.000[138] | Phase 1/2 doi:10.1001/jama.2020.15543 | |||
| Gam-COVID-Vac | Nichtreplizierender viraler Vektor | Kombinierter Zweikomponenten-Vektorimpfstoff, basierend auf humanen Adenoviren (Typ 5, Typ 26)[98] | Notfallzulassung in Russland im August 2020 erteilt;[139] Phase 3[140][141] |
Phase 1/2: 76[142][143]
Phase 3: 40.000[140] |
Phase 1/2 doi:10.1016/S0140-6736(20)31866-3 | |
| Ad5-nCoV | Nichtreplizierender viraler Vektor[123] | Adenovirus-Typ-5-Vektor | Phase 3[144] | Phase 3: 40.000[145] | Phase 1 doi:10.1016/S0140-6736(20)31208-3 Phase 2 doi:10.1016/S0140-6736(20)31605-6 | |
| Ad26.COV2.S | Nichtreplizierender viraler Vektor[123][104] | Adenovirus (Ad26), allein oder mit MVA-Boost, Einzeldosis, intramuskulär appliziert | Phase 3[146] | Phase 3: 60.000[146] reduziert auf 40.000.[147] | ||
| NVX-CoV2373 | Protein[123] | S-Glykoprotein-Trimer als Nanopartikel mit Matrix M | Phase 3[148] | Phase 1: 131[149]
Phase 2: 2904[150] Phase 3: 9000[148] |
Phase 1/2 doi:10.1056/NEJMoa2026920 | |
| BNT162b2 | RNA[104] | Liposom-umhüllte mRNA | Phase 2/3[151] Notfallzulassung in UK, den USA und weiteren Ländern erteilt. Bedingte Zulassung in der EU erteilt.[134] |
Phase 3: 43.661 | Phase 1/2 doi:10.1038/s41586-020-2639-4 | |
| CVnCoV | RNA[123][104] | Liposom-umhüllte mRNA | Phase 2b/3[153][154][155] | Phase 2: 691[154] Phase 2b/3: mehr als 35.000[153] |
||
| Protein | Phase 2[156] | Phase 1: 50[157]
Phase 2: 900[156] |
||||
| Protein[123] | S-Glykoprotein von Baculovirusvektor in Insektenzellkultur | Phase 1/2[158] | Phase 1/2: 440[158] | |||
| AG0301-COVID‑19 | DNA[123] | Plasmid | Phase 1/2[159] | 30[159] | ||
| Lunar-COV19/ARCT-021 | RNA[123][104] | Liposom-umhüllte selbstreplizierende RNA | Phase 1/2[160] | 92[161] | ||
| INO-4800 | DNA[123] | Plasmid mit Elektroporation | Phase 1/2 in Südkorea Phase 1 in USA[162][163] |
|||
| COVAC1 | RNA[123] | Liposom-umhüllte selbstamplifizierende RNA, RNA codierend für VEEV-Replicase und Antigen | Phase 1[164] | 320 | ||
| Nichtreplizierender viraler Vektor[165][166] | Lentiviraler Vektor in dendritischen Zellen per adoptivem Zelltransfer | Phase 1[165] | ||||
| Nichtreplizierender viraler Vektor[165][167] | Lentiviraler Vektor in antigenpräsentierenden Zellen per adoptivem Zelltransfer | Phase 1[165] | ||||
| DNA | S-Glykoprotein-codierendes Plasmid in Bifidobacterium longum, oral appliziert | Phase 1[168] | ||||
| DNA | Phase 1[169] | 40 | ||||
| Protein[123] | S-Glykoprotein-Trimer | Phase 1[170] | 150 | |||
| CoVac-1 | Peptidimpfstoff[171] | Multipeptidcocktail[172] | Phase 1[173][174] | 36[172] |
In Kuba arbeiten Wissenschaftler am Centro de Ingeniería Genética y Biotecnología (CIGB; spanisch Zentrum für Gentechnik und Biotechnologie) an mehreren möglichen Impfstoffen, von denen zwei in die klinische Phase eingetreten seien (Stand: November 2020).[175][176] Der Direktor des CIGB erklärte in einem Interview, dass die kubanische Forschung sich auf Impfstoffe auf Basis virusartiger Partikel konzentriere.[177]
In präklinischer Prüfung
| Impfstoffklasse | Typ | Entwickler | Publikationen |
|---|---|---|---|
| DNA[123] | DNA mit Elektroporation | (OPENCORONA Consortium) |
|
| DNA[123][178] | Lineare DNA per PCR | ||
| DNA[179] | Plasmid, nadelfrei | ||
| DNA[123] | Plasmid | ||
| DNA[180] | |||
| DNA[180] | |||
| Inaktiviertes Virus[123] | |||
| Inaktiviertes Virus[180] | mit Adjuvans CpG-Oligonukleotid 1018 | ||
| Inaktiviertes Virus[180] | mit Adjuvans CpG-Oligonukleotid 1018 | ||
| Attenuiertes Virus[123][104] | mehrfach attenuiertes Virus | ||
| Nichtreplizierender viraler Vektor[123] | MVA-codiertes virusartiges Partikel | ||
| Nichtreplizierender viraler Vektor[180] | Simianes Immundefizienzvirus (GRAd) mit S-Glykoprotein | ||
| Nichtreplizierender viraler Vektor[123] | MVA-S enkodiert | ||
| Nichtreplizierender viraler Vektor[123] | Adenovirus-basiertes NasoVAX, nasal angewendet | ||
| Nichtreplizierender viraler Vektor[123] | Adenovirus (Ad5 S) (GREVAX-Plattform) | ||
| Nichtreplizierender viraler Vektor[180] | Adenovirus (Ad5 S) | ||
| Nichtreplizierender viraler Vektor[123] | Adenovirus (Ad5) mit Antigen und TLR3-Agonist, oral appliziert | ||
| Nichtreplizierender viraler Vektor[180] | MVA | ||
| Nichtreplizierender viraler Vektor[180] | in dendritischen Zellen per adoptivem Zelltransfer | ||
| Nichtreplizierender viraler Vektor[180] | Parainfluenzavirus 5 mit S-Glykoprotein | ||
| Protein[123] | Kapsid-artiges Partikel | (PREVENT-nCoV consortium) |
|
| Protein[123] | Virusartige Partikel aus Drosophila-S2-Insektenzellkultur | ||
| Protein[179] | Peptide in Liposomen | ||
| Protein[123] | S-Glykoprotein | ||
| Protein[123] | S-Glykoprotein mit Adjuvans | ||
| Protein[123] | Virusartiges Partikel mit Adjuvans | ||
| Protein[123] | S-Glykoprotein mit Mikronadeln | ||
| Protein[123] | Peptid | ||
| Protein[123] | Rezeptor-bindende Proteindomäne mit Adjuvans | ||
| Protein[123] | Peptid | ||
| Protein[123] | S-Glykoprotein | ||
| Protein[123] | Peptid auf MHC-Klasse-II-Komplex (Ii-Key-Peptid) | ||
| Protein[123] | S-Glykoprotein | ||
| Protein[123] | gp-96-Fusionsprotein | ||
| Protein[123] | S-Glykoprotein-Klammer | ||
| Protein[180] | Peptide | ||
| Protein[180] | Untereinheiten-Impfstoff | ||
| Protein[123] | S1- oder RBD-Protein | ||
| Protein[123][104] | Lichenase-Fusionsprotein aus transgenen Pflanzen | ||
| Protein[123] | Virusartiges Partikel mit S-Glykoprotein und anderen Epitopen | ||
| Protein[123] | Verkürztes S-Glykoprotein | ||
| Protein[123] | Peptid mit Adjuvans | ||
| Protein[123] | Peptide von S-Glykoprotein und M-Protein | ||
| Protein[180] | E. coli mit S-Glykoprotein und Nukleokapsidprotein, oral appliziert | ||
| Protein[180] | rekombinantes S-Glykoprotein mit Adjuvans (Advax) | ||
| Protein[180] | basierend auf S-Glykoprotein | ||
| Replizierender viraler Vektor[123] | Masernvirus-Vektor | ||
| Replizierender viraler Vektor[123] | Masernvirus-Vektor | ||
| Replizierender viraler Vektor[180] | Masernvirus-Vektor | ||
| Attenuiertes Virus[123] | Masernvirusvektor mit S-Glykoprotein und Nukleokapsidprotein | ||
| Replizierender viraler Vektor[123] | Pferdepockenvirus-Vektor mit S-Glykoprotein | ||
| Replizierender viraler Vektor[179] | Attenuierter Influenzavirus-Vektor | IEM |
|
| Replizierender viraler Vektor[180] | modifiziertes Influenzavirus, nasal appliziert | ||
| Replizierender viraler Vektor[44] | modifiziertes Influenzavirus mit RBD, nasal appliziert | ||
| Replizierender viraler Vektor[123] | VSV-Vektor mit S-Glykoprotein | ||
| Replizierender viraler Vektor[180] | VSV-Vektor mit S-Glykoprotein | ||
| Replizierender viraler Vektor[180] | VSV-Vektor | ||
| RNA[123] | Liposom-umhüllte VLP-codierende mRNA-Mischung | ||
| RNA[123] | Liposom-umhüllte mRNA der RBD | ||
| RNA[179] | |||
| RNA[123] | Liposom-umhüllte mRNA | ||
| RNA[179] | Liposom-umhüllte mRNA | ||
| RNA[180] | mRNA | ||
| RNA[123] | mRNA | ||
| RNA[180] | mRNA, intranasal appliziert | ||
| Virusartiges Partikel[179] | Virusartiges Partikel mit RBD | ||
| Virusartiges Partikel[178][104] | Virusartiges Partikel von SARS-CoV-2 aus transgenen Tabakpflanzen | ||
| Virusartiges Partikel[123] | ADDomerTM | ||
| Virusartiges Partikel[180] | |||
| Virusartiges Partikel[180] | |||
| Unbekannt[123] | Unbekannt | ||
| Unbekannt[123] | Unbekannt | ||
| Unbekannt[180] | Unbekannt | ||
| Aviäres Coronavirus[123][178] | modifiziertes Infektiöses Bronchitis Virus (IBV) | ||
| Nichtreplizierender viraler Vektor[139] | Orf-Virus-Vektor-basierter, polyvalenter Impfstoff mit mehreren Antigenen | ||
| Unbekannt[139] | Unbekannt | ||
| mRNA/DNA-basiert[139] | mRNA/DNA-basiert | ||
| Totimpfstoff[139] | Totimpfstoff mit gentechnisch hergestellten Antigenen (in Tabak produziert) | ||
| Unbekannt[139] | Unbekannt |
Ablauf von Entwicklung und Zulassung
Alle COVID-19-Impfstoffe müssen jede Phase der klinischen Prüfung erfolgreich durchlaufen, bevor sie zugelassen werden können (siehe Impfstoffentwicklung).
Debatte über Belastungsstudien
Im Verlauf der COVID-19-Pandemie wurde vorgeschlagen, die Dauer der Arzneimittelzulassung durch Belastungsstudien zu verkürzen. Eine Belastungsstudie besteht aus einer Impfung mit nachfolgender gezielter Infektion zur Überprüfung der Immunität und des Schutzes vor Infektion und Erkrankung. Belastungsstudien wurden bei verschiedenen anderen Infektionskrankheiten am Menschen durchgeführt wie Grippe, Typhus, Cholera und Malaria. Während Belastungsstudien am Menschen ethisch problematisch sind und deren ethische Aspekte im Allgemeinen wenig erforscht sind,[181][182][183] könnte die Anzahl der COVID-19-Toten dadurch weltweit reduziert werden.[184][185][186][187] Daher wurden in Bezug auf SARS-CoV-2 ethische Richtlinien für Belastungsstudien am Menschen entwickelt.[181] Durch Belastungsstudien können die üblicherweise über mehrere Jahre laufenden klinischen Studien der Phasen II und III auf wenige Monate verkürzt werden.[184][185][188] Nach einem ersten Nachweis der Arzneimittelsicherheit und -wirksamkeit eines Impfstoffkandidaten im Tierversuch und anschließend in gesunden Menschen (< 100 Menschen) können Belastungsstudien eingesetzt werden, um eine klinische Studie der Phase III zu überspringen.[184][186] Belastungsstudien an Menschen beinhalten die Impfung und spätere Infektion von zuvor nicht infizierten, risikoarmen Freiwilligen im Vergleich zu einer mit Placebo-geimpften vergleichbar zusammengesetzten Gruppe als Negativkontrolle.[184][185] Anschließend erfolgt bei Bedarf eine Überwachung der Patienten in Kliniken, die SARS-CoV-2-Medikamente zur Behandlung bereithalten.[184][185]
Citizen Science
Am 27. Februar kündigte das Citizen-Science-Projekt Folding@home an, die Impfstoffentwicklung zur Aufklärung der Struktur des Spike-Proteins von SARS-CoV-2 voranzutreiben. Über Folding@home können Interessierte einen Teil ihrer Computerleistung der Molekülmodellierung zur Verfügung stellen.[189][190][191] Über BOINC kann man auch den Volunteer-Computing-Projekten Rosetta@home, World Community Grid und TN-Grid Computerleistung zur Aufklärung der Struktur von SARS-CoV-2-Proteinen zur Verfügung stellen.[192][193][194] Weiterhin bietet das experimentelle Computerspiel Foldit Interessierten die Möglichkeit, Wissenschaftlern bei der Aufklärung von SARS-CoV-2-Proteinen zu helfen.[195]
Weitere Immunisierungsstrategien
Passive Immunisierung
Passiv-Impfstoffe bestehen aus Antikörpern, welche in der Regel das Virus blockieren und so ein Eindringen in die Zelle verhindern. Im Gegensatz zu Aktivimpfstoffen können sie direkt gegen COVID-19 wirken und deshalb auch bereits mit SARS-CoV-2 Infizierten helfen. Antikörper haben bisher die beste Wirkung bei der Verhinderung von COVID-19 gezeigt, so konnte die Passivimmunisierung mit neutralisierenden Antikörpern bei Risikogruppen die Hospitalisierung um 72 % verringern.[196] Auch der mit SARS-CoV-2 infizierte amerikanische Präsident Donald Trump wurde mit neutralisierenden Antikörpern behandelt.[197]
Zahlreiche solcher neutralisierenden Antikörper gegen SARS-CoV-2 konnten bereits isoliert werden und mehr als 45 sind in der Entwicklung (Stand 1. Oktober 2020), davon 10 bereits in der klinischen Erprobung (Phasen I bis III).[198] Eine Übertragung der Antikörper von COVID-19-Genesenen (in Form einer passiven Immunisierung durch Transfusion von Rekonvaleszentenseren, die polyklonale Antikörper gegen SARS-CoV-2 enthalten) kann einen kurzfristigen Schutz vor einer Infektion und eine Therapie bei Erkrankung bieten.[199] Wesentlich mehr Entwicklungen nutzen dagegen menschliche oder humanisierte monoklonale Antikörper, beispielsweise von AbCellera Biologics (aus Kanada) mit Eli Lilly (aus den USA), von Harbour Biomed (aus China) mit Mount Sinai Health System (aus den USA), von ImmunoPrecise Antibodies (aus Kanada) und von Vir Biotechnology (aus den USA) mit WuXi (aus China) und Biogen (aus den USA).[104] Ein erster Zulassungsantrag wurde im Oktober 2020 in den USA für das Antikörperpräparat LY-CoV555 gestellt,[200] im November 2020 erfolgte die Notfallzulassung (emergency use authosization, EUA) für die Behandlung eines leichten bis mittelschweren Erkrankungsverlaufs, wenn aufgrund von Vorerkrankungen oder des Alters ein hohes Risiko für einen schweren Verlauf vorliegt.[201] Ebenfalls im November 2020 erteilte die FDA Notfallzulassungen für Baricitinib (Olumiant, Eli Lilly)[202][203] und die Kombination Casirivimab und Imdevimab (REGN-COV2) von Regeneron Pharmaceuticals.[204][205] In Deutschland entwickelt die Corat Therapeutics menschliche monoklonale Antikörper, welche sowohl Risikogruppen schützen wie an COVID-19 Erkrankte heilen sollen.[206]
Impfung mit VPM1002
Der von dem Tuberkulose-Impfstoff Bacillus Calmette-Guérin (BCG) abgeleitete Impfstoff VPM1002 soll wie BCG die unspezifische oder die angeborene Immunabwehr stärken und damit den Verlauf von COVID-19-Erkrankungen mildern und schwere COVID-19-Verläufe verhindern. VPM1002 ist kein SARS-CoV-2-Impfstoff, sondern ein Impfstoff, der spezifisch gegen Tuberkulose-Bakterien wirkt und unspezifisch das Immunsystem stärkt.
Herdenimmunität
Eines der Ziele der Impfung ist die Herdenimmunität. Dafür muss die Impfung durch Erzeugen einer sterilen Immunität auch die Übertragung des Erregers auf ungeimpfte Dritte verhindern. Bekannt ist bisher nur, wie häufig einige SARS-CoV-2-Impfstoffe die Infektion oder Milderung der Symptome der Geimpften bewirken. Dagegen ist unbekannt, in welchem Umfang und für welche Dauer die bisher entwickelten SARS-CoV-2-Impfstoffe auch die Infektiosität (das Anstecken Dritter) verhindert.
Zum Erreichen einer Herdenimmunität müssen außerdem mehrere weitere Bedingungen gleichzeitig erfüllt sein. Laut Experten der Weltgesundheitsorganisation (WHO) sei eine Durchimpfungsrate von 60 bis 70 Prozent der Bevölkerung für eine wirkungsvolle Bekämpfung der Pandemie nötig.[207][208][209] Zudem kommt es auch auf die Art, Häufigkeit und Dauer der bewirkten Immunität und die Homogenität ihrer Verteilung in der Bevölkerung an.[210][211] Ein epidemiologisch bedeutsames Beispiel für das Ausbleiben von Herdenimmunität trotz hoher Impfquoten ist die heute übliche Nadelimpfung gegen Kinderlähmung
Zugang und Verteilung
Die internationale Kampagne Access to COVID-19 Tools (ACT) Accelerator soll dazu beitragen, dass Instrumente gegen COVID-19, darunter Impfstoffe, schneller entwickelt und allen Ländern gerecht zur Verfügung gestellt werden. Um einen anfänglichen Mangel an Impfstoff einer gerechten Verteilung zuzuführen, muss zu Beginn eine Priorisierung der COVID-19-Impfmaßnahmen stattfinden.
Bestellte Impfdosen
Die Europäische Kommission hat Verträge mit AstraZeneca (400 Millionen Dosen), Sanofi-GSK (300 Millionen Dosen), Johnson & Johnson (Dosen für 400 Millionen Menschen), BioNTech/Pfizer (300 Millionen Dosen), CureVac (405 Millionen Dosen) und Moderna (160 Millionen Dosen) abgeschlossen. Die Dosen werden nach der Bevölkerungszahl der Mitgliedstaaten zugeteilt. Die Mitgliedstaaten haben auch die Möglichkeit, Impfstoffe an Länder mit niedrigen und mittleren Einkommen zu spenden.[212]
Logistik
Ein Engpass in der Produktion von Impfstoffen ist der weltweite Mangel an ausreichenden Mengen von Ampullen, in die der Impfstoff eingefüllt wird.[213] In vier Werken der Schott AG in Deutschland, Indien und Brasilien wird das Ausgangsmaterial Borosilikatglas Typ 1 für die Fläschchen geschmolzen, ein sehr reines Glas, das speziell gehärtet und beschichtet wird, damit es zu keinerlei chemischer Reaktion mit den Impfstoffen kommt. Es zeichnet sich auch durch seine Unempfindlichkeit gegen plötzliche Temperaturschwankungen aus, einer Folge des geringen Wärmeausdehnungskoeffizienten von etwa 3,3 × 10−6 K−1. Dieses Glas wird zu Rohren gezogen, aus denen in vierzehn anderen Schott-Werken schließlich Fläschchen werden. Zehn Milliliter ist das Standardmaß für Sars-CoV-2-Impfstoff und fasst zehn Impfstoffdosen.[214] Die aseptische Abfüllung und Verpackung („Fill & Finish“) des Impfstoffs übernimmt das Schweizer Unternehmen Siegfried in einer Produktionsanlage an seinem Standort in Hameln und stellt dort spezielle Lagerkapazitäten zur Verfügung.[215] Einige der Impfstoffe gegen die COVID-19-Erkrankung, die derzeit entwickelt werden, müssen bei −70 °C tiefgekühlt transportiert und gelagert werden. Dafür müssen entsprechende Ultratiefkühlschränke beschafft werden.[216] Ebenso müssen auch entsprechende Container mit Ultratiefkühlschränken für den Lufttransport, Schiffstransport, Bahntransport und LKW-Transport angeschafft werden.
Die für den Transport notwendige Logistik ist dabei eine große Herausforderung. Man rechnet mit zehn Milliarden Impfdosen, die über die ganze Welt verteilt werden müssen. Es ist davon auszugehen, dass rund 100.000 Paletten mit 15 Millionen geeigneten Ultratiefkühlschränken transportiert werden müssen, dazu würden beispielsweise etwa 15.000 Flüge nötig. Besondere Herausforderungen bietet die Lieferung vor allem in Gebiete mit warmem Klima, in denen die Logistik nur eingeschränkt auf die Einhaltung von Kühlketten ausgerichtet ist. Teile Afrikas, Südamerikas und Asiens seien schwer zu erreichen. Die nötige Temperatur muss über Sensoren eingehalten und lückenlos dokumentiert werden.[217]
Erschwerend kommt hinzu, dass die verschiedenen Impfstoffe unter jeweils anderen Temperaturen gelagert werden müssen, um nicht zerstört zu werden. Es werden deshalb Kühlgeräte benötigt, die individuell eingestellt werden können. Auch hier ist die Logistik gefordert, um impfstoffabhängig die richtige Temperatur einzustellen und zu überwachen. Der RNA-Impfstoffkandidat von Moderna mRNA-1273 erfordert ein Kühlkettenmanagement knapp über dem Gefrierpunkt und hat nur eine begrenzte Lagerdauer. Der Biontech-Pfizer-RNA-Kandidat BNT162b2 muss jedoch während des gesamten Einsatzes bis zur Impfung bei −70 °C oder kälter gelagert werden. Angeblich sei BNT162b2 bis zu fünf Tagen auch bei 2 °C bis 5 °C haltbar, was wenigstens die Anwendung am Zielort erleichtern würde, weil normale Kühlschränke zur kurzzeitigen Lagerung ausreichen würden. Der Impfstoff kann auch nicht bei seiner Temperatur von −70 °C verabreicht werden und muss deshalb langsam auf Raumtemperatur angewärmt werden, wofür dieses Zeitfenster von maximal fünf Tagen besteht. Auch die Vorlaufzeit, um die richtige Temperatur zur Kühlung auf dem Transportweg zu erreichen, ist dabei unterschiedlich und kann für Temperaturen von −70 °C mehrere Stunden dauern.
DHL soll gemeinsam mit United Parcel Service (UPS) sowie Federal Express (Fedex) die Hauptlast der Vakzinverteilung übernehmen. Um die Herausforderung aktuell und in weiteren Gesundheitskrisen zu bewältigen, müssten Regierungen Strategien und Strukturen einführen. DHL schlägt dazu fünf Säulen vor:[218]
- Notfallplan: Ein Plan, der festlegt, welche Vorkehrungen im Notfall entlang der gesamten Lieferkette getroffen werden müssen. Darunter könnte beispielsweise die Erfassung von Echtzeit-Daten und die Einrichtung von Entscheidungs-Einheiten sein.
- Kooperationsnetzwerk: Da sich Partnerschaften zwischen dem öffentlichen und privaten Sektor bereits zu Beginn der Coronakrise als hilfreich bei Versorgungsengpässen erwiesen haben, könne dies nach Ansicht der DHL-Studie auch in Zukunft wichtig bleiben.
- Physische Infrastruktur: Mit ausreichend Kapazitäten an Lager- und Transportmöglichkeiten könne ein Bestand an kritischen Vorräten sichergestellt werden.
- Transparenz der Lieferkette: Um die IT-gestützte Lieferkettentransparenz zu stärken, sollten nach Ansicht der Studie Echtzeit-Daten auswertbar sein, um Nachfragespitzen zu bewältigen.
- Organisation und Ressourcen: Um im Ernstfall schnell handeln zu können, müsse ein Krisenstab mit klarem Mandat eingerichtet werden.
Laut DHL-Studie verfügen weltweit nur 25 Länder über „fortschrittliche Logistiksysteme“. Die Studien-Autoren fordern für Logistikunternehmen eine Zertifizierung für den Transport und die Lagerung von Life-Science-Produkten. Nur so könne etwa eine reibungslose Zollabfertigung gelingen. Allein die Öffnung der Ultratiefkühlschränke zur Überprüfung durch den Zoll können zur Inaktivierung des Impfstoffes führen. Tatsächlich wären die Folgen bürokratischer Pannen gravierend, wenn Corona-Impfstoffe an den Landesgrenzen verderben.[219] Bisherige Erfahrungswerte bei biologischen Transporten, die „nur“ bei Temperaturen zwischen −20 °C und −30 °C transportiert werden mussten, ergaben einen „Schwund“ auf Grund von Transport- und Temperaturschäden von 25 % bis 50 % der transportierten Produkte.
Der chinesische Pharmariese Fosun Pharmaceutical, ein weiterer Partner von Biontech und Pfizer, will laut „Bloomberg“ ein solches logistisches Netzwerk in China aufbauen. Hierzu werden spezielle Kühlhäuser an Flughäfen, Lkws mit ebenfalls tiefgekühlten Anhängern zum Transport sowie Impfstationen im gesamten Land eingerichtet.[220]
Priorisierung
Nachdem der Impfstoff nicht sofort weltweit in ausreichender Menge vorhanden sein wird, erfordert die anfängliche Knappheit von COVID-19-Impfstoffen und begrenzten Impfkapazitäten eine Priorisierung der COVID-19-Impfmaßnahmen darüber, wer zuerst geimpft werden soll. Um einen geordneten Ablauf zu gewährleisten müssen Call-Center zur Terminvergabe eingerichtet werden, da beispielsweise in Deutschland pro Tag in 60 Impfzentren jeweils 4000 Personen geimpft werden sollen. Dies benötigt eine Logistik, mit der auch alle Personen überprüft werden müssen, ob sie zur entsprechend priorisierten Risikogruppe gehören. Hierzu gehören beispielsweise ärztliche Bescheinigungen oder Berufsnachweise.
In Deutschland wurde ein gemeinsames Positionspapier zur Priorisierung durch die Ständige Impfkommission (STIKO) beim Robert Koch-Institut, den Deutschen Ethikrat und die Nationale Akademie der Wissenschaften Leopoldina entwickelt.[221]
Fortschritt der Impfkampagnen
| Staat | Geimpfte Personen | Anteil an der Gesamtbevölkerung | Stand | Quelle |
|---|---|---|---|---|
| 71.876 | 0,79 % | 22. Dezember 2020 | [222] | |
| ~500.000 | ~0,75 % | 21. Dezember 2020 | [223] | |
| >614.000 | >0,19 % | 21. Dezember 2020 | [224] | |
| >200.000 | >0,14 % | 14. Dezember 2020 | [225] | |
| ~1.000.000 | 0,07 % | 20. November 2020 | [226] | |
| <10.000 | <0,03 % | 21. Dezember 2020 | [227] |
Freiheitsbeschränkungen
Kontrovers diskutiert wurde im Rahmen der COVID-Impfung die Aufhebung bestimmter Freiheitseinschränkungen für Geimpfte. Ein Land, welches dieses Strategie anwendet, ist Israel.[228]
Betrugswarnung und Bewachung
Medikamente sind der weltweit größte Betrugsmarkt im Umfang von rund 200 Milliarden US-Dollar pro Jahr, wodurch die weit verbreitete Nachfrage nach einem COVID-19-Impfstoff in der gesamten Lieferkette anfällig für Fälschungen, Diebstahl, Betrug und Cyberangriffe ist. Es werden Schutzmaßnahmen und Kontrollen benötigt, die Fälschungen aber auch Korruption weitestgehend verhindern können.[229] Am 2. Dezember 2020 erging eine weltweite Warnung der Interpol vor Kriminalität im Zusammenhang mit Corona-Impfstoffen. Kriminelle Organisationen planen Lieferketten zu unterwandern oder zu stören.
Ebenso besteht die Gefahr des Diebstahls, der Fälschung und des illegalen Bewerbens von Impfstoffen.[230] Die Impfstoffe werden außerhalb der Impfzentren an geheimen Orten gelagert und polizeilich bewacht, um Einbruchdiebstahl zu verhindern. Von dort aus werden täglich die am jeweiligen Impftag benötigten Mengen an die Impfzentren – entsprechend bewacht – ausgeliefert. Mobile Impfteams transportieren den Impfstoff nicht selbst. Auch hier wird der Impfstoff in einem gesonderten Fahrzeug unter Bewachung an den Zielort transportiert.
Verschwörungstheorien und Impfgegner
Rund um den Impfstoff ranken sich, wie zu Corona insgesamt (siehe Falschinformationen zur COVID-19-Pandemie), zahlreiche Verschwörungsmythen.[231][232][233] Es wird befürchtet, dass durch derartige Falschmeldungen, z. B. über vermeintliche Nebenwirkungen, die Impfbereitschaft in der Bevölkerung sinkt und damit das Ziel einer Herdenimmunität in Gefahr geraten könnte. Sollte die dafür notwendige Impfquote von mindestens 60–70 % nicht erreicht werden, müssten möglicherweise auch andere Schutzmaßnahmen (wie der Lockdown) weiterhin fortgeführt werden. Damit verbunden wären auch erhebliche wirtschaftliche Einbußen.[234]
Wolfram Henn, Humangenetiker und Mitglied des Ethikrats, sagte an Impfgegner gewandt: „Wer partout das Impfen verweigern will, der sollte, bitte schön, auch ständig ein Dokument bei sich tragen mit der Aufschrift: ,Ich will nicht geimpft werden! Ich will den Schutz vor der Krankheit anderen überlassen! Ich will, wenn ich krank werde, mein Intensivbett und mein Beatmungsgerät anderen überlassen.‘“[235]
Weblinks
- Draft landscape of COVID-19 candidate vaccines, regelmäßig aktualisierte Übersichtsliste der WHO zu COVID-19 Impfstoffkandidaten (englisch)
- Impfstoffe zum Schutz vor Covid-19, vom „Verband Forschender Arzneimittelhersteller“ (vfa) zusammengetragener Stand der Impfstoffentwicklung
- Impfstoffe gegen COVID-19: Stand der Entwicklung und klinischen Prüfungen. Webseite des Paul-Ehrlich-Instituts
- COVID-19 vaccine tracker, Impfstoffkandidaten, klinische Studien und deren Ergebnisse an der London School of Hygiene and Tropical Medicine
- Erklärvideo zur Funktionsweise von und Bedenken gegen die RNA-Impfstoffe, von quarks.de
- Wie weit sind die Corona-Impfstoffe? In: Süddeutsche Zeitung. 2. Dezember 2020, abgerufen am 7. Dezember 2020 (Mehr als 200 Impfstoffe gegen Covid-19 werden derzeit entwickelt. Über 20 haben die letzten beiden der drei Studienphasen erreicht. Der Impfstofftracker vermittelt welcher Hersteller bei der Entwicklung wo steht und welche Technologie er verwendet.).
- COVID-19 – Global literature on coronavirus disease, WHO-Literaturdatenbank über globale Forschung zu Coronavirus-Erkrankungen [COVID-19](englisch)
Literatur
- Patric U. B. Vogel: COVID-19: Suche nach einem Impfstoff (1. Aufl.). Springer Fachmedien Wiesbaden GmbH, Wiesbaden 2020, ISBN 978-3-658-31340-1.
Einzelnachweise
- ↑ Public stakeholder meeting: development and authorisation of safe and effective COVID-19 vaccines in the EU, EMA, 11. Dezember 2020.
- ↑ Corona: Wann gibt es einen Impfstoff? In: quarks.de. 17. Dezember 2020, abgerufen am 20. Dezember 2020 (deutsch).
- ↑ WHO: Draft landscape of COVID-19 candidate vaccines. (PDF) (PDF). In: Website der World Health Organization (WHO). WHO, 2. Dezember 2020, abgerufen am 3. Dezember 2020 (englisch, Spezifikationen und Links zu weiteren Infos über alle von der WHO aufgelisteten Impfstoffkandidaten).
- ↑ Biontech/Pfizer erhalten Notfallzulassung für ersten COVID-19-Impfstoff in den USA. In: Deutsche Apotheker Zeitung. 14. Dezember 2020, abgerufen am 20. Dezember 2020.
- ↑ Notfallzulassung erteilt: Moderna-Impfstoff wird in den USA ausgeliefert. In: Stern. Abgerufen am 20. Dezember 2020.
- ↑ Fernando P. Polack et al.: Safety and Efficacy of the BNT162b2 mRNA Covid-19 Vaccine. In: The New England Journal of Medicine. Dezember 2020, doi:10.1056/NEJMoa2034577.
- ↑ Swissmedic erteilt Zulassung für den ersten Covid-19-Impfstoff in der Schweiz. Swissmedic, 19. Dezember 2020, abgerufen am 19. Dezember 2020.
- ↑ a b EU-Kommission erteilt Zulassung für erste Corona-Impfung. bundesregierung.de, abgerufen am 22. Dezember 2020.
- ↑ Corona-Impfstoff: Zulassung wohl noch vor Heiligabend. … für den ersten COVID-19-Impfstoff in Westeuropa. Auf: aerztezeitung.de; abgerufen am 15. Dezember 2020.
- ↑ Jon Cohen: Science's Breakthrough of the Year 2020: shots of hope in a pandemic-ravaged world. In: sciencemag.org. Science, 17. Dezember 2020, abgerufen am 18. Dezember 2020 (englisch).
- ↑ D. G. Ahn, H. J. Shin, M. H. Kim, S. Lee, H. S. Kim, J. Myoung, B. T. Kim, S. J. Kim: Current Status of Epidemiology, Diagnosis, Therapeutics, and Vaccines for Novel Coronavirus Disease 2019 (COVID-19). In: Journal of microbiology and biotechnology. Band 30, Nummer 3, März 2020, S. 313–324, doi:10.4014/jmb.2003.03011, PMID 32238757.
- ↑ Dave Cavanagh: Severe acute respiratory syndrome vaccine development: Experiences of vaccination against avian infectious bronchitis coronavirus. In: Avian Pathology. 32. Jahrgang, Nr. 6, 2003, S. 567–582, doi:10.1080/03079450310001621198, PMID 14676007.
- ↑ A. Pratelli: High-cell-passage canine coronavirus vaccine providing sterilising immunity. In: The Journal of small animal practice. Band 48, Nummer 10, Oktober 2007, S. 574–578, doi:10.1111/j.1748-5827.2007.00416.x, PMID 17877547.
- ↑ M. Hebben, V. Duquesne, J. Cronier, B. Rossi, A. Aubert: Modified vaccinia virus Ankara as a vaccine against feline coronavirus: immunogenicity and efficacy. In: Journal of feline medicine and surgery. Band 6, Nummer 2, April 2004, S. 111–118, doi:10.1016/j.jfms.2003.12.011, PMID 15123156.
- ↑ Wentao Gao, Azaibi Tamin, Adam Soloff, Leonardo d'Aiuto, Edward Nwanegbo, Paul D. Robbins, William J. Bellini, Simon Barratt-Boyes, Andrea Gambotto: Effects of a SARS-associated coronavirus vaccine in monkeys. In: The Lancet. 362. Jahrgang, Nr. 9399, 2003, S. 1895–1896, doi:10.1016/S0140-6736(03)14962-8, PMID 14667748.
- ↑ Eun Kim, Kaori Okada, Tom Kenniston, V. Stalin Raj, Mohd M. Alhajri, Elmoubasher A.B.A. Farag, Farhoud Alhajri, Albert D.M.E. Osterhaus, Bart L. Haagmans, Andrea Gambotto: Immunogenicity of an adenoviral-based Middle East Respiratory Syndrome coronavirus vaccine in BALB/C mice. In: Vaccine. 32. Jahrgang, Nr. 45, 2014, S. 5975–5982, doi:10.1016/j.vaccine.2014.08.058, PMID 25192975.
- ↑ a b Shibo Jiang, Lu Lu, Lanying Du: Development of SARS vaccines and therapeutics is still needed. In: Future Virology. 8. Jahrgang, Nr. 1, 2013, S. 1–2, doi:10.2217/fvl.12.126.
- ↑ a b SARS (severe acute respiratory syndrome). National Health Service, 5. März 2020, abgerufen am 31. Januar 2020.
- ↑ M. M. Shehata, M. R. Gomaa, M. A. Ali et al.: Middle East respiratory syndrome coronavirus: a comprehensive review. Front. Med. 10, 120–136 (2016). doi:10.1007/s11684-016-0430-6
- ↑ J. T. Lin, J. S. Zhang, N. Su, J. G. Xu, N. Wang, J. T. Chen, X. Chen, Y. X. Liu, H. Gao, Y. P. Jia, Y. Liu, R. H. Sun, X. Wang, D. Z. Yu, R. Hai, Q. Gao, Y. Ning, H. X. Wang, M. C. Li, B. Kan, G. M. Dong, Q. An, Y. Q. Wang, J. Han, C. Qin, W. D. Yin, X. P. Dongs: Safety and immunogenicity from a phase I trial of inactivated severe acute respiratory syndrome coronavirus vaccine. In: Antiviral therapy. Band 12, Nummer 7, 2007, S. 1107–1113, PMID 18018769.
- ↑ J. E. Martin, M. K. Louder, L. A. Holman, I. J. Gordon, M. E. Enama, B. D. Larkin, C. A. Andrews, L. Vogel, R. A. Koup, M. Roederer, R. T. Bailer, P. L. Gomez, M. Nason, J. R. Mascola, G. J. Nabel, B. S. Graham: A SARS DNA vaccine induces neutralizing antibody and cellular immune responses in healthy adults in a Phase I clinical trial. In: Vaccine. Band 26, Nummer 50, November 2008, S. 6338–6343, doi:10.1016/j.vaccine.2008.09.026, PMID 18824060, PMC 2612543 (freier Volltext).
- ↑ J. H. Beigel, J. Voell, P. Kumar, K. Raviprakash, H. Wu, J. A. Jiao, E. Sullivan, T. Luke, R. T. Davey: Safety and tolerability of a novel, polyclonal human anti-MERS coronavirus antibody produced from transchromosomic cattle: a phase 1 randomised, double-blind, single-dose-escalation study. In: The Lancet. Infectious diseases. Band 18, Nummer 4, 04 2018, S. 410–418, doi:10.1016/S1473-3099(18)30002-1, PMID 29329957, PMC 5871563 (freier Volltext).
- ↑ K. Modjarrad, C. C. Roberts, K. T. Mills, A. R. Castellano, K. Paolino, K. Muthumani, E. L. Reuschel, M. L. Robb, T. Racine, M. D. Oh, C. Lamarre, F. I. Zaidi, J. Boyer, S. B. Kudchodkar, M. Jeong, J. M. Darden, Y. K. Park, P. T. Scott, C. Remigio, A. P. Parikh, M. C. Wise, A. Patel, E. K. Duperret, K. Y. Kim, H. Choi, S. White, M. Bagarazzi, J. M. May, D. Kane, H. Lee, G. Kobinger, N. L. Michael, D. B. Weiner, S. J. Thomas, J. N. Maslow: Safety and immunogenicity of an anti-Middle East respiratory syndrome coronavirus DNA vaccine: a phase 1, open-label, single-arm, dose-escalation trial. In: The Lancet. Infectious diseases. Band 19, Nummer 9, September 2019, S. 1013–1022, doi:10.1016/S1473-3099(19)30266-X, PMID 31351922.
- ↑ a b J. Pang, M. X. Wang, I. Y. Ang, S. H. Tan, R. F. Lewis, J. I. Chen, R. A. Gutierrez, S. X. Gwee, P. E. Chua, Q. Yang, X. Y. Ng, R. K. Yap, H. Y. Tan, Y. Y. Teo, C. C. Tan, A. R. Cook, J. C. Yap, L. Y. Hsu: Potential Rapid Diagnostics, Vaccine and Therapeutics for 2019 Novel Coronavirus (2019-nCoV): A Systematic Review. In: Journal of clinical medicine. Band 9, Nummer 3, Februar 2020, doi:10.3390/jcm9030623, PMID 32110875.
- ↑ a b c E. Padron-Regalado: Vaccines for SARS-CoV-2: Lessons from Other Coronavirus Strains. In: Infectious diseases and therapy. [elektronische Veröffentlichung vor dem Druck] April 2020, doi:10.1007/s40121-020-00300-x, PMID 32328406, PMC 7177048 (freier Volltext).
- ↑ T. Kramps, K. Elbers: Introduction to RNA Vaccines. In: Methods in molecular biology. Band 1499, 2017, S. 1–11, doi:10.1007/978-1-4939-6481-9_1, PMID 27987140.
- ↑ a b J. Zhang, H. Zeng, J. Gu, H. Li, L. Zheng, Q. Zou: Progress and Prospects on Vaccine Development against SARS-CoV-2. In: Vaccines. Band 8, Nummer 2, März 2020, S. , doi:10.3390/vaccines8020153, PMID 32235387.
- ↑ a b c E. Padron-Regalado: Vaccines for SARS-CoV-2: Lessons from Other Coronavirus Strains. In: Infectious diseases and therapy. [elektronische Veröffentlichung vor dem Druck] April 2020, doi:10.1007/s40121-020-00300-x, PMID 32328406, PMC 7177048 (freier Volltext).
- ↑ S. F. Ahmed, A. A. Quadeer, M. R. McKay: Preliminary Identification of Potential Vaccine Targets for the COVID-19 Coronavirus (SARS-CoV-2) Based on SARS-CoV Immunological Studies. In: Viruses. Band 12, Nummer 3, Februar 2020, S. , doi:10.3390/v12030254, PMID 32106567.
- ↑ A. C. Walls, Y. J. Park, M. A. Tortorici, A. Wall, A. T. McGuire, D. Veesler: Structure, Function, and Antigenicity of the SARS-CoV-2 Spike Glycoprotein. In: Cell. [elektronische Veröffentlichung vor dem Druck] März 2020, doi:10.1016/j.cell.2020.02.058, PMID 32155444.
- ↑ E. Prompetchara, C. Ketloy, T. Palaga: Immune responses in COVID-19 and potential vaccines: Lessons learned from SARS and MERS epidemic. In: Asian Pacific journal of allergy and immunology. [elektronische Veröffentlichung vor dem Druck] März 2020, doi:10.12932/AP-200220-0772, PMID 32105090.
- ↑ Y. R. Guo, Q. D. Cao u. a.: The origin, transmission and clinical therapies on coronavirus disease 2019 (COVID-19) outbreak - an update on the status. In: Military Medical Research. Band 7, Nummer 1, 03 2020, S. 11, doi:10.1186/s40779-020-00240-0, PMID 32169119, PMC 7068984 (freier Volltext) (Review).
- ↑ D. Wrapp, N. Wang, K. S. Corbett, J. A. Goldsmith, C. L. Hsieh, O. Abiona, B. S. Graham, J. S. McLellan: Cryo-EM structure of the 2019-nCoV spike in the prefusion conformation. In: Science. Band 367, Nummer 6483, März 2020, S. 1260–1263, doi:10.1126/science.abb2507, PMID 32075877.
- ↑ M. Bhattacharya, A. R. Sharma, P. Patra, P. Ghosh, G. Sharma, B. C. Patra, S. S. Lee, C. Chakraborty: Development of epitope-based peptide vaccine against novel coronavirus 2019 (SARS-COV-2): Immunoinformatics approach. In: Journal of medical virology. [elektronische Veröffentlichung vor dem Druck] Februar 2020, doi:10.1002/jmv.25736, PMID 32108359.
- ↑ a b c D. G. Ahn, H. J. Shin, M. H. Kim, S. Lee, H. S. Kim, J. Myoung, B. T. Kim, S. J. Kim: Current Status of Epidemiology, Diagnosis, Therapeutics, and Vaccines for Novel Coronavirus Disease 2019 (COVID-19). In: Journal of microbiology and biotechnology. Band 30, Nummer 3, März 2020, S. 313–324, doi:10.4014/jmb.2003.03011, PMID 32238757.
- ↑ Yixuan J. Hou, Shiho Chiba u. a.: SARS-CoV-2 D614G variant exhibits efficient replication ex vivo and transmission in vivo. In: Science, S. eabe8499, doi:10.1126/science.abe8499.
- ↑ Takahiko Koyama, Daniel Platt, Laxmi Parida, Variant analysis of SARS-CoV-2 genomes, WHO, Bulletin, 22. Februar 2020. Abgerufen am 25. November 2020.
- ↑ Q. Wang, L. Zhang, K. Kuwahara, L. Li, Z. Liu, T. Li, H. Zhu, J. Liu, Y. Xu, J. Xie, H. Morioka, N. Sakaguchi, C. Qin, G. Liu: Immunodominant SARS Coronavirus Epitopes in Humans Elicited both Enhancing and Neutralizing Effects on Infection in Non-human Primates. In: ACS infectious diseases. Band 2, Nummer 5, 30. März 2016, S. 361–376, doi:10.1021/acsinfecdis.6b00006, PMID 27627203, PMC 7075522 (freier Volltext).
- ↑ S. Jiang, M. E. Bottazzi, L. Du, S. Lustigman, C. T. Tseng, E. Curti, K. Jones, B. Zhan, P. J. Hotez: Roadmap to developing a recombinant coronavirus S protein receptor-binding domain vaccine for severe acute respiratory syndrome. In: Expert review of vaccines. Band 11, Nummer 12, Dezember 2012, S. 1405–1413, doi:10.1586/erv.12.126, PMID 23252385, PMC 3586247 (freier Volltext).
- ↑ Y. Honda-Okubo, D. Barnard, C. H. Ong, B. H. Peng, C. T. Tseng, N. Petrovsky: Severe acute respiratory syndrome-associated coronavirus vaccines formulated with delta inulin adjuvants provide enhanced protection while ameliorating lung eosinophilic immunopathology. In: Journal of Virology. Band 89, Nummer 6, März 2015, S. 2995–3007, doi:10.1128/JVI.02980-14, PMID 25520500, PMC 4337527 (freier Volltext).
- ↑ W. H. Chen, U. Strych, P. J. Hotez, M. E. Bottazzi: The SARS-CoV-2 Vaccine Pipeline: an Overview. In: Current tropical medicine reports. [elektronische Veröffentlichung vor dem Druck] März 2020, doi:10.1007/s40475-020-00201-6, PMID 32219057, PMC 7094941 (freier Volltext).
- ↑ China CDC developing novel coronavirus vaccine, 26. Januar 2020. Abgerufen am 28. Januar 2020
- ↑ Lee Jeong-ho, William Zheng, Laura Zhou: Chinese scientists race to develop vaccine as coronavirus death toll jumps In: South China Morning Post, 26. Januar 2020. Abgerufen am 28. Januar 2020
- ↑ a b c Elizabeth Cheung: Hong Kong researchers have developed coronavirus vaccine, expert reveals In: South China Morning Post, 28. Januar 2020
- ↑ Eli Chen: Wash U Scientists Are Developing A Coronavirus Vaccine, St. Louis Public Radio, 5. März 2020. Abgerufen am 6. März 2020
- ↑ a b Susanne Preuß: Trump kassiert Korb im Kampf um Impfstoffhersteller. In: FAZ.net. 15. März 2020, abgerufen am 15. März 2020.
- ↑ Hanna Ziady: Biotech company Moderna says its coronavirus vaccine is ready for first tests, CNN, 26. Februar 2020. Abgerufen am 2. März 2020
- ↑ a b c d e f Impfstoffe gegen Coronavirus – Der aktuelle Forschungsstand – vfa. Verband Forschender Arzneimittelhersteller, 17. März 2020.
- ↑ CEPI welcomes UK Government's funding and highlights need for $2 billion to develop a vaccine against COVID-19. Coalition for Epidemic Preparedness Innovations, Oslo, Norway, 6. März 2020, abgerufen am 23. März 2020.
- ↑ Staff: Moderna Press Release – 3 March 2020 In: Moderna, 3. März 2020. Abgerufen am 11. März 2020
- ↑ Mark Prvulovic: Will Moderna Make a Fortune Off Its Coronavirus Vaccine? – There’s a lot of excitement surrounding this vaccine, but is there any money to be made from it? In: The Motley Fool, 11. März 2020
- ↑ Jocelyn Kaiser: Temperature concerns could slow the rollout of new coronavirus vaccines. In: Science. American Association for the Advancement of Science, 16. November 2020, abgerufen am 23. November 2020 (englisch).
- ↑ Redaktion /fg: Fosun Pharma steigt bei BioNTech ein. In: Onlinemagazin Investmentplatform Deutschland/China. China Investment Media GmbH, 18. März 2020, abgerufen am 23. November 2020.
- ↑ Wolfgang Geissel: BioNTech-Impfstoff BNT162b2 erreicht Phase-III-Ziel: 95 Prozent Wirksamkeit. In: Ärzte Zeitung. Springer Medizin Verlag GmbH, 18. November 2020, abgerufen am 23. November 2020.
- ↑ Coronavirus: Deutschland startet erste klinische Prüfung von Impfstoff. In: spiegel.de. 22. April 2020, abgerufen am 22. April 2020.
- ↑ Bert Fröndhoff: Deutsche Biotechfirma macht Fortschritte bei der Entwicklung eines Corona-Impfstoffs. In: handelsblatt.com. 16. März 2020, abgerufen am 16. März 2020.
- ↑ hessenschau de, Frankfurt Germany: Erste Studie zu Corona-Impfstoff in Deutschland läuft an. 22. April 2020, abgerufen am 3. Dezember 2020.
- ↑ Pfizer and BioNTech to Submit Emergency Use Authorization Request Today the U.S. FDA for COVID-19 Vaccine, abgerufen am 2. Dezember 2020.
- ↑ Zweiter Corona-Impfstoff wird überprüft, Pharmazeutische Zeitung, 6. Oktober 2020.
- ↑ Biontech hat EU-Zulassung beantragt. In: tageschau.de. Abgerufen am 1. Dezember 2020.
- ↑ Update on assessment of the BioNTech and Pfizer BNT162b2 vaccine marketing authorisation application, EMA, 15. Dezember 2020. Abgerufen am 15 Dezember 2020.
- ↑ Corona-Impfstoff: Zulassung wohl noch vor Heiligabend. … für den ersten COVID-19-Impfstoff in Westeuropa. Auf: aerztezeitung.de; abgerufen am 15. Dezember 2020.
- ↑ Europäische Arzneimittel-Agentur EMA wird bis 21. Dezember über BioNTech-Impfstoff entscheiden: Fragen und Antworten zum Zulassungsverfahren, ec.europa.eu, 15. Dezember 2020.
- ↑ a b Großbritannien lässt Biontech-Impfstoff zu. Noch vor EU und USA. In: n-tv. 9. Dezember 2020, abgerufen am 2. Dezember 2020 (englisch).
- ↑ UK medicines regulator gives approval for first UK COVID-19 vaccine. Press release. In: GOV.UK (Website). Government Digital Service, 2. Dezember 2020, abgerufen am 7. Dezember 2020.
- ↑ Jochen Wittmann: Eine 90-jährige macht den Anfang. In: Sächsische Zeitung (SZ), 9. Dezember 2020, S. 4 (Bericht des SZ-Korrespondenten aus London).
- ↑ Carsten Volkery: Start der Corona-Impfung –Briten feiern den „V-Day“ – „Wir waren von Anfang an sehr organisiert“. In: Handelsblatt-Online. Dieter von Holtzbrinck, abgerufen am 17. Dezember 2020 („Großbritannien hat als erstes westliches Land mit der Corona-Impfung begonnen. Die zweite Spritze erhielt ein gewisser William Shakespeare.“).
- ↑ a b Pfizer and BioNTech Receive Conditional Marketing Authorization by Swissmedic for COVID-19 Vaccine, Biontech, Pressemitteilung, 19. Dezember 2020.
- ↑ Most FDA Committee Members Vote To Recommend COVID-19 Vaccine, Precision vaccination, 10. Dezember 2020. Abgerufen am 11. Dezember 2020.
- ↑ Pfizer-BioNTech COVID-19 Vaccine, FDA, abgerufen am 12. Dezember 2020.
- ↑ Julie Steenhuysen, Kate Kelland: With Wuhan virus genetic code in hand, scientists begin work on a vaccine, 24. Januar 2020. Abgerufen am 25. Januar 2020
- ↑ „Besser wird es nicht“ – Fauci erfreut über Durchbruch bei Corona-Impfstoff, Welt, 16. November 2020. Abgerufen am 16. November 2020.
- ↑ Jocelyn Kaiser: Temperature concerns could slow the rollout of new coronavirus vaccines. In: Website von Science. American Association for the Advancement of Science (AAAS), 16. November 2020, abgerufen am 23. November 2020 (englisch).
- ↑ Recommendation paves way for FDA authorization of Moderna Covid vaccine in US. In: www.theguardian.com. 17. Dezember 2020, abgerufen am 18. Dezember 2020.
- ↑ a b Moderna COVID-19 Vaccine, FDA, 18. Dezember 2020.
- ↑ EMA starts rolling review of mRNA COVID-19 vaccine by Moderna Biotech Spain, S.L. 16. November 2020, abgerufen am 18. November 2020.
- ↑ Frühere Entscheidung über Moderna-Impfstoff. 17. Dezember 2020, abgerufen am 18. Dezember 2020.
- ↑ a b Schweizer Arzneimittelbehörde testet Impfstoff von Moderna, www.aerzteblatt.de, 13. November 2020.
- ↑ Moderna-Impfstoff kommt von Lonza im Wallis. In: Website von Schweizer Bauer. 16. November 2020, abgerufen am 16. Dezember 2020.
- ↑ List 124 – COVID-19 (special edition), WHO Drug Information, Vol. 34, No. 3, 2020 (PDF).
- ↑ Ulrich Schreyer: Hoffnung auf Impfstoff im Winter. In: Stuttgarter Nachrichten. Band 75, Nr. 229, 2. Oktober 2020, S. 13 (ähnlicher Artikel bei online).
- ↑ Kühlschranklagerung genügt! DAZ.online, 12. November 2020.
- ↑ CureVac beginnt die globale, zulassungsrelevante Phase 2b/3-Studie für seinen COVID-19-Impfstoffkandidaten CVnCoV. In: Pressemitteilung der CureVac AG. Hrsg.: CureVac AG, 14. Dezember 2020, abgerufen am 17. Dezember 2020.
- ↑ Curevac darf Impfstoff produzieren. In: Stuttgarter Nachrichten. Band 75, Nr. 295, 19. Dezember 2020, S. 13.
- ↑ Adrian Kemp (Company Secretary AstraZeneca PLC): AZD1222 vaccine met primary efficacy endpoint in preventing COVID-19. In: Website von AstraZeneca. 23. November 2020, abgerufen am 25. November 2020 (englisch).
- ↑ Kathrin Zinkant: Auch Astra Zenecas Impfstoff erweist sich als wirksam. In: Süddeutsche Zeitung. 23. November 2020, abgerufen am 25. November 2020.
- ↑ AFP: AstraZeneca muss Corona-Impfstoff erneut testen. Offene Fragen zur Wirksamkeit. In: t-online. Ströer Digital Publishing, 26. November 2020, abgerufen am 12. Dezember 2020: „Wie wirksam ist der an der Universität Oxford entwickelte Impfstoff wirklich? Offenbar gab es Unstimmigkeit bei der Errechnung des Wirkungsgrades. Deshalb muss jetzt weiter getestet werden.“
- ↑ Europäische Arzneimittelagentur (EMA): EMA starts first rolling review of a COVID-19 vaccine in the EU, 1. Oktober 2020.
- ↑ Zweiter Corona-Impfstoff wird überprüft, Pharmazeutische Zeitung, 6. Oktober 2020.
- ↑ C. Müller: EMA prüft vierten Corona-Impfstoff. In: DAZ.online. 3. Dezember 2020, abgerufen am 10. Dezember 2020.
- ↑ EMA starts rolling review of Janssen’s COVID-19 vaccine Ad26.COV2.S. In: Website der EMA. EMA Press office, 1. Dezember 2020, abgerufen am 14. Dezember 2020 (englisch).
- ↑ a b Eva Dou, Isabelle Khurshudyan: China and Russia are ahead in the global coronavirus vaccine race, bending long-standing rules as they go. In: washingtonpost.com, 18. September 2020.
- ↑ China hat fast eine Million Menschen gegen Corona geimpft. In: rnd.de, 20. November 2020.
- ↑ Brasilien unterbricht klinische Studien mit Coronaimpfstoffkandidat aus China. In: aerzteblatt.de. 10. November 2020, abgerufen am 1. Dezember 2020.
- ↑ https://www.tagesschau.de/ausland/russland-massenimpfungen-101.html
- ↑ https://www.dw.com/de/so-wurde-ich-mit-sputnik-v-geimpft/a-55816126
- ↑ Julia Köppe: Verdacht auf Manipulation bei Russlands Corona-Impfstoff „Sputnik V“. In: spiegel.de. 15. September 2020, abgerufen am 19. September 2020.
- ↑ a b Das russische Gesundheitsministerium hat den weltweit ersten Impfstoff gegen COVID-19 registriert (russisch), Ministerium für Gesundheit, 11. August 2020.
- ↑ +++ Corona-News +++. Der Spiegel, 21. Dezember 2020, abgerufen am 21. Dezember 2020.
- ↑ Sinovac's coronavirus vaccine candidate approved for emergency use in China, Reuters, 28. August 2020.
- ↑ Vereinigte Arabische Emirate: Corona-Impfstoff aus China für Notfallgebrauch, www.pharmazeutische-zeitung.de, 15. September 2020.
- ↑ Bahrain latest country to vaccinate frontline workers with COVID-19 shot, Reuters, 3. November 2020.
- ↑ Vector center registers second Russian COVID-19 vaccine, 14. Oktober 2020.
- ↑ a b c d e f g h i The pandemic pipeline. In: nature.com. 20. März 2020, abgerufen am 23. März 2020 (englisch).
- ↑ Corona-Impfstoff: Bahrain erteilt Biontech/Pfizer Notfallzulassung. In: RND. 4. Dezember 2020, abgerufen am 9. Dezember 2020.
- ↑ Drug and vaccine authorizations for COVID-19: List of applications received. In: Government of Canada. Abgerufen am 10. Dezember 2020 (englisch).
- ↑ Coronavirus: Saudi Arabia approves Pfizer-BioNTech COVID-19 vaccine for use. In: Al Arabiya English. Abgerufen am 11. Dezember 2020 (englisch).
- ↑ Pfizer-BioNTech COVID-19 Vaccine. In: FDA. 11. Dezember 2020, abgerufen am 13. Dezember 2020.
- ↑ Impfstoff erhält auch in Mexiko Notfallzulassung. In: Zeit Online. 12. Dezember 2020, abgerufen am 12. Dezember 2020.
- ↑ Swissmedic erteilt Zulassung für den ersten Covid-19-Impfstoff in der Schweiz. 19. Dezember 2020, abgerufen am 19. Dezember 2020.
- ↑ https://www.arabnews.com/node/1776666/middle-east
- ↑ https://apnews.com/article/science-singapore-coronavirus-pandemic-lee-hsien-loong-coronavirus-vaccine-5bf8461b9d2d32ec08d56fcf5958317a
- ↑ https://www.france24.com/en/live-news/20201215-jordan-approves-pfizer-biontech-covid-vaccine
- ↑ https://www.reuters.com/article/health-coronavirus-oman-vaccine-int-idUSKBN28P1RA
- ↑ https://ticotimes.net/2020/12/16/costa-rica-authorizes-pfizer-biontech-coronavirus-vaccine
- ↑ https://www.controlsanitario.gob.ec/arcsa-autoriza-ingreso-al-pais-de-vacuna-pfizer-biontech-para-el-covid-19/
- ↑ https://finance.yahoo.com/news/panama-approves-pfizers-covid-19-010942802.html?guccounter=1&guce_referrer=aHR0cHM6Ly9lbi53aWtpcGVkaWEub3JnLw&guce_referrer_sig=AQAAAJx7wfOIfhVQcCrhLb1jS_sxfYm7bcO8rU08J3rp8fJlJmOqOtoCv1nfvzVNSKmTYRC7snpYyP2t1_h-qnccRbYCf83cvC17km3RvtpZgTbZXJCTTuVk8Vih16StYcoBjKcKcgoOzQiBNTlERxml19hRvYFRrP48zGToL1Q9izD0
- ↑ https://www.straitstimes.com/world/chile-approves-pfizer-biontech-covid-19-vaccine-for-emergency-use
- ↑ EMA recommends first COVID-19 vaccine for authorisation in the EU. European Medicines Agency, 21. Dezember 2020, abgerufen am 21. Dezember 2020.
- ↑ EU-Kommission genehmigt Corona-Impfstoff von Biontech und Pfizer. Der Spiegel, 21. Dezember 2020, abgerufen am 21. Dezember 2020.
- ↑ Moderna COVID-19 Vaccine (mRNA-1273 SARS-CoV-2). 23. Dezember 2020, abgerufen am 23. Dezember 2020.
- ↑ WHO: DRAFT landscape of COVID-19 candidate vaccines – 20 March 2020. (PDF) In: who.int. Abgerufen am 27. März 2020.
- ↑ a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab ac ad ae af ag ah ai aj ak al am an ao ap aq ar as at au av aw ax ay az ba bb bc bd be bf WHO: DRAFT landscape of COVID-19 candidate vaccines – 4 April 2020. (PDF) In: who.int. Abgerufen am 6. April 2020.
- ↑ Weltgesundheitsorganisation: DRAFT landscape of COVID-19candidate vaccines, 13 August 2020. Abgerufen am 17. August 2020.
- ↑ Covid-19 vaccinetracker. Abgerufen am 16. November 2020.
- ↑ Jackie Salo: First coronavirus vaccine trial begins as Seattle volunteer receives shot. In: nypost.com. 16. März 2020, abgerufen am 17. März 2020 (englisch).
- ↑ H. H. Thorp: Underpromise, overdeliver. In: Science. Band 367, Nummer 6485, 27. März 2020, S. 1405, doi:10.1126/science.abb8492, PMID 32205459.
- ↑ F. Amanat, F. Krammer: SARS-CoV-2 Vaccines: Status Report. In: Immunity. Band 52, Nummer 4, 6. April 2020, S. 583–589, doi:10.1016/j.immuni.2020.03.007, PMID 32259480, PMC 7136867 (freier Volltext).
- ↑ Clinical Development Success Rates 2006–2015. BIO Industry Analysis, Juni 2016.
- ↑ Corona-Impfstudien länger laufen lassen, www.pharmazeutische-zeitung.de, 27. November 2020.
- ↑ a b Phase III Double-blind, Placebo-controlled Study of AZD1222 for the Prevention of COVID-19 in Adults - Full Text View - ClinicalTrials.gov. Abgerufen am 2. September 2020 (englisch).
- ↑ A Study of a Candidate COVID-19 Vaccine (COV001) – Full Text View. In: clinicaltrials.gov. 27. März 2020, abgerufen am 15. April 2020.
- ↑ Moderna Announces Phase 3 COVE Study of mRNA Vaccine Against COVID-19 (mRNA-1273) Begins. 27. Juli 2020, abgerufen am 28. Juli 2020 (englisch).
- ↑ a b tagesschau.de: Corona-Impfstoff von Biontech/Pfizer: EU-Zulassung beantragt. Abgerufen am 1. Dezember 2020.
- ↑ A Study to Evaluate Efficacy, Safety, and Immunogenicity of mRNA-1273 Vaccine in Adults Aged 18 Years and Older to Prevent COVID-19. In: clinicaltrials.gov. Abgerufen am 2. August 2020.
- ↑ Sinovac COVID-19 Vaccine Collaboration with Butantan Receives Approval from Brazilian Regulator for Phase III Trial. 6. Juli 2020, abgerufen am 2. August 2020.
- ↑ Clinical Trial of Efficacy and Safety of Sinovac's Adsorbed COVID-19 (Inactivated) Vaccine in Healthcare Professionals (PROFISCOV). In: clinicaltrials.gov. Abgerufen am 2. August 2020.
- ↑ a b A Phase III clinical trial for inactivated novel coronavirus pneumonia (COVID-19) vaccine (Vero cells). In: chictr.org. Abgerufen am 7. August 2020.
- ↑ a b c d e f Impfstoffe gegen Coronavirus – der aktuelle Forschungsstand – vfa. Verband Forschender Arzneimittelhersteller (vfa), Stand 26. August 2020; abgerufen am 28. August 2020.
- ↑ a b Clinical Trial of Efficacy, Safety, and Immunogenicity of Gam-COVID-Vac Vaccine Against COVID-19 (RESIST). In: clinicaltrials.gov. Abgerufen am 28. August 2020.
- ↑ Phase-III-Studie für Coronaimpfstoff in Russland gestartet, aerzteblatt.de, 9. September 2020.
- ↑ An Open Study of the Safety, Tolerability and Immunogenicity of "Gam-COVID-Vac Lyo" Vaccine Against COVID-19. In: clinicaltrials.gov. Abgerufen am 3. September 2020.
- ↑ An Open Study of the Safety, Tolerability and Immunogenicity of the Drug "Gam-COVID-Vac" Vaccine Against COVID-19. In: clinicaltrials.gov. Abgerufen am 3. September 2020.
- ↑ Petrovax and Casino Biologics are to launch Phase III International Clinical Trial of the potential COVID-19 vaccine in Russia. 15. August 2020, abgerufen am 24. August 2020.
- ↑ Phase III Trial of A COVID-19 Vaccine in Adults 18 Years of Age and Older. In: clinicaltrials.gov. Abgerufen am 28. August 2020.
- ↑ a b A Study of Ad26.COV2.S for the Prevention of SARS-CoV-2-Mediated COVID-19 in Adult Participants (ENSEMBLE). In: clinicaltrials.gov. Abgerufen am 28. August 2020.
- ↑ ad26cov2-s, precisionvaccinations. Abgerufen am 10. Dezember 2020.
- ↑ a b A Phase 3, Randomised, Observer-Blinded, Placebo-Controlled Trial to Evaluate the Efficacy and Safety of a SARS-CoV-2 Recombinant Spike Protein Nanoparticle Vaccine (SARS-CoV-2 rS) with Matrix-M1™ Adjuvant in Adult Participants 18-84 Years of Age in the United Kingdom. Abgerufen am 30. September 2020 (englisch).
- ↑ Evaluation of the Safety and Immunogenicity of a SARS-CoV-2 rS (COVID-19) Nanoparticle Vaccine With/Without Matrix-M Adjuvant – Full Text View – ClinicalTrials.gov. Abgerufen am 15. Mai 2020 (englisch).
- ↑ A Study Looking at the Effectiveness and Safety of a COVID-19 Vaccine in South African Adults. Abgerufen am 4. September 2020 (englisch).
- ↑ Pfizer and Biontech Choose Lead mRNA Vaccine Candidate Against COVID-19 and Commence Pivotal Phase 2/3 Global Study. 27. Juli 2020, abgerufen am 28. Juli 2020.
- ↑ Study to Describe the Safety, Tolerability, Immunogenicity, and Potential Efficacy of RNA Vaccine Candidates Against COVID-19 in Healthy Adults – Tabular View – ClinicalTrials.gov. Abgerufen am 2. August 2020 (englisch).
- ↑ a b CureVac beginnt die globale, zulassungsrelevante Phase 2b/3-Studie für seinen COVID-19-Impfstoffkandidaten CVnCoV. In: curevac.com. CureVac, 14. Dezember 2020, abgerufen am 15. Dezember 2020.
- ↑ a b A Dose-Confirmation Study to Evaluate the Safety, Reactogenicity and Immunogenicity of Vaccine CVnCoV in Healthy Adults. Abgerufen am 2. September 2020.
- ↑ A Study to Determine the Safety and Efficacy of SARS-CoV-2 mRNA Vaccine CVnCoV in Adults. In: clinicaltrails.gov. 8. Dezember 2020, abgerufen am 15. Dezember 2020 (englisch).
- ↑ a b Clinical Study of Recombinant Novel Coronavirus Vaccine. Abgerufen am 4. September 2020 (englisch).
- ↑ Phase I Clinical Study of Recombinant Novel Coronavirus Vaccine. Abgerufen am 4. September 2020 (englisch).
- ↑ a b Study of Recombinant Protein Vaccine Formulations Against COVID-19 in Healthy Adults 18 Years of Age and Older. Abgerufen am 4. September 2020 (englisch).
- ↑ a b Study of COVID-19 DNA Vaccine (AG0301-COVID19) - Full Text View - ClinicalTrials.gov. Abgerufen am 2. September 2020 (englisch).
- ↑ BIA: CTI and Arcturus Therapeutics Announce Initiation of Dosing of COVID-19 STARR™ mRNA Vaccine Candidate, LUNAR-COV19 (ARCT-021) in a Phase 1/2 study. Abgerufen am 2. September 2020.
- ↑ Ascending Dose Study of Investigational SARS-CoV-2 Vaccine ARCT-021 in Healthy Adult Subjects. Abgerufen am 3. September 2020 (englisch).
- ↑ IVI, INOVIO, and KNIH to partner with CEPI in a Phase I/II clinical trial of INOVIO's COVID-19 DNA vaccine in South Korea. International Vaccine Institute, 16. April 2020, abgerufen am 23. April 2020.
- ↑ Safety, Tolerability and Immunogenicity of INO-4800 for COVID-19 in Healthy Volunteers – Full Text View. In: clinicaltrials.gov. 24. April 2020, abgerufen am 29. April 2020.
- ↑ ISRCTN – ISRCTN17072692: Clinical trial to assess the safety of a coronavirus vaccine in healthy men and women. In: isrctn.com. Abgerufen am 10. Juni 2020 (englisch).
- ↑ a b c d T. Thanh Le, Z. Andreadakis, A. Kumar, R. Gómez Román, S. Tollefsen, M. Saville, S. Mayhew: The COVID-19 vaccine development landscape. In: Nature reviews. Drug discovery. [elektronische Veröffentlichung vor dem Druck] April 2020, doi:10.1038/d41573-020-00073-5, PMID 32273591.
- ↑ Immunity and Safety of Covid-19 Synthetic Minigene Vaccine – Full Text View. In: clinicaltrials.gov. 19. Februar 2020, abgerufen am 15. April 2020.
- ↑ Safety and Immunity of Covid-19 aAPC Vaccine – Full Text View. In: clinicaltrials.gov. 15. Februar 2020, abgerufen am 15. April 2020.
- ↑ Evaluating the Safety, Tolerability and Immunogenicity of bacTRL-Spike Vaccine for Prevention of COVID-19 – Full Text View. In: clinicaltrials.gov. 22. April 2020, abgerufen am 19. Mai 2020.
- ↑ The Jakarta Post: Kalbe to start COVID-19 vaccine trial with S. Korean pharma firm. 29. Mai 2020, abgerufen am 22. Juni 2020 (englisch).
- ↑ Clover Biopharmaceuticals Initiates Phase 1 Clinical Trial for COVID-19 Vaccine Candidate. 19. Juni 2020, abgerufen am 22. Juni 2020 (englisch).
- ↑ Neuartiger Impfstoff zur Aktivierung von T-Zell-Antworten gegen SARS-CoV-2 in Erprobung. 1. Dezember 2020, abgerufen am 1. Dezember 2020.
- ↑ a b Safety and Immunogenicity Trial of Multi-peptide Vaccination to Prevent COVID-19 Infection in Adults (pVAC). Abgerufen am 3. Dezember 2020 (englisch).
- ↑ Studie zum Tübinger Coronavirus-Impfstoff CoVac-1. Abgerufen am 1. Dezember 2020.
- ↑ UKT startet T-Zell-Impfstudie gegen das Coronavirus. Abgerufen am 1. Dezember 2020.
- ↑ Kuba startet klinische Studie mit zweitem Impfstoffkandidaten. In: amerika21.de. 21. Oktober 2020, abgerufen am 1. Dezember 2020.
- ↑ Coronavirus Vaccine Tracker. Cuba announces two Phase 1 trials. In: nytimes.com. 30. November 2020, abgerufen am 1. Dezember 2020.
- ↑ Corona-Impfstoff made in Cuba. In: Deutsche Welle (DW) – Online. Hrsg.:Deutsche Welle (Anstalt des öffentlichen Rechts), 18. August 2020, abgerufen am 1. Dezember 2020.
- ↑ a b c d e f DRAFT landscape of COVID-19candidate vaccines – 11. April 2020. (PDF) In: who.int. 11. April 2020, abgerufen am 15. April 2020.
- ↑ a b c d e f g h i j k l m n o p q r s t u v w WHO: DRAFT landscape of COVID-19 candidate vaccines – 26 April 2020. (PDF) In: who.int. 26. April 2020, abgerufen am 29. April 2020 (englisch).
- ↑ a b Seema K. Shah, Franklin G. Miller, Thomas C. Darton, Devan Duenas, Claudia Emerson, Holly Fernandez Lynch, Euzebiusz Jamrozik, Nancy S. Jecker, Dorcas Kamuya, Melissa Kapulu, Jonathan Kimmelman, Douglas MacKay, Matthew J. Memoli, Sean C. Murphy, Ricardo Palacios, Thomas L. Richie, Meta Roestenberg, Abha Saxena, Katherine Saylor, Michael J. Selgelid, Vina Vaswani, Annette Rid: Ethics of controlled human infection to study COVID-19. In: Science. , S. eabc1076, 22. Mai 2020. doi:10.1126/science.abc1076.
- ↑ B. Bambery, M. Selgelid, C. Weijer, J. Savulescu, A. J. Pollard: Ethical Criteria for Human Challenge Studies in Infectious Diseases. In: Public health ethics. Band 9, Nummer 1, April 2016, S. 92–103, doi:10.1093/phe/phv026, PMID 29731811, PMC 5926904 (freier Volltext).
- ↑ E. Jamrozik, M. J. Selgelid: Human Challenge Studies in Endemic Settings: Ethical and Regulatory Issues. In: Springer Briefs in Ethics, Springer, 2020. ISBN 978-3-030-41480-1.
- ↑ a b c d e N. Eyal, M. Lipsitch, P. G. Smith: Human challenge studies to accelerate coronavirus vaccine licensure. In: The Journal of Infectious Diseases. [elektronische Veröffentlichung vor dem Druck] März 2020, doi:10.1093/infdis/jiaa152, PMID 32232474, PMC 7184325 (freier Volltext).
- ↑ a b c d E. Callaway: Should scientists infect healthy people with the coronavirus to test vaccines? In: Nature. Band 580, Nummer 7801, 2. April 2020, S. 17, doi:10.1038/d41586-020-00927-3, PMID 32218549.
- ↑ a b Jon Cohen: Speed coronavirus vaccine testing by deliberately infecting volunteers? Not so fast, some scientists warn. In: Science, 31. Mai 2020.doi:10.1126/science.abc0006.
- ↑ Imperial College COVID-19 Response Team – Patrick G. T. Walker, Charles Whittaker, Oliver Watson, Marc Baguelin, Kylie E. C. Ainslie, Sangeeta Bhatia, Samir Bhatt, Adhiratha Boonyasiri, Olivia Boyd, Lorenzo Cattarino, Zulma Cucunubá, Gina Cuomo-Dannenburg, Amy Dighe, Christl A. Donnelly, Ilaria Dorigatti, Sabine van Elsland, Rich FitzJohn, Seth Flaxman, Han Fu, Katy Gaythorpe, Lily Geidelberg, Nicholas Grassly, Will Green, Arran Hamlet, Katharina Hauck, David Haw, Sarah Hayes, Wes Hinsley, Natsuko Imai, David Jorgensen, Edward Knock, Daniel Laydon, Swapnil Mishra, Gemma Nedjati-Gilani, Lucy C. Okell, Steven Riley, Hayley Thompson, Juliette Unwin, Robert Verity, Michaela Vollmer, Caroline Walters, Hao Wei Wang, Yuanrong Wang, Peter Winskill, Xiaoyue Xi, Neil M Ferguson, Azra C. Ghani: Report 12: The Global Impact of COVID-19 and Strategies for Mitigation and Suppression, 26. März 2020.
- ↑ Eric Boodman: Coronavirus vaccine clinical trial starting without usual animal data. STAT News, 13. März 2020, abgerufen am 19. April 2020.
- ↑ B. Kraft, C. Windeck, M. Mantel: Anleitung: Mit Folding@home für die Suche nach Coronavirus-Medikamenten rechnen. In: c't Magazin. heise online, 2. April 2020.
- ↑ Oliver Bünte: Coronavirus-Forschung: Stanford-Wissenschaftler bitten um Rechenressourcen. In: heise.de. 3. März 2020, abgerufen am 20. März 2020.
- ↑ Greg Bowman: Folding@home takes up the fight against COVID-19 / 2019-nCoV. In: Folding@home. 27. Februar 2020.
- ↑ Nero24: TN-Grid weiteres BOINC-Projekt zur SARS-CoV-2 Erforschung – Planet 3DNow! 2. April 2020.
- ↑ Volunteers rally to Rosetta@Home to stop COVID-19 – Institute for Protein Design. Institute for Protein Design, University of Washington 26. März 2020.
- ↑ Your computer can help scientists seek potential COVID-19 treatments. In: www.scripps.edu. The Scripps Research Institute, 1. April 2020.
- ↑ Bayerischer Rundfunk: So unterstützen Sie die Forschung im Kampf gegen Corona. In: BR24. 16. März 2020.
- ↑ Lilly announces proof of concept data for neutralizing antibody LY-CoV555 in the COVID-19 outpatient setting, www.prnewswire.com, 16. September 2020.
- ↑ J. Simmank: Ein Cocktail für den Präsidenten. Zeit Online, 3. Oktober 2020.
- ↑ A. Renn, Y. Fu, X. Hu, M.D. Hall, A. Simeonov: Fruitful Neutralizing Antibody Pipeline Brings Hope To Defeat SARS-Cov-2. Trends in Pharmacological Sciences, 31. Juli 2020 [elektronische Veröffentlichung vor dem Druck] doi:10.1016/j.tips.2020.07.004
- ↑ A. Casadevall, L. A. Pirofski: The convalescent sera option for containing COVID-19. In: The Journal of clinical investigation. [elektronische Veröffentlichung vor dem Druck] März 2020, doi:10.1172/JCI138003, PMID 32167489.
- ↑ Eli Lilly beantragt Notfallzulassung für Covid-19-Medikament, apotheke adhoc, 7. Oktober 2020.
- ↑ Coronavirus (COVID-19) Update: FDA Authorizes Monoclonal Antibody for Treatment of COVID-19. U.S. Food and Drrug Administration (FDA), 9. November 2020, abgerufen am 11. November 2020.
- ↑ A. Rössler: Notfallzulassung für Baricitinib in den USA. In: www.pharmazeutische-zeitung.de. 20. November 2020, abgerufen am 22. November 2020.
- ↑ Petra Jungmayr: USA: Notfall-Zulassung für erste SARS-CoV-2-Antikörpertherapie. In: Deutsche Apotheker Zeitung. 23. November 2020, abgerufen am 23. November 2020.
- ↑ USA: Notfallzulassung für Antikörper-Cocktail zur Covid-Behandlung. In: RND.de. 22. November 2020, abgerufen am 22. November 2020.
- ↑ Austria Presse Agentur (APA): Coronavirus – Antikörper-Cocktail erhält US-Notfallzulassung für Covid-Behandlung. In: Der Standard. Hrsg. Verlagsgesellschaft m.b.H, 22. November 2020, abgerufen am 23. November 2020.
- ↑ CORAT Therapeutics GmbH soll COVID-19-Medikament entwickeln NBank Capital beteiligt sich an Braunschweiger Biotech-Startup. Pressemitteilung des Niedersächsischen Ministeriums für Wirtschaft, Arbeit, Verkehr und Digitalisierung und des Niedersächischen Ministeriums für Wissenschaft und Kultur vom 16. September 2020 (PDF).
- ↑ Jens Spahn: Um eine Herdenimmunität zu erreichen, müssten sich in Deutschland demnach 55 bis 65 Prozent der Bürger impfen lassen, dpa, zit. in: kma online, Thieme Verlag, online 16. September 2020
- ↑ Laut Experten ist eine Durchimpfungsrate von 60 bis 70 Prozent der Bevölkerung für eine wirkungsvolle Bekämpfung der Corona-Pandemie nötig, in: Redaktionsnetzwerk Deutschland, online 15. Dezember 2020
- ↑ Bundesforschungsministerin Anja Karliczek: 60 Prozent bis 70 Prozent müssen sich impfen lassen, in: Arte TV, online 17. Dezember 2020
- ↑ Corona-Impfung: Wann sind genügend Menschen geimpft?, In: ZDF, online 29. November 2020
- ↑ Roy M. Anderson u.a.: Challenges in creating herd immunity to SARS-CoV-2 infection by mass vaccination, in: The Lancet, Band 396, Ausgabe 10263, 21. November 21 2020
- ↑ Europäische Arzneimittel-Agentur EMA wird bis 21. Dezember über BioNTech-Impfstoff entscheiden: Fragen und Antworten zum Zulassungsverfahren, Europäische Kommission, 15. Dezember 2020. Abgerufen am 15. Dezember 2020.
- ↑ Megan Molteni: Vaccine makers turn to microchip tech to beat glass shortages. Wired, 26. Juni 2020, abgerufen am 17. September 2020.
- ↑ Eine logistische Herausforderung, ZDF, 2. November 2020. Abgerufen am 11. November 2020.
- ↑ Siegfried und Biontech unterzeichnen Vertrag zur aseptischen Abfüllung eines COVID-19-Impfstoffes, Pressemeldung Siegfried Holding, 14. September 2020. Abgerufen am 11. November 2020.
- ↑ Gesundheitsminister beschließen Impfstrategie, Tagesschau, 7. November 2020. Abgerufen am 10. November 2020.
- ↑ Bis minus 80 °C: Wer soll Corona-Impfstoff liefern?, Apotheke ad hoc, 3. September 2020. Abgerufen am 10. November 2020.
- ↑ DHL-Studie stellt Konzept zur Impfstofflogistik vor, Deutsche Verkehrszeitung, 3. September 2020. Abgerufen am 10. November 2020.
- ↑ Corona-Impfstoff fordert Logistik heraus, Springer Professional, 5. Oktober 2020. Abgerufen am 10. November 2020.
- ↑ deep freeze challenge, Bloomberg, 10. November 2020. Abgerufen am 12. November 2020.
- ↑ Wie soll der Zugang zu einem COVID-19-Impfstoff geregelt werden?, Positionspapier der Ständigen Impfkommission beim Robert Koch-Institut, dem Deutschen Ethikrat und der Nationalen Akademie der Wissenschaften Leopoldina, 9. November 2020. Abgerufen am 9. November 2020.
- ↑ https://www.haaretz.com/israel-news/coronavirus-israel-live-ministers-to-debate-third-lockdown-as-cases-spike-1.9394419
- ↑ https://www.telegraph.co.uk/global-health/0/covid-19-vaccine-moderna-oxford-pfizer-update-coronavirus/
- ↑ https://www.nytimes.com/interactive/2020/us/covid-19-vaccine-doses.html?action=click&%3Bmodule=Top%20Stories&%3Bpgtype=Homepage&auth=login-google
- ↑ https://www.reuters.com/article/health-coronavirus-russia-vaccine/russia-repeats-91-4-efficacy-rate-in-new-covid-19-vaccine-data-developers-idUSKBN28O1OA
- ↑ https://www.theguardian.com/world/2020/nov/20/china-has-given-almost-a-million-people-experimental-covid-vaccine-says-company
- ↑ https://globalnews.ca/news/7534269/coronavirus-vaccine-canada-2021-optimistic-poll/
- ↑ Salzburg24: Israel will „grünen Pass“ für Geimpfte. 17. Dezember 2020, abgerufen am 20. Dezember 2020.
- ↑ COVID-19-related trafficking of medical products as a threat to public health. United Nations Office on Drugs and Crime, 2020, abgerufen am 10. November 2020.
- ↑ INTERPOL warns of organized crime threat to COVID-19 vaccines, Interpol, 2. Dezember 2020. Abgerufen am 2. Dezember 2020.
- ↑ Tom Kertscher: No, there is no vaccine for the Wuhan coronavirus. In: PolitiFact. Poynter Institute, 23. Januar 2020, abgerufen am 7. Februar 2020.
- ↑ Jessica McDonald: Social Media Posts Spread Bogus Coronavirus Conspiracy Theory. In: FactCheck.org. Annenberg Public Policy Center, 24. Januar 2020, abgerufen am 8. Februar 2020.
- ↑ Corona-Impfstoff-Mythen: Was ist dran an den Verschwörungstheorien? In: ruhr-24. 30. November 2020, abgerufen am 20. Dezember 2020.
- ↑ „Sie haben nicht verstanden, wie die neuen Impfstoffe funktionieren“. In: tagesspiegel. Abgerufen am 20. Dezember 2020.
- ↑ https://www.merkur.de/welt/coronavirus-deutschland-rki-covid-19-tote-infizierte-regierung-lockdown-impfung-stoff-zr-90145651.html