„COVID-19“ – Versionsunterschied
| [gesichtete Version] | [ungesichtete Version] |
K →Abschätzung des Sterberisikos: akt. Meyerowitz-Katz nun peer-rv |
Neuer Abschnitt zu Urpsrung ergänzt, Inhalte aus englischer Wikipedia übernommen, übersetzt und belegt. Markierungen: Zurückgesetzt Visuelle Bearbeitung |
||
| Zeile 573: | Zeile 573: | ||
Nach [[Berufskrankheiten-Verordnung|deutschem Recht]] kann COVID-19 als [[Berufskrankheit]] anerkannt werden, wenn der Erkrankte im Gesundheitsdienst, in der Wohlfahrtspflege oder in einem Laboratorium tätig oder durch eine andere Tätigkeit der Infektionsgefahr in ähnlichem Maße besonders ausgesetzt war.<ref>{{Internetquelle |autor=Berufsgenossenschaft Rohstoffe und chemische Industrie |url=https://www.bgrci.de/presse-medien/aktuelle-meldungen/informationen-zu-dem-neuen-coronavirus-sars-cov-2/ |titel=Informationen zu dem neuen Coronavirus (SARS-CoV-2) |hrsg=bgrci.de |abruf=2020-03-31}}</ref> |
Nach [[Berufskrankheiten-Verordnung|deutschem Recht]] kann COVID-19 als [[Berufskrankheit]] anerkannt werden, wenn der Erkrankte im Gesundheitsdienst, in der Wohlfahrtspflege oder in einem Laboratorium tätig oder durch eine andere Tätigkeit der Infektionsgefahr in ähnlichem Maße besonders ausgesetzt war.<ref>{{Internetquelle |autor=Berufsgenossenschaft Rohstoffe und chemische Industrie |url=https://www.bgrci.de/presse-medien/aktuelle-meldungen/informationen-zu-dem-neuen-coronavirus-sars-cov-2/ |titel=Informationen zu dem neuen Coronavirus (SARS-CoV-2) |hrsg=bgrci.de |abruf=2020-03-31}}</ref> |
||
== Ursprung == |
|||
Es wird angenommen, dass das Virus natürlichen Ursprungs ist<ref>{{Literatur |Autor=Kristian G. Andersen, Andrew Rambaut, W. Ian Lipkin, Edward C. Holmes, Robert F. Garry |Titel=The proximal origin of SARS-CoV-2 |Sammelwerk=Nature Medicine |Band=26 |Nummer=4 |Datum=2020-04 |ISSN=1546-170X |DOI=10.1038/s41591-020-0820-9 |PMC=7095063 |PMID=32284615 |Seiten=450–452 |Online=https://pubmed.ncbi.nlm.nih.gov/32284615/ |Abruf=2021-05-24}}</ref> und von einem Tier stammt und durch sog. Spillover-Infektion auf den Menschen übergegangen ist.<ref>{{Internetquelle |autor=Kevin Berger |url=http://nautil.us/issue/83/intelligence/the-man-who-saw-the-pandemic-coming |titel=The Man Who Saw the Pandemic Coming |datum=2020-03-12 |abruf=2021-05-24}}</ref> Es gibt unterschiedliche Theorien darüber, woher der erste Fall (der sogenannte Patient Null) stammt, Untersuchungen über den Ursprung der Pandemie sind im Gange.<ref>{{Internetquelle |autor=Fernando Duarte |url=https://www.bbc.com/future/article/20200221-coronavirus-the-harmful-hunt-for-covid-19s-patient-zero |titel=Who is 'patient zero' in the coronavirus outbreak? |abruf=2021-05-24 |sprache=en}}</ref> Die [[Phylogenetik]] geht davon aus, dass SARS-CoV-2 im Oktober oder November 2019 entstanden ist.<ref>{{Literatur |Autor=Xingguang Li, Junjie Zai, Qiang Zhao, Qing Nie, Yi Li |Titel=Evolutionary history, potential intermediate animal host, and cross-species analyses of SARS-CoV-2 |Sammelwerk=Journal of Medical Virology |Band=92 |Nummer=6 |Datum=2020-06 |ISSN=1096-9071 |DOI=10.1002/jmv.25731 |PMC=7228310 |PMID=32104911 |Seiten=602–611 |Online=https://pubmed.ncbi.nlm.nih.gov/32104911/ |Abruf=2021-05-24}}</ref><ref>{{Literatur |Autor=Kristian G. Andersen, Andrew Rambaut, W. Ian Lipkin, Edward C. Holmes, Robert F. Garry |Titel=The proximal origin of SARS-CoV-2 |Sammelwerk=Nature Medicine |Band=26 |Nummer=4 |Datum=2020-04 |ISSN=1546-170X |DOI=10.1038/s41591-020-0820-9 |Seiten=450–452 |Online=https://www.nature.com/articles/s41591-020-0820-9 |Abruf=2021-05-24}}</ref><ref>{{Literatur |Autor=Lucy van Dorp, Mislav Acman, Damien Richard, Liam P. Shaw, Charlotte E. Ford |Titel=Emergence of genomic diversity and recurrent mutations in SARS-CoV-2 |Sammelwerk=Infection, Genetics and Evolution |Band=83 |Datum=2020-9 |ISSN=1567-1348 |DOI=10.1016/j.meegid.2020.104351 |PMC=7199730 |PMID=32387564 |Seiten=104351 |Online=https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7199730/ |Abruf=2021-05-24}}</ref> Obwohl eine italienische Studie nahelegt, dass der Virus dort bereits im September 2019 vorhanden war.<ref>{{Literatur |Autor=Giselda Vagnoni |Titel=Researchers find coronavirus was circulating in Italy earlier than thought |Sammelwerk=Reuters |Datum=2020-11-16 |Online=https://www.reuters.com/article/health-coronavirus-italy-timing-idUSKBN27W1J2 |Abruf=2021-05-24}}</ref> Es gibt Hinweise darauf, dass es von einem Coronavirus abstammt, das wilde Fledermäuse infiziert und sich über einen Zwischenwirt in der Tierwelt auf den Menschen ausgebreitet hat.<ref>{{Internetquelle |autor=Deutsche Welle (www.dw.com) |url=https://www.dw.com/en/coronavirus-from-bats-to-pangolins-how-do-viruses-reach-us/a-52291570 |titel=Coronavirus: From bats to pangolins, how do viruses reach us? {{!}} DW {{!}} 26.03.2020 |abruf=2021-05-24 |sprache=en-GB}}</ref><ref>{{Internetquelle |url=https://www.npr.org/sections/goatsandsoda/2021/03/15/977527808/who-points-to-wildlife-farms-in-southwest-china-as-likely-source-of-pandemic |titel=WHO Points To Wildlife Farms In Southern China As Likely Source Of Pandemic |abruf=2021-05-24 |sprache=en}}</ref> |
|||
== COVID-19, Tiere und Haustiere == |
== COVID-19, Tiere und Haustiere == |
||
Version vom 24. Mai 2021, 19:57 Uhr
| Klassifikation nach ICD-10 | |
|---|---|
| U07.1 | COVID-19, Virus nachgewiesen |
| U07.2 | COVID-19, Virus nicht nachgewiesen |
| ICD-10 online (WHO-Version 2019) | |
COVID-19 (Abkürzung für englisch coronavirus disease 2019, deutsch Coronavirus-Krankheit-2019,[1][2][3][4] in deutschsprachigen Ländern umgangssprachlich auch nur Corona oder Covid genannt) ist eine meldepflichtige Infektionskrankheit, zu der es infolge einer Infektion mit dem neuartigen Coronavirus SARS-CoV-2 kommen kann und die ein breites, aber unspezifisches Symptomspektrum aufzeigt.[5] Das Virus wurde erstmals im Dezember 2019 in Wuhan (Volksrepublik China) beschrieben. Es verbreitete sich sehr schnell weltweit und war Ursache der COVID-19-Pandemie. Bis 20. Mai 2021 hatten sich weltweit bereits mehr als 164 Millionen Menschen infiziert; die Zahl der Todesopfer im Zusammenhang mit dem Virus belief sich auf mehr als 3,4 Millionen.[6]
Die Ansteckung mit SARS-CoV-2 erfolgt durch Tröpfcheninfektion oder durch das Einatmen virusbehafteter Aerosole, insbesondere bei Aufenthalt in geschlossenen, schlecht durchlüfteten Räumen. Das Robert Koch-Institut (RKI) schließt aber auch die Möglichkeit einer Schmierinfektion durch kontaminierte Oberflächen nicht aus.[7][8][9] Zur Vorbeugung einer Infektion werden deshalb räumliche Distanzierung („social distancing“), Kontaktbeschränkung, das Tragen medizinischer Schutzmasken und strenge Hygienemaßnahmen empfohlen.
Vieles deutet darauf hin, dass die Ausbreitung von COVID-19 zur weltweiten Pandemie insbesondere durch „Superspreading“ begünstigt wurde.[10]
Die Inkubationszeit von COVID-19 beträgt durchschnittlich fünf bis sechs Tage; zwischen Ansteckung und dem Auftreten erster Symptome können aber auch bis zu zwei Wochen vergehen. Vereinzelt treten erste Symptome schon innerhalb von 24 Stunden nach Ansteckung mit SARS-CoV-2 auf. Besonders tückisch ist, dass ein Infizierter bereits Tage vor dem Auftreten erster Symptome, sowie auch noch nach deren Abklingen, ansteckend sein kann.[11]
Der Krankheitsverlauf ist unspezifisch und kann stark variieren. Laut Schätzung des RKI haben 55 bis 85 % der Infizierten spürbare Beschwerden und/oder zeigen erkennbare Anzeichen einer Erkrankung (Symptome) oder typische Symptomkombinationen (Syndrom) einer COVID-19-Erkrankung (Manifestationsindex); die übrigen Infizierten sind beschwerdefrei und zeigen keine Symptome, sind also asymptomatisch erkrankt (können das Virus aber dennoch potenziell weiterverbreiten).[11][12] Bei rund 81 % der registrierten Erkrankungen ist ein leichter Verlauf mit Fieber oder einer leichten Lungenentzündung und weniger schwerwiegenden Symptomen wie trockenem Husten und Müdigkeit zu beobachten. Weniger häufig sind eine verstopfte Nase, Kopf-, Hals- und Gliederschmerzen, Bindehautentzündungen, Durchfall, Erbrechen, Geschmacks- und Geruchsverlust, Hautausschlag oder Verfärbung von Fingern oder Zehen.[13] Bei etwa 14 % der Fälle ist der Verlauf schwerer, und in etwa 5 % so schwer, dass eine intensivstationäre Beatmung der Patienten erfolgen muss.[14] Bei schwerem Verlauf von COVID-19 erkranken die Infizierten an einer beidseitigen Lungenentzündung, erleiden akutes Lungenversagen und können auch sterben.[11] Beobachtet wurden außerdem krankhafte Prozesse der Leber,[15] des zentralen Nervensystems,[16] der Nieren,[17] der Blutgefäße[18] und des Herzens.[19][20]
Anhaltende Beschwerden nach der Erkrankung, auch als „Long COVID“ bezeichnet, scheinen häufiger vorzukommen als zuerst angenommen. Sie können sowohl bei anfänglich schwer Erkrankten[21] wie auch bei jungen, gesunden,[22] anfänglich nur leicht Erkrankten auftreten und können zu langanhaltenden chronischen Beschwerden in vielen Organsystemen führen.[23] Im Gegensatz zur natürlichen Infektion sind bei bisher über 100.000 Teilnehmern von COVID-Impfstudien (Stand Dezember 2020) keine Hinweise auf Long Covid beobachtet worden.[24][25][26] Long Covid ist Thema laufender Forschung.[27][28][29][30]
COVID-19 ist seit Beginn der Pandemie Gegenstand intensiver Forschung. Die Ergebnisse werden international geteilt. Es ist üblich, aktuelle Studien online als Preprints zu veröffentlichen (anstatt zum Beispiel den Peer-Review abzuwarten).[31]
Bereits Ende des Jahres 2020 erfolgte in der Europäischen Union und in einigen Ländern außerhalb der EU die Zulassung von Impfstoffen zur Vorbeugung gegen die durch das Virus verursachte Erkrankung COVID-19 und der Einsatz im Rahmen von Impfkampagnen. Das Wissenschaftsmagazin Science erklärte die Entwicklung von Impfstoffen gegen das SARS-CoV-2 in nie dagewesener Geschwindigkeit zum Breakthrough of the Year, dem wissenschaftlichen Durchbruch des Jahres.[32]
Bezeichnung
Das Akronym »COVID-19« wurde als offizielle Bezeichnung am 11. Februar 2020 von der WHO festgelegt und stammt aus dem Englischen: CO für Corona, VI für Virus, D für Disease (Krankheit) und 19 für das Jahr der Erstbeschreibung 2019.
Ursache und Krankheitsentstehung
Auslöser der Erkrankung ist das Betacoronavirus SARS-CoV-2, das erstmals im Januar 2020 aufgrund von Isolaten aus Pneumoniepatienten identifiziert wurde.[33]
Übertragungsweg
Das Virus wurde bisher im Sekret des Nasen- und Rachenraumes, im Sputum, im Stuhl, der Tränenflüssigkeit, im Blut, in Aerosolen und auf Oberflächen nachgewiesen.[11][34][35][36] Hauptübertragungsweg für SARS-CoV-2 ist die respiratorische Aufnahme virushaltiger Flüssigkeitspartikel (Atmen, Husten, Sprechen, Niesen). Weitere Ansteckungswege (Stuhl, Tränenflüssigkeit, Blut) sind nicht abschließend geklärt.
Am 20. Januar 2020 gab die chinesische Gesundheitskommission bekannt, dass eine Mensch-zu-Mensch-Übertragung möglich sei,[37][38] insbesondere wenn zwei Personen engen Kontakt zueinander haben (weniger als 1,8 m Abstand[39] bzw. weniger als 1,5 m Abstand[11]).
Aerosol- und Tröpfcheninfektion

Es wird angenommen, dass sich das Virus wie andere Erreger von Atemwegserkrankungen hauptsächlich durch virushaltige Partikel verbreitet. Diese werden von Infizierten beim Atmen, Husten, Niesen, Sprechen und Singen freigesetzt und dann von gesunden Personen aufgenommen. Der Übergang zwischen Aerosol- und Tröpfcheninfektion ist fließend.[40] Die Weltgesundheitsorganisation (WHO) definiert Tröpfchen als Partikel mit einem Durchmesser von 5 bis 10 Mikrometer (μm).[41] Auf Grund ihrer Größe sinken Tröpfchen anders als die viel kleineren Aerosolpartikel relativ schnell zu Boden. Diese sind nur ca. 0,001 bis 5 μm groß und verteilen sich mit den Luftströmungen in Räumen und Gebäuden auch über größere Distanzen; abhängig von ihrer Größe und Dichte können sie dort sehr lange in der Luft verbleiben. Das Risiko für eine Übertragung durch Aerosole ist bei Tätigkeiten mit hohem Partikelausstoß wie lautem Sprechen oder Singen in kleinen, schlecht gelüfteten Räumen wesentlich höher als im Freien.[40] Deshalb müssen insbesondere für Wohnungen, Büros, Klassenräume, Wohnanlagen und Betreuungseinrichtungen wirkungsvolle Maßnahmen zur Vorbeugung einer Infektion festgelegt und auch umgesetzt werden.[42][43]
In klimatisierten Innenräumen, z. B. in Krankenhäusern, können Tröpfchen im Größenbereich von 5 bis 40 μm – bedingt durch ihr aerodynamisches Verhalten als „jet riders“ (Transport mit Luft-Jet und Air Conditioning-induzierter Luftbewegung, Ausfallen in größerer Distanz, schlechte Elimination mit Ventilation) – ganz besonders gut Krankheitserreger übertragen.[44]
Im Freien finden so gut wie keine Infektionen durch Aerosolpartikel statt. Allerdings können Tröpfcheninfektionen auftreten, insbesondere in Menschenansammlungen, wenn Mindestabstände nicht eingehalten und/oder keine Masken getragen werden.[43]
Eine biophysikalische Studie des MIT stellte Anfang 2020 experimentell fest, dass Flüssigkeitspartikel beim Husten oder Niesen ohne mechanische Barriere bis zu acht Meter weit verbreitet werden können. Dies stellt das aus dem frühen zwanzigsten Jahrhundert stammende Tröpfcheninfektionsparadigma in Frage.[45] Anhand einer Auswertung von Virusgenomen bei Superspreaderevents schätzen Forscher, dass die meisten Infektionen ab einer Übertragung von rund 1.000 Viruspartikeln erfolgen. Es seien aber auch Infektionen durch geringere Virusdosen möglich.[46]
Chinesische Forscher schrieben im Februar 2020 aufgrund von quantitativen Analysen von RT-PCR-Untersuchungen des Nasopharynx, das Virus sei wie Influenza auch durch Aerosole übertragbar.[47][48] Eine Studie des US-amerikanischen NIAID stützt diese Ansicht anhand quantitativer Viruslastbestimmung in Aerosolen. Die Untersuchung hat gezeigt, dass die Viren in Aerosolen, die durch einen maschinellen Vernebler erzeugt wurden, wenigstens drei Stunden lang entwicklungsfähig und damit infektiös blieben. Es dauerte etwa 66 Minuten, bis die Hälfte der Viren ihre Ansteckungsfähigkeit in Aerosolen verloren.[49] Eine Metastudie von 24 Studien zeigte, dass von 473 untersuchten Luftproben aus Krankenhäusern mit COVID-Patienten 17 % Erbmaterial des Virus enthielten und in 9 % der untersuchten Proben das Virus in Kultur angezüchtet werden konnte. Dabei wiesen sowohl Luftproben aus Patientennähe als auch entfernt vom Patienten genommene Luftproben virushaltige Aerosole auf.[50]
Bei 3 von 63 Patienten mit COVID-19-Pneumonie waren Abstriche von den Augenbindehäuten PCR-positiv.[51] Das Robert Koch-Institut schreibt (Stand 11. Dezember 2020) dazu: In drei (von 63 untersuchten) Patienten mit COVID-19-Pneumonie waren Konjunktivalproben PCR-positiv […]. Dies ist jedoch kein Beleg [dafür], dass Konjunktiven als Eintrittspforte fungieren können.[11] In einer Tierstudie (März 2020) konnte ein Rhesusaffe über die Augenbindehäute mit SARS-CoV-2 infiziert werden. Dieser Affe hatte eine geringere Viruslast in der Lunge als ein intratracheal infizierter Affe, aber eine höhere Viruslast in Nase, Auge und Tränenwegen.[52]
Bei manchen untersuchten Patienten mit Krankheitssymptomen war die Virenmenge in der Nase höher als im Rachen; das Auftreten gerade in den oberen Atemwegen unterscheidet SARS-CoV-2 damit von dem SARS-verursachenden SARS-CoV-1.[47] Probenuntersuchungen der dem Münchener Cluster zugehörigen Patienten zeigen, dass die vorhandene Viruslast im Nasen-Rachen-Raum um den Faktor 1.000 höher war als bei zuvor bekannten Coronavirus-Erkrankungen wie SARS und MERS.[53] Eine vorveröffentlichte Studie konnte keinen Unterschied der Viruslast unter den verschiedenen Altersgruppen feststellen.[54]
Kontaktübertragung
In einer sehr kleinen Studie wurde nachgewiesen, dass per Polymerase-Kettenreaktion (PCR) in Schlaf- und Waschräumlichkeiten von Coronapatienten hohe Viruslasten an Textilien und den Oberflächen selbst nachweisbar sind. Da in der Studie keine Viruskultur erfolgt ist, ist die Infektiosität nicht abschließend bewiesen.[55] Das Bundesinstitut für Risikobewertung (BfR) schrieb im Mai 2020 dazu, es seien keine Fälle nachgewiesen, in denen sich Menschen durch den Verzehr kontaminierter Lebensmittel oder durch Kontakt zu kontaminierten Gegenständen mit SARS-CoV-2 angesteckt hätten. Da die Stabilität von Coronaviren in der Umwelt relativ gering sei, wäre eine solche Ansteckung allenfalls in einem kurzen Zeitraum nach der Kontamination denkbar.[56]
Eine Auswertung von 22 Studien, die die Persistenz von medizinisch relevanten Coronaviren (wie SARS-CoV und MERS-CoV) auf Oberflächen untersuchten, zeigt, dass diese Viren bei Raumtemperatur bis zu neun Tage lang auf Oberflächen aus Metall, Glas oder Plastik überdauern können. Durchschnittlich bleiben sie vier bis fünf Tage infektiös. Durch geeignete Desinfektionsmittel können sie inaktiviert werden. Nach Aussage der beteiligten Wissenschaftler sollten diese Erkenntnisse auf SARS-CoV-2 übertragbar sein.[57][58] Vorläufige Laboruntersuchungen an SARS-CoV-2 zeigen, dass das Virus auf Kunststoff und rostfreiem Stahl bis zu drei Tage infektionsfähig bleiben kann, jedoch nicht länger als einen Tag auf Pappe oder länger als vier Stunden auf Kupfer.[49] Laut Robert Koch-Institut sei eine Infektion durch kontaminierte Oberflächen „insbesondere in der unmittelbaren Umgebung des Infizierten nicht auszuschließen“.[11] Das ECDC wies in einem Statement zur Risikobewertung zu COVID-19 auf die Übertragbarkeit des Virus durch von Tröpfchen bedeckte Oberflächen hin.[59] Die US-amerikanischen National Institutes of Health schrieben im März 2020 nach quantitativen Untersuchungen der Viruslast in verschiedenen Szenarien hingegen, dass eine Übertragung durch kontaminierte Gegenstände und Oberflächen stattfinden kann, da das Virus mehrere Stunden (in speziellen Fällen sogar bis zu drei Tage) nach der Kontamination außerhalb des menschlichen Körpers nachweisbar ist.[49][60]
Anhand von Untersuchungen mittels Viruskultur konnte gezeigt werden, dass, abhängig von den Umweltbedingungen, auch nach dem Aufenthalt des Virus auf Gegenständen eine Infektiosität besteht.[61]
Insgesamt ist die Bedeutung der Kontaktübertragung für das Pandemiegeschehen von COVID-19 gering bis sehr gering.
Andere Übertragungswege
Forscher aus Singapur empfehlen aufgrund des Virusnachweises im Stuhl und des Nachweises von infektionsfähigen Coronaviren im Abwasser von zwei chinesischen Krankenhäusern während der SARS-Pandemie 2002/2003, den Stuhl der Patienten als infektiös zu behandeln. Um die Möglichkeit eines fäkal-oralen Infektionswegs neben Tröpfchen- und Aerosol-Infektionen auszuschließen, seien weitere Untersuchungen sowohl der Virusausscheidung der Patienten als auch der potentiell kontaminierten Umwelt notwendig.[62] Probenuntersuchungen mittels Viruskultur der dem Münchener Cluster zugehörigen 16 Patienten zeigen hingegen, dass deren Stuhl nicht virulent war, obschon sich Virus-RNA nachweisen ließ.[53] Dahingegen berichten chinesische Forscher von zwei Fällen ohne Durchfallbeschwerden, bei denen mittels Viruskultur und Elektronenmikroskopie vermehrungsfähiges Virus im Stuhl nachgewiesen werden konnte.[63] Dies konnte von einer anderen Forschungsgruppe bestätigt werden.[64] Ein Zellkulturmodell mit Virus-RNA-haltigen Abwasserproben konnte kein vermehrungsfähiges Virus nachweisen.[65]
Eine Übertragung im Mutterleib ist in mehreren Einzelfällen nachgewiesen.[66][67]
Anteil bestimmter Bevölkerungsgruppen
Risikogruppen für schwere Verläufe sind nach Aussage des Robert Koch-Instituts insbesondere Ältere und Vorerkrankte.[68] Eine Mitte Februar 2020 veröffentlichte Auswertung der englischsprachigen und chinesischen Fachartikel kommt zu dem Ergebnis, dass alle Bevölkerungsgruppen infiziert werden können. Von den Infizierten waren 72 % über 40 Jahre alt, 64 % waren männlich. 40 % der Patienten hatten chronische Erkrankungen wie Diabetes mellitus und Bluthochdruck.[38] Dies bestätigt der Bericht der von der WHO in China durchgeführten „gemeinschaftlichen Mission“ (englisch WHO-China joint mission), der weiterhin noch Herz-Kreislauf-Erkrankungen, chronische Atemwegserkrankungen und Krebs nennt.[69]
Das RKI weist darauf hin, dass eine Häufung schwerer Krankheitsverläufe bei älteren Personen und Personen mit Vorerkrankungen beobachtet wurde. Als Vorerkrankungen werden Erkrankungen des Herz-Kreislaufsystems, der Lunge, der Niere und auch der Leber genannt. Auch Krebskranke, Zuckerkranke und stark fettleibige Menschen sind vermehrt von einem schweren Krankheitsverlauf betroffen, ebenso wie Patienten, die krankheits- oder medikationsbedingt über ein eingeschränktes Immunsystem verfügen. Schwere Krankheitsverläufe treten aber auch bei Patienten ohne Vorerkrankung und Jüngeren auf. Laut einer Metastudie vom Dezember 2020 erkranken Männer und Frauen zwar etwa gleich häufig an COVID-19, bei Männern ist jedoch ein schwerer Krankheitsverlauf dreimal häufiger als bei Frauen.[70] Auch eine Analyse des Robert Koch-Instituts kam zu dem Ergebnis, dass Männer häufiger schwer erkranken.[71] Daneben gibt es eine schwache Evidenz für eine höhere Krankheitsschwere bei Nikotinabhängigen.[72]
Ein Bericht der Centers for Disease Control and Prevention zur Altersverteilung in den USA kam zu dem Schluss, dass schwere Verläufe, die eine Hospitalisierung oder intensivmedizinische Versorgung erfordern, bei Erwachsenen jeden Alters auftreten können. Zwar seien besonders Ältere betroffen, allerdings waren 20 % der Hospitalisierten und 12 % der intensivmedizinisch Behandelten des untersuchten Kollektivs 20–44 Jahre alt. Jünger als 20 Jahre alte Personen zeigten hingegen so gut wie keine schweren Verläufe.[73] Außerdem berichtete das CDC, dass Menschen mit dunklerer Hautfarbe in den USA überdurchschnittlich betroffen sind. In einer Auswertung der Daten bis Anfang August 2020 hatte die Gruppe der „Black or African American People“ demnach eine 4,7-fache Hospitalisierungs- und eine 2,1-fache Todesrate.[74]
Laut einer im Lancet am 30. April 2021 publizierten Beobachtungskohortenstudie[75] hat COVID-19 ethnische Minderheiten in Großbritannien überproportional betroffen. Die Quantifizierung anhand einer Analyse der Daten von Public Health England ergab, dass die Todesfälle durch COVID-19 bei Menschen aus ethnischen Minderheiten zwei- bis viermal höher waren als in der weißen Bevölkerung. Als Gründe wurden in Betracht gezogen eine höhere Prävalenz von Komorbiditäten im Zusammenhang mit schlechten COVID-19-Ergebnissen (z. B. Typ-2-Diabetes bei britischen Südasiaten), eine größere soziale Benachteiligung, große Haushalte mit mehreren Generationen, Unterschiede beim beruflichen Expositionsrisiko sowie der verzögerter Zugang zur Gesundheitsversorgung.
Eine Studie an Kindern aus Wuhan stellte eine bestätigte Infektion bei 171 von 1.391 untersuchten Kindern fest. Nur eine Minderheit der Kinder zeigte Fieber oder andere Symptome. Von den infizierten Kindern verstarb ein 10 Monate alter Säugling, der auch an einer Invagination litt. Die Studienautoren werteten die Ergebnisse als einen Hinweis auf einen milderen Verlauf bei Kindern und wiesen auf die Möglichkeit der Übertragung der Erkrankung durch Kinder mit wenig Krankheitszeichen hin.[76] Auch in einer Studie in Island, bei der insgesamt 19.996 Personen auf eine aktive Infektion getestet wurden, zeigten sich Kinder deutlich unterrepräsentiert.[77] Eine Analyse von 2.135 Patienten im Kindesalter in China, die aufgrund eines positiven Tests oder der klinischen Beschwerden als COVID-19 klassifiziert wurden, ergab eine Rate von schweren und kritischen Verläufen von rund sechs Prozent. Gehäuft traten diese bei Säuglingen und Kindern im Vorschulalter auf.[78]
Eine südkoreanische Studie, welche die Kontaktverfolgung von rund 60.000 Kontaktpersonen nachvollzog, kam zu dem Schluss, dass das Risiko, von einem Haushaltsmitglied im Alter von 10 bis 19 Jahren angesteckt zu werden, hoch sei. Die niedrigere Rate der Infektionen in Haushalten mit Klein- und Grundschulkindern wurde auf die im Studienzeitraum herrschenden Schulschließungen zurückgeführt. Im Ergebnis zeigte die großangelegte Studie, dass das Übertragungsmuster des neuartigen Coronavirus dem anderer Atemwegsviren ähnelt.[79]
Im September 2020 veröffentlichten Forscher des Max-Planck-Instituts Leipzig eine Studie, die neben Alter und Vorerkrankungen einen genetischen Faktor als Determinante für einen schweren Krankheitsverlauf postulierte. Eine gewisse Gruppe von Genen auf Chromosom 3 sorge laut den Autoren Zeberg und Pääbo für ein dreimal höheres Risiko, dass im Verlauf der Krankheit eine künstliche Beatmung nötig wird. Es handle sich dabei um eine von den Neandertalern ererbte Genvariante. Über den Grund der Korrelation zwischen diesen Genen und dem Krankheitsverlauf ist noch nichts bekannt.[80][81] Ende Februar 2021 wurde in diesem Kontext eine russische Studie veröffentlicht, die die Beschaffenheit der T-Lymphozyten auf den Zelloberflächen für den Krankheitsverlauf in Teilen verantwortlich macht. Die individuelle genetische Zusammensetzung des HLA-Systems spiele bei der Immunantwort auf das Virus eine fundamentale Rolle. Gewisse Allele des HLA-I scheinen das Virus besser detektieren zu können und das Immunsystem könne schneller reagieren.[82] Eine Studie an 323 COVID-19-Patienten ergab, dass eine erhöhte Konzentration von Perfluorbutansäure im Körper mit einem gesteigerten Risiko eines schwereren Verlaufs einer COVID-19-Infektion korreliert ist.[83][84]
Laut Epidemiologischem Bulletin 19/2021 des RKI steigt nach Auswertung von rund 94.000 Krankheitsfällen das Risiko für einen schweren Verlauf einer COVID-19-Erkrankung beim Vorliegen bestimmter Risikofaktoren.[85] Demnach sind die fünf größten Risikofaktoren hämatoonkologische Erkrankungen (31,5 %), metastasierte solide Tumorerkrankungen mit Therapie (28,2 %), Demenz (24,3 %), metastasierte solide Tumorerkrankungen ohne Therapie (23,3 %) und Herzinsuffizienz (21,7 %). Die Analyse-Ergebnisse sollen laut Bulletin „eine einfache, im Versorgungsalltag unkompliziert umsetzbare und dabei möglichst effektive Grundlage für die Impfrangfolge in der ambulanten ärztlichen Versorgung bilden“.
Basisreproduktionszahl
Die Auswertung der Daten der ersten 425 Fälle in Wuhan ergab eine Basisreproduktionszahl von 2,2[86] – was bedeutet, dass jeder Infizierte im Durchschnitt 2,2 andere Personen angesteckt hatte. Eine Modellrechnung mit chinesischen und ausländischen Patientendaten vom 31. Dezember 2019 bis zum 28. Januar 2020 ergab einen Wert von 2,68.[87] Eine Auswertung des frühen Stadiums des Ausbruchs auf dem Kreuzfahrtschiff Diamond Princess kam auf einen Wert von 2,28.[88] Im Vergleich hierzu wurde für SARS eine Basisreproduktionszahl von 2,3 bis 2,6 berechnet.[89] Eine vergleichende Auswertung von 12 Studien, die bis zum 7. Februar 2020 veröffentlicht wurden, kommt zu dem Ergebnis, dass die Basisreproduktionszahl höher liegt, als bisher von der WHO angenommen, deren Schätzung bei 1,4 bis 2,5 liegt.[38] Die Wissenschaftler aus Schweden, China und Deutschland schätzten, dass die Basisreproduktionszahl im Mittel bei 3,28, im Median bei 2,79 (bei einem Interquartilabstand von 1,16) liegt – und somit über dem Wert bei SARS, den sie mit 2 bis 5 angeben. Aufgrund der unzureichenden Datenlage sind die aktuellen Schätzungen der mittleren Basisreproduktionszahl möglicherweise verzerrt.[90] In einem am 7. April 2020 veröffentlichten Artikel schätzen die Centers for Disease Control and Prevention die Basisreproduktionszahl ohne eindämmende Maßnahmen auf 5,7 bei einem 95 %-Konfidenzintervall von 3,8 bis 8,9.[91][92]
Eine internationale Studie, die 539 Sozialkontakte eines Patienten untersuchte, stellte fest, dass dieser eine Patient 2 von 7 engen Sozialkontakten, und 3 von 473 flüchtigen Sozialkontakten angesteckt hatte.[93]
In einem von Christophe Fraser, Luca Ferretti und Kollegen entwickelten mathematischen Infektionsmodell[94] kann die Basisreproduktionszahl (nach den Autoren beim Wert 2,0) aufgeteilt werden nach der Art der Übertragung: präsymptomatisch, asymptomatisch, symptomatisch und über Umweltkontakt (z. B. Schmierinfektion). Danach ist der Wert von allein aus präsymptomatischer Übertragung 0,9 (entsprechend 46 Prozent an dem Gesamtwert von ), also fast ausreichend, um eine Epidemie am Laufen zu halten. Der Beitrag der symptomatischen Überträger ist nach den Autoren 0,8, der asymptomatischen 0,1 und der Umwelt 0,2. Die Generationszeit ist nach der Studie im Mittel 5,0 Tage. Die Studie untersuchte mit ihrer mathematischen Simulation auch die Erfolgsaussichten der Isolation symptomatischer Individuen und der manuellen Kontaktverfolgung und kam zu dem Schluss, dass sie nicht schnell genug sind, um die Epidemie zu stoppen. (Sie empfehlen die Verwendung von Apps auf Mobiltelefonen.)
Superspreading
Die Neigung von COVID-19 zum Superspreading wird durch Überdispersion angezeigt. Überdispersion beschreibt das Phänomen einer hohen individuen-spezifischen Variation in der Verteilung der Anzahl der Sekundärübertragungen, die zu „Superverbreitungsereignissen“ führen kann. Der Grad an Überdispersion lässt sich durch ein statistisches Modell schätzen, bei dem die Verteilung der Sekundärübertragungen durch den Überdispersionsparameter und die Basisreproduktionszahl charakterisiert wird.[95] Der Überdispersionsparameter quantifiziert die Variabilität in der Anzahl der Sekundärfälle und kann als Maß für die Wirkung von Superspreading interpretiert werden. Je kleiner der geschätzte Überdispersionsparameter, desto stärker ist die Wirkung von Superspreading.[96] Die Interpretation des geschätzten Überdispersionsparameters wird vereinfacht, indem sich auf den Anteil der Individuen konzentriert wird, der für 80 % der Sekundärübertragungen verantwortlich ist (ein empirisches Muster, bekannt als 80/20-Regel). Wenn der Überdispersionsparameter klein ist (), approximiert er den Anteil infizierter Personen, die 80 % der Infektionen verursachen. Beispielsweise würde ein geschätzter Überdispersionsparameter von 0,1 bedeuten, dass die infektiösesten 10 % der Personen etwa 80 % der Infektionen verursachen.[97]
Julien Riou und Christian Althaus kamen durch Simulationen zu dem Schluss, dass der geschätzte Überdispersionsparameter bei COVID-19 etwas höher sei als der bei SARS-CoV und MERS-CoV.[98] In einem Preprint von Gabriel Leung und Kollegen, in dem Kontaktpersonennachverfolgungsdaten verwendet wurden, um SARS-CoV-2-Cluster in Hongkong zu identifizieren und zu charakterisieren, wurde der Überdispersionsparameter auf 0,45 geschätzt (95 %-Konfidenzintervall: [0,31–0,76]). Dies stelle eine beträchtliche individuelle Heterogenität in der Übertragbarkeit von SARS-CoV-2 dar und ist damit mit einem hohen Potenzial für zukünftiges Superspreading verbunden, allerdings nach ihren Resultaten weniger stark als bei SARS-CoV und MERS-CoV.[99] Spätere Studien gehen von einem geschätzten Überdispersionsparameter von etwa 0,1 aus.[97] Es gibt empirische Belege dafür, dass die Verteilung der Anzahl der Sekundärübertragungen „fette Verteilungsenden“ aufweist. Außergewöhnliche Übertragungsereignisse sind daher zwar extreme, aber dennoch wahrscheinliche Ereignisse, die einen beträchtlichen Beitrag zur Gesamtübertragung leisten (siehe dazu ausführlich in Überdispersion#Anwendung in der Epidemiologie).
Inkubationszeit, Serielles Intervall und Zeitspanne der Infektiosität

Inkubationszeit
Die Inkubationszeit kann laut Informationen des Robert Koch-Instituts (RKI) bis zu 14 Tage betragen.[100] Das RKI und auch eine statistische Auswertung mehrerer Berichte von Infektionen in einem Haushalt oder in anderer enger räumlicher Begrenzung (sogenannte Cluster) haben die Inkubationszeit auf 5–6 Tage im Median beziffert.[101] In Korea wurde anhand der Daten von 303 Patienten mit einem Durchschnittsalter von 25 Jahren der Zeitraum zwischen erstem Positivtest und Krankheitssymptomen zu 15 Tagen (Ø) ermittelt. Die Abklingzeit bis zum Negativtest betrug bei symptomatischen 19,5 und bei asymptomatischen Patienten 17 Tage.[102] Eine Analyse der ersten 425 in Wuhan gemeldeten Fälle ergab eine Inkubationszeit von im Mittel 5,2 Tagen und ein Durchschnittsalter von 59 Jahren. Die Autoren vermuteten, dass bereits Mitte Dezember 2019 im Umfeld des Fischmarktes Übertragungen von Mensch zu Mensch stattfanden.[86]
Infektiosität während der Inkubationszeit und im Verlauf mit oder ohne Symptome
Eine Ansteckung anderer Menschen während der Inkubationszeit ist trotz beschwerdefreien Gesundheitszustands möglich. Tests auf die Viruslast im Sputum von Patienten legen außerdem den Verdacht nahe, dass manche Patienten auch während der Ausheilung bei klinischer Besserung weiterhin vorübergehend infektiös sein können.[103] In einer Gruppe von 126 aus Wuhan nach Deutschland Evakuierten zeigten sich zwei Patienten in der RT-PCR des Rachenabstrichs positiv, die keine oder nur sehr unspezifische Beschwerden aufwiesen.[104] Ebenso ist ein Fall eines subjektiv asymptomatischen zehnjährigen Jungen in Shenzhen beschrieben, dessen Blutbild und Entzündungszeichen im Labor unauffällig waren. In der weiteren Untersuchung zeigten sich jedoch radiologische Befunde vereinbar mit einer Pneumonie, und im Rachenabstrich ließ sich Virus-RNA nachweisen.[34]
In einer Untersuchung einer dreiköpfigen Familie aus Guangzhou im Februar 2020 waren alle Familienmitglieder PCR-positiv, aber nur der Vater zeigte Symptome. Die Autoren hielten es hypothetisch für möglich, dass nicht der Vater der Patient 1 gewesen sein könnte, sondern ebenso auch die anderen beiden asymptomatischen Personen hierfür in Frage kommen, und warnten aufgrund dessen vor einer Verbreitungsgefahr des Virus durch beschwerdefreie Patienten in frühen Infektionsstadien.[105] Messungen der Viruslast im Sekret des Nasenrachenraums von 14 mit COVID-19 diagnostizierten Patienten ergaben eine ähnlich hohe Viruslast bei symptomfreien Patienten (einer von 14 Untersuchten) und solchen mit Symptomen (13 von 14 Untersuchten, von denen zehn leicht bis mittelschwer erkrankten und drei so schwer, dass sie intensivmedizisch behandelt werden mussten).[47] Aufgrund von quantitativen Virusuntersuchungen im Sekret des Nasenrachenraums bei Patienten mit sehr leichten Symptomen schlossen die Forscher der Virologie der Charité und des Instituts für Mikrobiologie der Bundeswehr, dass auch bereits bei sehr milden Erkrankungssymptomen eine hohe Infektionsfähigkeit besteht.[106][107] Auch das Robert Koch-Institut hat über einzelne Fälle berichtet, bei denen sich Betroffene möglicherweise bei infizierten Personen angesteckt haben, die noch keine oder keine spezifischen Symptome hatten.[108] Zum gleichen Ergebnis kamen chinesische Fallbeobachtungen, bei denen asymptomatische Patienten im häuslichen Umfeld andere Menschen ansteckten.[109][110]
Eine weitere Studie aus China kam anhand von Kontaktpersonennachverfolgung und der Analyse des Virusgenoms zu der Vermutung, dass die Bildung eines Infektionsclusters auf eine asymptomatische Person zurückging. Die vermutete asymptomatische Patientin 1 kehrte am 19. März 2020 aus den USA zurück und wurde aufgefordert, sich in häusliche Quarantäne zu begeben. Sie wohnte im selben Haus, befand sich jedoch nie in körperlicher Nähe mit den später Infizierten und wurde selbst nie PCR-positiv getestet. Etwa 20 Tage nach der vermuteten Ansteckung des Clusters war ihr IgG-Wert positiv, für die Autoren ein Hinweis („indicating“), dass sie früher mit SARS-CoV-2 infiziert war. Die Autoren glaubten („we believe“) deshalb, dass sie die asymptomatisch Infizierte war und dass Patient 2 durch Kontakt mit Oberflächen im Aufzug des Gebäudes, in dem beide wohnten, infiziert wurde. Außerdem zeigte eine Analyse des Virusgenoms, dass es sich vom bisher in China zirkulierenden Genom unterschied – für die Autoren ein Hinweis („indicating“), dass es aus dem Ausland stammte und vermutlich („suggesting“) Patient 1 der Ursprung des Infektionsbaums war.[111]
In einer Studie an 191 Krankenhauspatienten zeigten chinesische Forscher bei den 137 Überlebenden ein positives Testergebnis der RT-PCR für im Mittel zwanzig Tage mit einer Streuung zwischen acht und 37 Tagen.[112] Eine vorveröffentlichte Analyse von Infektionen in Singapur und Tianjin ergab, dass 48 % bis 62 % der Infektionen von Menschen übertragen wurden, die COVID-19-infiziert waren, aber noch keine Symptome zeigten.[113]
Ein wesentlicher Unterschied zum SARS-Coronavirus ist, dass Patienten schon einige Tage vor Einsetzen der Krankheitssymptome infektiös sein können (beim SARS-Coronavirus waren die Patienten hingegen erst nach Auftreten der Symptome infektiös). Die Infektion lässt sich daher schwerer erkennen und schwieriger eindämmen. Bei Quarantänemaßnahmen reicht es deswegen nicht aus, nur die klinisch auffälligen Personen zu isolieren.[114] Eine im April 2020 veröffentlichte chinesische Untersuchung[115] bestätigte die große Rolle von präsymptomatischer Übertragung bei COVID-19. Aus den Daten berechneten sie (wie sich später zeigte, mit einem Rechenfehler, siehe unten), dass bei den untersuchten Fällen die Infektiosität 2 bis 3 Tage vor Ausbildung von Symptomen begann. Untersucht wurden 94 Fälle aus einem Krankenhaus in Guangzhou, bei denen der zeitliche Verlauf der Viruslast im Rachen ermittelt wurde. Sie war bei Symptombeginn schon ausgeprägt und zeigte danach einen Abfall. Außerdem wurden 77 Fälle von Paaren aus einer Infektionskette innerhalb und außerhalb von China untersucht. Diese zeigte, dass die Infektion bei 44 Prozent vor Ausbildung von Symptomen beim Infizierenden stattfand. Die Infektionsperiode begann im Mittel 2,3 Tage vor Symptombeginn und hatte einen Höhepunkt 0,7 Tage vor Symptombeginn. Innerhalb einer Woche nahm die Infektiosität rasch ab. Das serielle Intervall betrug im Mittel 5,8 Tage. Bei einer Nachuntersuchung der Daten von Leung und Kollegen fand ein Team um Sebastian Bonhoeffer von der ETH Zürich einen Fehler im Computerprogramm, durch den zwei Datenpunkte versehentlich wegfielen. Tatsächlich begann die infektiöse Periode etwa 5 Tage vor Beginn der Symptome. Der Anteil präsymptomatischer Ansteckungsfälle von rund 45 Prozent bleibt aber gleich.[116][117] Leung und Kollegen haben den Fehler eingeräumt. Die Korrektur hat auch Auswirkung auf das Kontakt-Tracing, das auf 5 bis 6 Tage vor Symptombeginn (statt wie bisher 2 bis 3 Tage) ausgedehnt werden müsste.
Infektiosität von Genesenen
Ärzte der Sun-Yat-sen-Universität in Guangzhou berichten von einem Fall, der nach einem milden Verlauf und zwei negativen RT-PCR-Ergebnissen aus Abstrichmaterial erneut ohne Beschwerden einen positiven Virusnachweis ergeben habe. Die Studienautoren empfehlen routinemäßige Tests und eine zweiwöchige Quarantäne auch bei beschwerdefreien Ausgeheilten, um potenzielle Neuinfektionen zu verhindern.[118] Eine Studie aus Peking stellte im März 2020 bei 22 von 133 entlassenen Patienten bei negativem Rachenabstrich weiterhin nachweisbare Virus-RNA im Stuhl oder im Sputum fest. Die Autoren empfahlen zum Ausschluss einer Infektionsgefahr durch entlassene Patienten über den Rachenabstrich hinausgehende RT-PCR-Testung.[119]
Serielles Intervall
Das serielle Intervall, das heißt der zeitliche Abstand vom Beginn der Erkrankung einer Person zum Beginn der Erkrankung einer von ihr infizierten Person in einer Infektionskette, betrug nach einer im Januar 2020 veröffentlichten chinesischen Studie mit 425 Patienten im Mittel 7,5 Tage (Standardabweichung 3,4 Tage),[86] nach einer anderen Studie mit 28 Fällen 4 Tage.[11][120] Auch eine Studie mit 468 bestätigten Infektionspaaren aus ganz China im Januar/Februar 2020 kam auf ein serielles Intervall von im Mittel 3,96 Tagen (95 %-Konfidenzintervall 3,53 bis 4,39 Tage, Standardabweichung 4,75 Tage).[121] Darunter waren auch 59 Fälle (12,6 Prozent der Fälle), in denen die Symptome beim Infizierten früher auftraten als bei der infizierenden Person.
In einer Studie zu 312 Übertragungen wurde als Mittelwert des seriellen Intervalles 4,46 Tage angegeben. Darin wurden Übertragungen bereits am ersten Tag nach der Ansteckung festgestellt. Am dritten Tag war das Übertragungsrisiko am höchsten. Nach 10 Tagen sank das Übertragungsrisiko deutlich ab, war aber immer noch vorhanden.[122]
Krankheitsentstehung bei COVID-19
Das COVID-19 auslösende Virus SARS-CoV-2 dringt wie SARS-CoV-1 bei SARS über eine Bindung an das in der Zellmembran verankerte Enzym ACE2 in die menschliche Zelle ein.[123] Dabei interagiert das virale Spike-Protein mit ACE2. Für diesen Prozess ist die Mitwirkung der Serinprotease TMPRSS2 notwendig.[124] Im Versuch mit HeLa-Zellen, die ACE2 des Menschen, der Chinesischen Hufeisennase (Rhinolophus sinicus), einer Schleichkatzenart, des Hausschweins und der Maus exprimieren, konnte SARS-CoV-2 das jeweilige ACE2-Protein als Rezeptor nutzen, um in die Zelle einzudringen, nur bei dem Maus-ACE2 gelang dies nicht, ebenso wenig bei HeLa-Zellen, die kein ACE2 bildeten. An Rezeptoren, die von anderen Coronaviren genutzt werden, findet keine Bindung von SARS-CoV-2 statt.[123]
Eine reverse Suche in einer humanen Zelltypen- und Genexpressions-Datenbank (Human Cell Atlas, kurz: HCA) nach Zelltypen und Geweben, bei denen neben ACE2 auch TMPRSS2 auf Membranoberflächen vorhanden ist, zeigte, dass in der Nasenschleimhaut vor allem den Becherzellen, aber auch den Flimmerepithelen die höchsten Konzentrationen dieser beiden Proteine auftreten. Daher werden diese Zellen als Eintrittspforte für SARS-CoV-2 angesehen und auch als Reservoir vermutet.[125][126] Die Proteine werden ebenso in den Hornhaut-Zellen des Auges, in der Darmschleimhaut sowie im Herz in Perizyten der Blutkapillaren, Herzmuskelzellen und Fibroblasten gebildet. Dabei bleibt die erste Phase des Befalls im Nasenrachen nahezu symptomfrei, während bei Übergang in eine schwere Verlaufsform überwiegend die Lunge angegriffen wird, da ein Großteil der ACE-2 exprimierenden Zellen des Menschen in den Typ-II-Pneumozyten der Lunge vorkommt.[127][128] Als weitere Gründe für die besondere Anfälligkeit der Lunge wird ihre große Oberfläche angegeben,[128] außerdem verfügen die ACE2-exprimierenden Pneumozyt-Typ-II-Zellen über diverse Gene, die die Replikation und Transmission von SARS-CoV-2 begünstigen.[127] Bei Untersuchungen an kryokonservierten Lungengewebsproben von Nichtinfizierten konnte auch gezeigt werden, dass Lungengewebe kaum ACE2 sowie die Transmembranprotease TMPRSS2 ausbildet, die Pneumozyten Typ II in der Lunge hingegen vermehrt. Diese Vorläuferzellen waren bei Männern und in fortgeschrittenem Alter tendenziell vermehrt nachzuweisen. Neben unterschiedlichen ACE2-Werten bei Männern und Frauen wird eine Ursache für die unterschiedliche Schwere der Erkrankung im geschlechtsspezifischen Hormonhaushalt vermutet: „Östrogen fördert eine Immunantwort, Testosteron dagegen unterdrückt sie“.[129] Neu ist auch, dass im Lungenepithel und benachbarten Gewebezellen die Proprotease Furin co-exprimiert wird, was wiederum dem Virus den Zellzutritt vereinfacht, da es am Spike-Protein eine Furin spezifische Trennstelle aufweist. Außer in der Lunge wurde ACE-2 auch im Dünn- und Dickdarm, in den Atemwegen und in den Nieren nachgewiesen.[130] Eine Vermehrung des Virus in Darmzellen[131] und Inselzellen der Bauchspeicheldrüse wurde bestätigt.[132]
Durch Untersuchung von Lungengewebe mittels Biopsien oder Autopsien konnte ein diffuser Schaden an den Lungenbläschen nachgewiesen werden. Dieser zeigte sich in der Bildung hyaliner Membranen, der Verdickung der Alveolarwände und der Einwanderung von einkernigen Immunzellen und Makrophagen. Elektronenmikroskopisch ließen sich Viruspartikel in den Pneumozyten Typ 2 und den Zellen der Bronchien nachweisen. Neben den Veränderungen in der Lunge wurden auch Nekrosen der Lymphknoten am Lungenhilus, Lebervergrößerungen mit Entzündungszellinfiltrat, Atrophien der Milz und bei einzelnen Patienten vereinzelte degenerierte Nervenzellen des Gehirns beobachtet. Ob die Schäden außerhalb der Lunge direkt dem Virus oder der allgemeinen Belastung des Organismus durch die Erkrankung zuzuschreiben sind bleibt unklar.[133] In einer anderen Obduktionensserie zeigten sich herdförmige kleinste Thromben in den Lungenkapillaren auch in Abwesenheit von größeren Thrombosen im Organismus. Darüber hinaus zeigte sich bei fortgeschrittener Erkrankung auch ein fibrotischer Umbau der Lungenareale. Eine diffuse alveoläre Schädigung wie beim klassischen ARDS zeigte sich nur bei Patienten, die auch invasiv beatmet worden waren. Die Autoren schlossen daraus, dass die Bildung der Blutgerinnsel in den kleinsten Blutgefäßen den führenden Mechanismus der COVID-assoziierten Lungenschädigung darstellte.[134]
Das Eindringen des Virus in die Riechsinneszellen über die Nasenschleimhaut ist nachgewiesen. Eine Ausbreitung des Virus über diese Nervenzellen in das zentrale Nervensystem wird vermutet.[135] In einigen wenigen Fällen wurde das Auftreten eines Guillain-Barré-Syndroms diagnostiziert, das oft mit Virusinfektionen assoziiert ist. Die Patienten waren PCR-positiv – ein Liquornachweis gelang nicht. In der Bildgebung waren die Cauda equina, sowie der Nervus facialis auffällig darstellbar. Symptomatisch zeigten sich Parästhesien und Paresen (motorische Ausfälle).[136] In einem weiteren Fallbericht wurde eine virusinduzierte Encephalitis auch durch positiven PCR-Nachweis in der Cerebrospinalflüssigkeit bestätigt.[137] Die Deutsche Gesellschaft für Neurologie (DGN) empfiehlt in einer eigens für die COVID Erkrankung herausgegebenen Leitlinie eine fortlaufenden Kontrolle besonders stationär, aber auch ambulant versorgter Patienten auf Frühzeichen neurologischer Mitbeteiligung.[138]

Italienische Intensivmediziner haben im April 2020 aufgrund ihrer klinischen Beobachtungen für das Vorhandensein zweier Erscheinungsformen der COVID-19-Viruspneumonie plädiert. Die Pneumonie beginne meist mit dem L-Typ, der sich durch ein geringes Vorhandensein eines Ödems im Gewebe auszeichne. Bei einem Teil der Patienten erfolge der Übergang in einen H-Typ, der sich durch ein Ödem im Gewebe auszeichne. Die Forscher plädieren für eine unterschiedliche Vorgehensweise bei der Beatmung dieser zwei Typen.[139] Bei Vorliegen extrem erniedrigter Sauerstoffsättigung, die auf eine massive Gasaustauschstörung schließen lässt und in Verbindung mit einer Bildgebung eindeutig auf ein akutes Lungenversagen (ARDS) deutet, weichen deutsche Pneumologen mittlerweile auch von bisherigen Leitlinien ab und empfehlen zunächst eine lungenschonendere nichtinvasive Beatmung (NIV) mit O2-Anreicherung.[140] Weitere führende Pneumologen regten ebenfalls aufgrund der vermehrten Endothelschäden befallener Lungengefäße an, nicht die klassische Beatmungsstrategie für ein entzündliches Pneumonitis-ARDS, sondern bei noch gegebener Elastizität mit an das von ihnen zur Unterscheidung als CARDS benannte klinische Bild bei COVID durch adaptierte Tidalvolumina und Expirationsdrucke (PEEP) anzupassen.[141]
Eine feingewebliche Untersuchung an sechs verstorbenen Patienten zeigte bei den fortgeschrittenen Lungenerkrankungen, die klinisch dem H-Typ zuzuordnen sind, die Ausbildung von Fibrinballen in den Lungenbläschen mit einem Infiltrat aus T-Lymphozyten und Plasmazellen sowie einer Hyperplasie der Typ-II-Pneumozyten. In den Blutgefäßen fanden sich Zeichen einer Endothelschädigung mit Ausbildung von Vakuolen im Zellplasma sowie der Unterbrechung der Verbindungen zwischen den Endothelzellen. Die Autoren stellten die Hypothese auf, dass der H-Typ als spätere Verlaufsform der COVID-Lungenkrankheit feingeweblich das Bild einer akut-fibrinösen organisierenden Pneumonie zeige.[142] Eine Untersuchung der Lungen von sieben Verstorbenen zeigte eine deutlich erhöhte Gefäßneubildung durch Lumenteilung in den befallenen Lungengefäßabschnitten. Die Autoren stellten die Hypothese auf, dass die krankhaft gesteigerte Gefäßneubildung zum Lungenschaden beitrage.[143]
Beim Übergang von milden zu schweren Verläufen wird mittlerweile ein virusinduzierter septischer Schock angenommen, der auf einem immunologischen Mechanismus basiert. Bei milden Fällen gelinge es dem Immunsystem, die Virusvermehrung in der Lunge rasch aufzuhalten. Bei schweren Fällen gelänge dies aber durch die virusbedingte Dysfunktion der direkt infizierten T-Zellen nicht. Die Virusvermehrung in den Lungenepithelzellen und auch den Innenschichtzellen der Lungenkapillaren führe zu einem Kapillarleck, das zur Einlagerung von Flüssigkeit in den Lungenbläschen führe. Durch die unkontrollierte Virusvermehrung komme es zu einer weiteren Einwanderung von Monozyten und Granulozyten. Dabei waren entzündungsverstärkende Zytokine und Chemokine einschließlich TNF-α, Interleukin-1β, IL-6, CXCL10, CCL2 und MIP-1α signifikant erhöht, wodurch sich Immunzellen am Ort einer Entzündung ansammeln und die Immunantwort verstärkt wird. Die Entzündungsreaktion in der Lunge führe zusammen mit dem Übergreifen des Virus auf andere Organe zu einer überschießenden Immunreaktion im Sinne des Zytokinsturms, der wiederum lokal zu weiterer Zellschädigung führt und im Anschluss die Lymphozytenzahl – besonders CD4+- und CD8+-T-Zellen – reduziert (Lymphopenie).[144] Bei milden Verläufen wurde kein signifikanter Abfall von Effektor-T-Zellen beobachtet. Bei schweren Verläufen korreliert deren Wiederanstieg mit der Heilung der Erkrankung.[145] Ebenso fand sich in einer kleinen Studie dass überlebende Patienten vor allem IgG-Antikörper gegen das Spike-Protein bilden und an der Erkrankung Verstorbene vor allem IgG-Antikörper gegen das Nucleocapsid ausbilden.[146]
Als weiterer Mechanismus wird eine direkte Freisetzung des spezifischen Transkriptionsfaktors NF-κB angesehen, die wiederum IL-6 hochreguliert. Zusätzlich ist durch die infektionsbedingte Reduktion von ACE2 ein Anstieg von Serum-AngII beobachtbar, was wiederum über die AngII-AT1R-Achse auch NF-κB, Disintegrin und die Sekretase ADAM17 (englisch ADAM metallopeptidase domain 17) aktiviert, die die reife Form der Liganden des epidermalen Wachstumsfaktor-Rezeptors (EGFR) und TNFα, sowie zwei NF-κB-Stimulatoren erzeugt.[147] Die ADAM17-Induzierung verarbeitet auch die Membranform von IL-6Rα zur löslichen Form (sIL-6Rα), gefolgt von der gp130-vermittelten Aktivierung von STAT3 über den IL-6/sIL-6Rα-Komplex in IL-6Rα-negativen Zellen, wie Fibroblasten, Endothel- und Epithelzellen.[148] So kann eine SARS-CoV-2-Infektion im Atemtrakt sowohl NF-κB als auch STAT3 aktivieren, was wiederum den IL-6-Verstärker (englisch IL-6 amplifier, kurz IL-6 Amp) in Gang setzt, einem Mechanismus für die weitere Überaktivierung von NF-κB durch STAT3, was zu unterschiedlichen Enzündungs- und Autoimmunkrankheiten führt.[148] Dabei wird der IL-6-Verstärker in einer positiven Rückkopplungsschleife durch die Induzierung verschiedener entzündungsfördernder Zytokine und Chemokine, einschließlich Interleukin-6, und die Rekrutierung von lymphoiden und myeloischen Zellen, wie zum Beispiel aktivierte T-Zellen und Makrophagen, verstärkt. Dieser Prozess wird als Zytokinsturm bezeichnet und ist die Ursache für das akute Lungenversagen bei einer SARS-CoV-2-Infektion. Da IL-6 als wichtiger Marker für Seneszenz gilt, könnte der IL-6-Verstärker auch für die höhere Mortalität unter Älteren angesehen werden.[149]
Vergleichende Untersuchungen mit anderen Formen des akuten Lungenversagens und Entzündungssyndromen kommen jedoch zu dem Schluss dass die Menge der freigesetzten Entzündungsmediatoren bei einer schweren COVID-19-Erkrankung deutlich niedriger ist als bei anderen mit einem Zytokinsturm vergesellschafteten Erkrankungen. Dies wird als Hinweis gewertete dass auch andere Mechanismen der Krankheitsentstehung wie Gefäßentzündung, direkte virale Schädigung oder durch das Virus induzierte Immunschwäche stark zur Schwere der Erkrankung beitragen.[150]
Interferon-1 ist ein zentraler Regler der zellulären Immunantwort gegen Viren. Im Gegensatz zu anderen respiratorischen Viren zeichnet sich COVID durch eine Verminderung von Interferon-1 und Interferon-3 aus.[151] Ebenso wurde eine Verminderung der Produktion von Interferon-1 durch das Virusprotein Orf9b im Zellmodell nachgewiesen.[152] In einer Studie wurden bei 3,5 % Prozent untersuchter COVID-Patienten mit schwerem Verlauf angeborene Defekte der Interferon-1-Bildung festgestellt.[153]
Forscher aus Wuhan haben im März 2020 in einer Studie auch von Herzmuskelschäden berichtet. Bei rund einem Fünftel der 416 untersuchten hospitalisierten Patienten zeigte sich neben der Lungenschädigung auch eine Schädigung des Herzmuskels. Die Ursache der Herzschädigung sei noch nicht klar. Sie vermuteten eine negative Wirkung der im Rahmen der Pneumonie ausgelösten Entzündungsreaktion[154] sowie eine direkte Infektion und erhöhter Stress des Herzens durch die mangelnde Sauerstoffversorgung und die höhere Kreislaufbelastung. Bei Autopsien zeigten sich Entzündungsinfiltrate, die mit Regionen von Zelluntergang korrelierten. Das Bild der Herzmuskelschädigung war in diesen Fällen vereinbar mit einer Myokarditis.[27] Deren Ausbildung ohne bekannte koronare Vorerkrankung wurde auch ohne Beteiligung der üblichen Pneumonitis beobachtet.[155] Mit dem Alter steigt die Expression von ACE2 und TMPRSS2 in Herzmuskelzellen an, über die der Zellzutritt erfolgt. Die Schädigung der Kardiomyozyten ist korreliert mit dem Anstieg von Troponin, einem typischen Marker für Herzinfarkt. Resultiert eine Pumpschwäche des linken Ventrikels, könne das die verminderten Überlebenschancen Älterer erklären. Diese Zusammenhänge, sowie eine höhere Expression eines IL-6 Rezeptors auf Kardiomyozyten im Alter, der für den Zytokinsturm verantwortlich ist, wurde bei postmortem Untersuchungen des Herzens von Patienten gefunden, die nicht an kardialen Erkrankungen, aber auch nicht durch SARS-CoV-2 verstarben.[156] Im Fall zweier relativ junger und nicht vorerkrankter Patienten, die aufgrund geschilderter Symptome einen grippeähnlichen Infekt durchgemacht hatten, zeigte sich 4 Wochen später Atemnot, die den Verdacht einer Herzmuskelfunktionsstörung nahelegte. PCR-Tests der zur Verdachtsabklärung entnommenen Biopsate waren positiv, sodass die Herzerkrankung als Folge einer SARS-CoV-2-Infektion vermutet wird.[157] In einer weiteren Fallserie wurde in Gewebeproben von 104 Patienten, die wegen des Verdachts einer Myokarditis oder anderer entzündlicher Herzkrankheiten untersucht wurden, bei 5 von ihnen das Virusgenom von SARS-CoV-2 nachgewiesen. Bei allen – zwischen 36 und 62 Jahre alt – war es zu einer deutlichen Pumpschwäche gekommen und Troponin bei 4 der 5 Patienten erhöht. Die Studie legt nahe, dass nach einer COVID-19 Erkrankung mit einer Herzbeteiligung zu rechnen ist, obwohl der direkte Nachweis, dass das Virus den Herzmuskel angreift, noch nicht erbracht sei.[158]
Ebenso konnte eine Virusvermehrung im Tubulus (Nierenkanälchen) mit akuter Schädigung des Tubulus durch die nachfolgende Entzündungsreaktion an einzelnen Obduktionsfällen nachgewiesen werden.[159]
In seltenen Einzelfällen tritt bei Kleinkindern vermehrt das Kawasaki-Syndrom auf, eine Gefäßentzündung bei der als Begleitsymptom z. B. Hautausschläge auftreten. Ein direkter Zusammenhang mit einer SARS-CoV-2 Infektion wird vermutet.[160][161] Von der WHO wurde dieses Krankheitsbild multisystem inflammatory syndrome in children (MIS-C) benannt.[162] Mit Stand 1. Juli sind weltweit mehr als 1000 Kinder mit diesem eher seltenen Syndrom erkrankt. In einer Studie wurden 186 Fälle diagnostiziert, wobei das Durchschnittsalter bei 8,3 Jahren lag. Die Inzidenz beträgt 2 auf 100.000. Die ersten Anzeichen etwa 2 bis 4 Wochen nach Infektion bestehen in hohem Fieber, Tachykardie, gastrointestinalen Symptomen, Hautausschlag sowie konjunktivalen Injektionen. CRP war bei allen, außerdem D-Dimer-Werte und Troponin bei den meisten erhöht. Etwa die Hälfte zeigte Zeichen einer Myokarditis, 80 % mussten intensiv behandelt werden. Zwei Kinder verstarben.[163]
Klinische Symptome und laborchemische Krankheitszeichen
| Symptom | Häufigkeit |
|---|---|
| Fieber | 87,9 % |
| Trockener Husten | 67,7 % |
| Unwohlsein und Ermüdung | 38,1 % |
| Auswurf | 33,4 % |
| Riechverlust[164][165][166][167] | 30–71 % |
| Kurzatmigkeit | 18,6 % |
| Muskel- oder Gelenkschmerz | 14,8 % |
| Halsschmerzen | 13,9 % |
| Kopfschmerz | 13,6 % |
| Schüttelfrost | 11,4 % |
| Übelkeit/Erbrechen | 5,0 % |
| Schnupfen | 4,8 % |
| Durchfall | 3,7 % |
| Bluthusten | 0,9 % |
| Schwellung der Bindehaut | 0,8 % |
| Quelle: WHO,[69] wo nicht anders angegeben | |
Eine Abgrenzung von anderen Viruserkrankungen wie Influenza nur anhand der Symptome ist „schwierig bis unmöglich“.[168] Auch andere Erreger und Diagnosen können das Krankheitsbild beeinflussen (siehe Syndrome, Komorbidität und Multimorbidität), beispielsweise Erkältungsviren wie Rhino-, Entero- und Mastadenoviren, Paramyxoviridae oder andere Coronaviren. Sie können durch eine Differentialdiagnose mit mikrobiologischem Befund ein- oder ausgeschlossen werden.
Nach einer Inkubationszeit von typischerweise 5 bis 6 Tagen (in seltenen Fällen bis zu 14 Tagen)[108] können Fieber, Muskelschmerzen und trockener Husten auftreten. Häufig manifestiert sich die Krankheit auch mit allgemeinem, schwerem Krankheitsgefühl und auch Rückenschmerzen.[169]
Im weiteren Verlauf kann sich eine schwere Atemnot aufgrund einer Infektion der unteren Atemwege bis zur Lungenentzündung entwickeln.[170] Diese kann mit Brustschmerzen im Sinne einer Pleuritis einhergehen. Die Mehrheit der Patienten zeigte die für schwere Virusinfekte typische Kombination aus einer Verminderung der Anzahl der gesamten weißen Blutzellen, einer Verminderung der Lymphozyten-Anzahl und einer Erhöhung laborchemischer Entzündungsparameter (wie CRP und BSG). Wenige Betroffene leiden auch unter Schnupfen, Übelkeit und Durchfall.[108]
In der Studie einer britischen Forschergruppe fand sich bei 59 % von 1702 positiv getesteten COVID-Patienten ein Verlust des Geruchssinns (Anosmie) und des Geschmackssinns (Ageusie) gegenüber 18 % bei der virusnegativen Kontrollgruppe.[164] In einer kleineren Studie durch direkte Patientenuntersuchung zeigten rund 70 % der untersuchten Patienten dieses Krankheitszeichen.[167] An der Johns-Hopkins-Universität wurde an Gewebeproben von 23 COVID-19-freien Patienten die höchste Expression des Enzyms ACE2 in dem Areal der Nase nachgewiesen, das für das Riechen verantwortlich ist, und so der Geruchsverlust bei Infektion erklärt.[171]
Aufgrund klinischer Beobachtungen und laborchemischer Untersuchungen wird ein dreiphasiges Krankheitsbild postuliert. Auf eine frühe Infektionsphase folge nach rund fünf Tagen eine Phase, in der die Lungenerkrankung vorherrscht. Bei einem weiteren Fortschreiten der Erkrankung komme es um den zehnten Tag nach Symptombeginn zu einer Phase, die durch eine überschießende Immunantwort mit weiterer zunehmender Schädigung der Lunge sowie auch des Herzmuskels gekennzeichnet sei. In der letzten Phase komme es auch zur Erhöhung von Troponin und BNP als Ausdruck der Herzmuskelschädigung und des Funktionsverlusts des Organs.[27] Zu nahezu identischer Einschätzung dieses Drei-Phasen-Verlaufs, der frühen Infektion, der pulmonalen Manifestation und der schweren hyperinflammatorischen Phase mit jeweils differenzierten Therapieempfehlungen zur maschinellen Beatmung während der einzelnen Stadien kommt ein diagnostisch-therapeutischer Leitfaden deutscher Lungenärzte.[140]
Im Bericht des Chinesischen Zentrums für Krankheitskontrolle und -prävention (englisch Chinese Center for Disease Control and Prevention, kurz: CCDC) über 44.415 Fälle aus Wuhan erfolgt die Klassifizierung als leichter Krankheitsverlauf, wenn keine oder nur eine leichte Lungenentzündung vorliegt, für einen schweren Krankheitsverlauf sind Pneumonie (Lungenentzündung), Dyspnoe (Atemnot), eine Atemfrequenz von ≥ 30 Atemzüge pro Minute, eine Sauerstoffsättigung des Blutes ≤ 93 % und weitere klinische Anzeichen typisch, bei einem kritischen Krankheitsverlauf ist mit Atemversagen, septischem Schock und/oder Multiorganversagen zu rechnen. Der Fallbericht stellte 81 % leichte Krankheitsverläufe, 14 % schwere Krankheitsverläufe und bei 5 % einen kritischen Krankheitsverlauf fest.[14] Bei einem leichten Verlauf bestehen laut RKI häufig keine Symptome,[11] oder sie klingen laut WHO innerhalb von zwei Wochen ab.[172] Bei Menschen mit einem schweren Krankheitsverlauf dauere es zwischen drei und sechs Wochen, bis sie sich von der Krankheit erholen.[172]
Die Mehrheit der Krankenhauseinweisungen der ersten Patienten erfolgte nach rund einwöchiger symptomatischer Krankheit aufgrund einer Verschlechterung des Zustandes. In den Fällen, in denen eine intensivmedizinische Behandlung notwendig wurde, ergab sich deren Notwendigkeit nach rund zehn Tagen nach Symptombeginn.[170] In einer epidemiologischen Studie von 99 hospitalisierten Fällen fanden bei 13 Patienten eine nicht-invasive Beatmung, bei vier Patienten eine invasive Beatmung, bei neun Patienten eine Dialyse aufgrund eines Nierenversagens und bei drei Patienten eine extrakorporale Lungenunterstützung (ECLA) Anwendung.[173] Klinische Beobachtungen schildern häufig geringe Beschwerden trotz apparativ messbarer Ateminsuffizienz. So zeigten sich Patienten, die aufgrund einer geringen Sauerstoffsättigung eigentlich beatmungspflichtig waren, oft erst noch relativ beschwerdefrei,[174] ehe sich ihr Befinden aufgrund der Sauerstoffschuld im Organismus rapide verschlechterte.[175]
Etwa 85 % der schwer erkrankten COVID-19-Patienten entwickeln eine Lymphopenie, das heißt einen Mangel an Lymphozyten im Blut.[176] Bei tödlich verlaufenden Erkrankungen kam es zu einer anhaltenden Lymphopenie. Die schwer erkrankten Patienten entwickeln häufig zudem eine Hyperzytokinämie (Zytokinsturm).[177] Ein Zytokinsturm entsteht durch eine Überreaktion des Immunsystems. Diese Überreaktion ist durch einen deutlichen Anstieg von entzündungsrelevanten Zytokinen wie beispielsweise Interleukin-6, Interleukin-8, Interleukin-1β und TNF-α gekennzeichnet. Die verstärkte Freisetzung dieser Zytokine führt zu einer Überproduktion von Immunzellen, vor allem im Lungengewebe. Dort werden von den Immunzellen weitere Zytokine ausgeschüttet (Mitkopplung). Diese unkontrollierte Immunantwort führt zu schweren entzündlichen Erkrankungen wie beispielsweise Lungenentzündung, Atemnot und Entzündungen der Atemwege.[178][179]
Laborchemisch erwiesen sich sehr hohe Ferritinwerte sowie stark erhöhtes Interleukin-6[112] oder auch erhöhte Werte der LDH, des D-Dimers und eine andauernde Verminderung der Lymphozyten als Faktoren für eine ungünstige Prognose.[180]
Zytokinsturm und Lymphopenie werden als „lymphopenische ambulant erworbene Pneumonie“ (englisch lymphopenic community acquired pneumonia, L-CAP) zusammengefasst. L-CAP ist mit schwerem Krankheitsverlauf, erhöhter Sterblichkeit und fehlgesteuerter Immunantwort verbunden. Man geht davon aus, dass eine frühzeitige Erkennung dieses immunologischen Phänotyps nützlich sein könnte, um Patienten mit schweren Verläufen rechtzeitig identifizieren zu können.[181]
Aus der Auswertung von Erkrankungsverläufen der ersten 50 Patienten aus dem Kreis Heinsberg, die im Uniklinikum Aachen teils intensivmedizinisch behandelt wurden, ergab sich laut einer Studie neben den bekannten Risikofaktoren für einen schweren Verlauf noch eine Risikoerhöhung bei Patienten mit Adipositas (Übergewicht). Eine Lymphozytopenie wurde in dieser kleinen Patientenkohorte nicht beobachtet, die schwer erkrankten Patienten wiesen hingegen alle eine deutliche Leukozytose auf.[182]
Wie bei Erwachsenen, zählen bei Kindern zu den Symptomen Husten und Fieber, außerdem Magen-Darm-Probleme mit oder ohne Durchfall. Meist verläuft die Erkrankung ohne oder nur mit leichten Symptomen. Bei Kindern mit Vorerkrankungen des Atemwegs- oder Herzsystems, Säuglingen und Kleinkindern sind schwere Verläufe, die intensivmedizinisch behandelt werden müssen, bekannt. In mehreren Ländern wurde bei Kindern das MIS-C-Syndrom beobachtet.[183]
Diagnostik
Falldefinition und Vorgehensweise bei der Diagnostik
Verdachtsfall
Die Falldefinitionen des Robert Koch-Instituts wurden am 24. März 2020 geändert,[184] auf der Website des Robert Koch-Instituts ist ein Flussschema zu finden, wie im medizinischen Bereich mit COVID-19-Verdachtsfällen umzugehen ist:[185] Ebenso wurde dort ein Flussschema für Bürger bereitgestellt, mit Hinweisen zum Verhalten bei Erkrankungssymptomen.[186]
- Begründete Verdachtsfälle
Personen
- mit akuten respiratorischen Symptomen (Symptome, die den Atemtrakt betreffen) jeder Schwere und Kontakt zu einem bestätigten COVID-19-Fall bis maximal 14 Tage vor Erkrankungsbeginn,
- bei denen klinische oder radiologische Hinweise auf eine durch Viren verursachte Lungenentzündung (Pneumonie) vorliegen und ein epidemischer Zusammenhang (mehrere Fälle von Pneumonien) in einer Pflegeeinrichtung oder einem Krankenhaus wahrscheinlich ist oder vermutet wird,
werden vom Robert Koch-Institut als begründeter Verdachtsfall eingestuft und den zuständigen Gesundheitsämtern gemeldet.[185]
- Fälle unter differenzialdiagnostischer Abklärung
Personen
- mit akuten respiratorischen Symptomen jeder Schwere ohne Kontakt zu einem bestätigten COVID-19-Fall bis maximal 14 Tage vor Erkrankungsbeginn, dafür Tätigkeit in Pflege, Arztpraxis oder Krankenhaus, oder Zugehörigkeit zu Risikogruppe, oder ohne bekannte Risikofaktoren,
- bei denen klinische oder radiologische Hinweise auf eine durch Viren verursachte Pneumonie (ohne Alternativdiagnose) vorliegen ohne Kontakt zu einem bestätigten COVID-19-Fall,
werden vom Robert Koch-Institut als Fall unter differenzialdiagnostischer Abklärung eingestuft und sollen zunächst nicht gemeldet werden.[185]
In beiden Fällen wird nach Schwere der Erkrankung, Risikofaktoren und Umfeld entschieden, ob eine ambulante oder eine stationäre Versorgung notwendig ist. Bei einer stationären Einweisung wird in jedem Fall eine labortechnische Diagnose durchgeführt, bei der ambulanten Versorgung ist sie Bestandteil der Differentialdiagnose, bei Personen ohne bekannte Risikofaktoren jedoch nur, sofern die Testkapazitäten dies erlauben.[185]
Labordiagnostischer Nachweis

Laut RKI erfolgt der labordiagnostische, direkte Erregernachweis durch Nukleinsäurenachweis (z. B. RT-PCR, real-time quantitative Reverse-Transkriptase-Polymerase-Kettenreaktion).[184][187] Auch die Erregerisolierung in einer Zellkultur ist möglich,[184] wird aber von der WHO nicht für die Routinediagnostik empfohlen,[188] siehe auch Abschnitt Virus- und Antikörpernachweis.
Das Virus ist im Sputum, im Trachealsekret, in der bronchoalveolären Spülflüssigkeit und im Nasenrachen-Abstrich sowie im Stuhl direkt nachzuweisen.[189] Die Laboruntersuchung führte in Deutschland erstmals das Konsiliarlabor für Coronaviren an der Charité in Berlin durch, mittlerweile sind zahlreiche andere Labore in Deutschland dazu in der Lage.[190]
Bei positivem Befund liegt nun ein laborbestätigter COVID-19-Fall vor.[185] Ist der Befund zwar negativ, besteht aber ein anhaltend hoher Verdacht auf eine Infektion mit dem neuartigen Coronavirus, wird empfohlen, die Diagnostik zu wiederholen. Erste Erfahrungen mit COVID-19 aus China zeigten, dass gerade zu Beginn der Infektion nur etwa 70 % der Patienten positiv in der RT-PCR-Testung waren, während es insgesamt 94 % nach der zweiten Testung waren.[191]
Für einen indirekten Nachweis (Antikörpernachweis)[114] soll das Blutserum betroffener Personen aufbewahrt werden.[185][188] (Stand: 13. April 2020)
Definition: »COVID-19-Fall«
Ein COVID-19-Fall liegt nach Definition der Weltgesundheitsorganisation (WHO) vor, wenn durch Labortests bei einer Person eine Infektion mit dem Coronavirus SARS-CoV-2 nachgewiesen wurde – ungeachtet klinischer Anzeichen und Symptome –und demzufolge auch, wenn eine Corona-Infektion asymptomatisch (ohne erkennbare Symptome) verläuft.[192] Darüber hinaus definiert die WHO auch noch den Verdachtsfall und den wahrscheinlichen Fall. Sie weist darauf hin, dass sich diese Definitionen angesichts neuer Erkenntnisse ändern können und dass die Mitgliedsstaaten die Definitionen an ihre besondere epidemische Lage anpassen können.[192]
In Deutschland werden COVID-19-Fälle von den Gesundheitsämtern entsprechend den folgenden Falldefinitionen an das Robert Koch-Institut (RKI) übermittelt:[184]
- mittlerweile entfallen: (Klinisch-epidemiologisch bestätigte Erkrankung: zeigt das spezifische oder unspezifische klinische Bild einer COVID-19-Erkrankung ohne labordiagnostischen Nachweis)[193],
- Klinisch-labordiagnostisch bestätigte Erkrankung: zeigt das spezifische oder unspezifische klinische Bild einer COVID-19-Erkrankung und wurde labordiagnostisch nachgewiesen,
- Labordiagnostisch nachgewiesene Infektion bei nicht erfülltem klinischen Bild: wurde labordiagnostisch nachgewiesen und das klinische Bild ist bekannt, entspricht aber nicht dem spezifischen oder unspezifischen klinischen Bild einer COVID-19-Erkrankung, z. B. asymptomatische Infektionen,
- Labordiagnostisch nachgewiesene Infektion bei unbekanntem oder nicht erfülltem klinischen Bild: wurde labordiagnostisch nachgewiesen, das klinische Bild wurde jedoch nicht erfasst, war nicht zu ermitteln oder es zeigten sich keine Symptome.
Fälle der Kategorie 1 sind begründete Verdachtsfälle, Fälle der Kategorien 2 bis 4 sind laborbestätigte COVID-19-Fälle und werden vom Robert Koch-Institut gemeinsam als Fallzahlen veröffentlicht,[184] zur Meldepflicht siehe Abschnitt Meldepflicht, ICD-10-Einordnung, Berufskrankheit. Diese Referenzdefinition des RKI entspricht der WHO-Falldefinition.
Definition: »COVID-19-Todesfall«
Zu den COVID-19-Todesfällen werden sowohl Person gezählt, die unmittelbar an einer COVID-19-Erkrankung verstarben, als auch Corona-Infizierte mit Vorerkrankungen, bei denen sich die genaue Todesursache nicht abschließend nachweisen lässt.[194]
Virus- und Antikörpernachweis
RT-PCR-Test
Die Nachweismethode ist die real-time quantitative Reverse-Transkriptase-Polymerase-Kettenreaktion, abgekürzt auch als qRT-PCR, RT-qPCR oder nur als PCR-Test bezeichnet. Sie basiert auf der Detektion von zwei Nukleotidsequenzen, bezeichnet als E Gen und RdRp Gen. Ein positiver PCR-Test ist nicht gleichbedeutend mit Infektiosität: Der PCR-Test ist bei der empfohlenen Abstrich-Technik stets, in einigen Fällen mehrere Wochen, länger positiv als vermehrungsfähige Viren nachweisbar sind.[195][196][197] Ein unter anderem in diesem Fall hoher Ct-Wert (> 30) deutet auf eine geringe Viruslast und somit geringe Ansteckungsfähigkeit hin, die ein Argument für die Entlassung aus einer Quarantäne sein kann.[198] Beachtet werden muss jedoch auch, dass zu Beginn der Infektion die Viruslast ebenfalls gering und der Ct-Wert hoch ist, sodass der Patient in wenigen Tagen hochansteckend werden kann.[199]
Die Wahrscheinlichkeit, mit Hilfe des RT-PCR-Tests einen Kranken auch korrekt als infiziert zu erkennen, hängt maßgeblich von der Entnahmeart des Materials ab (zum Unterschied zwischen „infiziert“ und „Infektion“ siehe dort). Der wegen seiner einfachen Durchführbarkeit meist praktizierte nasale Abstrich zeigte in einer kleinen chinesischen Studie bei 205 Patienten eine Sensitivität von 63 %. Der Nachweis aus der bronchoalveolären Spülflüssigkeit (bronchoalveoläre Lavage, BAL) erkannte das Virus in 93 % der Krankheitsfälle. Ebenso konnte bei wenigen Patienten auch ein Nachweis im Blut als Zeichen einer systemischen Infektion, einer Infektion bei der sich die Krankheitserreger durch Einschwemmung per Blutbahn über ein gesamtes Organsystem oder den ganzen Organismus ausbreiten, erbracht werden.[200]
Eine chinesische Studie an 1014 Patienten mit Lungenerkrankung während des Ausbruchs der Epidemie in Wuhan zeigte, dass positive (mit COVID-19 vereinbare) Computertomogramme (CTs) bei rund 88 % der Patienten nachgewiesen wurden und lediglich 59 % mittels PCR-Test. Bei den 413 mit RT-PCR negativ getesteten Personen wiesen sodann 75 % positive CT-Ergebnisse auf. Studienergebnis war, dass CTs als primäres Werkzeug zum sicheren Nachweis von COVID-19 taugen und eine höhere Diagnose-Sensitivität dafür aufweisen als ein RT-PCR-Test.[201]
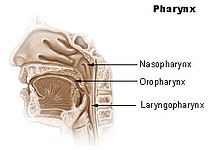
Es ist daher wichtig, bei Proben der oberen Atemwege einen Abstrich des Nasenrachens (Nasopharynx) oder des Mundrachens Oropharynx (siehe Abbildung) zu nehmen. Nach Möglichkeit sollte dies durch eine Probe der unteren Atemwege (bronchoalveoläre Lavage, Sputum, Trachealsekret) ergänzt werden.[188][202] Der mit Rachenabstrichen vorgenommene PCR-Test ist nur in der ersten Woche zuverlässig. Anschließend kann das Virus im Rachen verschwinden, während es sich in der Lunge weiter vermehrt (entgegen der landläufigen Meinung „wandert“ das Virus nicht in die Lunge, sondern wird mit jedem Atemzug mit den inhalierten erregerbehafteten Tröpfchen in den gesamten Atemtrakt befördert, wo selbige an jeder Schleimhaut haften bleiben können, das Virus oder Bruchstücke davon sind bloß im Rachen nicht mehr nachweisbar, weil der lymphatische Rachenring als Teil des lymphatischen Systems seiner Aufgabe als Abwehrbarriere der oberen Atemwege nachgekommen ist). Bei Infizierten, die in der zweiten Krankheitswoche getestet werden, ist der PCR-Test anhand des Rachenabstrichs nicht zuverlässig positiv respektive auf den Gesamtstatus bezogen nicht zuverlässig negativ. Hilfsweise kann dann Probenmaterial per Absaugkatheter aus den tiefen Atemwegen entnommen oder ausgehustetes Material (Sputum) herangezogen werden.[203] Neben Fehlern bei der Probenahme können falsch-negative Ergebnisse durch eine zu geringe Viruslast im Probenmaterial, das Testkit oder bei dessen Verwendung auftreten.[191] Die Sensitivität der Abstrichuntersuchung ist dabei abhängig vom Zeitpunkt nach der Exposition mit dem Erreger. Am Tag des Symptombeginns testen rund 40 % der Patienten. Am achten Tag nach Exposition zeigte sich die beste Sensitivität mit rund 80 %.[204]
Antikörpertest und weitere Nachweismethoden

Das Virus kann auch durch eine Genomanalyse (RNA-Sequenzierung des Genoms) identifiziert werden.[188] Die NAAT-Methode (Nucleic Acid Amplification Technology) beruht ebenfalls auf der RT-PCR; das fertig zusammengestellte Assay ist jedoch einfacher in der Handhabung und lässt sich von entsprechend ausgestatteten Routine-Laboratorien verwenden.[188] Seit Februar 2020 gibt es ein derartiges Assay (Testkit) mit der Bezeichnung Centers for Disease Control and Prevention (CDC) 2019-Novel Coronavirus (2019-nCoV) Real-Time Reverse Transcriptase (RT)-PCR Diagnostic Panel.[205]
Der Antikörpernachweis als serologische Untersuchung wurde nach Angabe der WHO seit Mitte Januar 2020 entwickelt. In einer bisher nur als Preprint im April 2020 veröffentlichten Studie wurden drei kommerzielle ELISA-Tests und sechs kommerzielle Lateral-Flow-Tests evaluiert. Für die drei ELISA-Tests wurde die diagnostische Sensitivität (Richtig-positiv-Rate) zwischen 67 % und 93 % ermittelt, die Spezifität (Richtig-negativ-Rate) lag zwischen 93 % und 100 %. Falsch positive Ergebnisse gab es durch Kreuzreaktivität mit Serumproben, die Antikörper gegen andere Coronaviren (z. B. Humanes Coronavirus HKU1) sowie weitere Viren enthielten.[206] Weitere Details sind im Abschnitt Antikörpernachweis im Artikel zum Virus beschrieben.
Antigen-Schnelltests
Seit Herbst 2020 sind Antigen-Schnelltests verfügbar, die auf Eiweiße des SARS-CoV-2 reagieren. Sie werden in der Regel wie PCR-Tests aus in Nasen-Rachen-Abstrichen gewonnenem Material durchgeführt. Die Sensitivität dieser Tests ist geringer als die von PCR-Tests, die als Referenzmethode gelten.[207] Ihr Vorteil liegt in der geringeren Zeit des Testablaufs von 15 bis 30 Minuten, zudem können einige der Tests vor Ort durchgeführt werden.[208] Eine im November vorveröffentlichte Studie verglich sieben Antigen-Tests mit PCR-Tests und beschrieb, dass die Sensitivität der Tests sich mit Viruskonzentrationen deckte, wie sie typischerweise in der ersten Woche mit Symptomen beobachtet würde, die bei den meisten Patienten der Zeit der Infektiosität entspräche.[208] Laut Robert Koch-Institut bedarf ein positives Testergebnis zur Vermeidung falsch-positiver Befunde einer Nachtestung mittels PCR.[207] Ein negatives Ergebnis im Antigentest schließt eine Infektion nicht aus, insbesondere, wenn eine niedrige Viruslast vorliegt, wie z. B. in der frühen Inkubationsphase oder ab der zweiten Woche nach Symptom beginn bzw. in der späten Phase der Infektion.[207]
Als Alternative werden die gegenüber Antigen-Schnelltests erheblich sensitiveren und bei der Probenentnahme zudem mit einem geringeren Expositionssrisiko verbundenen PCR-Pooltests diskutiert. Hierbei werden die Probentupfer 30 Sekunden gelutscht (ugs.: Lolli-Test). Anschließend werden die Tupfer z. B. aller Schüler einer Schulklasse in einem einzigen Probenbehälter zusammengeführt (Pool) und dann kollektiv einem PCR-Test unterzogen (PCR-Pooltest). Im Falle eines positiven Ergebnisses werden dann alle Schüler der betroffene Klassen einzeln mittels PCR getestet, um so die infizierten Schüler zu ermitteln.[209]
Bildgebende Verfahren


Ob ein Mensch mit dem Virus infiziert ist, lässt sich durch die Bildgebung nicht feststellen. Jedoch lassen sich bei Patienten, deren Krankheit so schwer ist, dass sie eine Lungenentzündung hervorruft, diese bildgebend nachweisen. In der Bildgebung zeigen sich im CT milchglasartige Verdickungen, wie sie auch bei anderen viralen Lungenentzündungen vorkommen.[210][211] Diese Veränderungen lassen sich aufgrund ihrer oft pleuranahen Lage auch sonographisch darstellen.[212]
Einige Wissenschaftler vertreten die Ansicht, die Diagnostik COVID-19-typischer Lungenschäden mittels Bildgebung sei der Diagnostik per RT-PCR überlegen, da die CT-Bildgebung schneller erfolgen kann und die Veränderungen zuverlässiger entdeckt werden als durch den fehleranfälligeren Abstrichtest.[191] Radiologen aus Changsha berichteten aus einer Fallserie von 167 Patienten über fünf Patienten, bei denen zum Zeitpunkt einer durch Computertomographie gesicherten Lungenentzündung die RT-PCR für das Virus negativ ausfiel und der Virusnachweis erst nach mehrmaligen Tests im Verlauf der Erkrankung gelang.[213] In Zeiten einer Epidemie kann es als Triage-Strategie bei einem gehäuften Auftreten der Patienten sinnvoll sein, Verdachtsfälle mit typischer Bildgebung auch bei negativer RT-PCR wie COVID-19-Fälle zu behandeln, um die Einleitung einer Therapie nicht zu verzögern.[211]
Behandlungsmöglichkeiten
Das Nukleosidanalogon Remdesivir zeigte in einer vorläufig veröffentlichten, randomisierten Studie eine Verkürzung der Krankheitsdauer bei hospitalisierten Patienten.[214] Das Medikament ist in der EU für COVID-19-Patienten, die Sauerstoff benötigen, zugelassen[215] und kann laut Leitlinie der DIVI bei schwer kranken Patienten erwogen werden.[216] Da sich der Nutzen des Medikaments in weiteren Studien nicht bestätigen ließ wird Remdesivir laut aktueller Leitlinie der ERS nicht empfohlen.[217]
Mitte Juli 2020 veröffentlichte die britische Studiengruppe RECOVERY[218] vorläufige Studiendaten, denen zufolge Dexamethason die Sterberate bei Patienten an Beatmungsgeräten von 41 % auf 29 %, für Patienten mit Sauerstoffversorgung von 26 % auf 23 % reduziert. Bei Patienten, die keine Sauerstoffgabe benötigten, zeigte eine Behandlung mit Dexamethason keine positive Wirkung.[219] Dexamethason bremst die überschießende Reaktion des Immunsystems, den Zytokinsturm.[220] Der Einsatz wird laut DIVI-Leitlinie bei beatmeten Intensivpatienten mit einer Progression der Erkrankung sowie bei Sauerstoffsättigungen unterhalb 92 % von der DGP empfohlen.[216][221]
Aufgrund des erhöhten Thrombose- und Lungenembolierisikos bei COVID-Patienten[222] wird eine Antikoagulation mittels niedermolekularem oder unfraktioniertem Heparin bei akut erkrankten COVID-Patienten über den gesamten Krankheitsverlauf empfohlen. Eine Dosissteigerung wird bei Vorhandensein von Risikofaktoren für ein thrombotisches Ereignis empfohlen. Eine Blutgerinnungshemmung in voller therapeutischer Dosis kann bei allen beatmeten Intensivpatienten mit COVID-19 nach einer individuellen Risikobewertung erwogen werden.[223]
Chloroquin und Hydroxychloroquin zeigten zunächst erfolgversprechende Ergebnisse bei In-vitro-Studien in Zellkultur.[224] Die weitere Untersuchung von Hydroxychloroquin wurde in der SOLIDARITY-Studie gestoppt, da sich keine Hinweise auf eine Wirksamkeit zeigten.[225] Die US-Arzneimittelbehörde FDA zog ihre notfallmäßige Zulassung des Medikaments für COVID-19 im Juni 2020 zurück.[226] Im Tiermodell zeigte sich mit verschiedenen Behandlungszeitpunkten kein Einfluss auf die Viruslast, die Zeitdauer bis zur Entfernung des Virus aus dem Organismus oder ein schützender Effekt gegen die Infektion.[227] An Lungenepithelzellen in Kultur konnte keine Wirkung nachgewiesen werden. Auch an Verozellen denen TMPRSS2 gentechnisch eingebaut wurde konnte keine Verhinderung der Infektion nachgewiesen werden.[228] In zwei vergleichenden Studien mit insgesamt mehr als 5000 hospitalisierten Teilnehmern wurde in mit Hydroxychloroquin behandelten Gruppen eine etwas höhere Sterblichkeit als in Kontrollgruppen beobachtet.[229][230][231] Das RKI rät vom Einsatz von Chloroquin und Hydroxychloroquin außerhalb von klinischen Studien explizit ab.[223]
Tocilizumab, ein monoklonaler Antikörper, der unter anderem zur Behandlung verschiedener Formen von rheumatoider Arthritis und dem Zytokin-Freisetzungssyndrom[232] zugelassen ist wurde auf seine Wirksamkeit bezüglich COVID-19 untersucht. Dabei zeigte sich kein Einfluss auf die Sterblichkeit oder den klinischen Zustand. Jedoch zeigten sich Hinweise auf eine Reduktion des Risikos einer Beatmungspflichtigkeit. Aufgrund der Datenlage empfiehlt das RKI den Einsatz möglichst nur im Rahmen klinischer Studien. Eine Off-Label-Use in der hyperinflammatorischen Phase der Erkrankung ist möglich.[223] Die ERS empfiehlt den Einsatz von Tocilizumab und anderen Medikamenten dieser Substanzklasse bei Patienten deren Atmung durch Sauerstoffgabe oder eine Beatmung unterstützt werden muss.[217]
Im November 2020 erhielt der monoklonale Antikörper Bamlanivimab (Lilly) in den USA die Notfallzulassung für die Behandlung eines leichten bis mittelschweren Erkrankungsverlaufs, wenn aufgrund von Vorerkrankungen oder des Alters ein hohes Risiko für einen schweren Verlauf vorliegt.[233] Die Leitlinie der DIVI trifft die Aussage dass der Einsatz bei früh hospitalisierten Patienten ohne Atemwegssymptome mit mindestens einem Risikofaktor für einen schweren Verlauf erfolgen könne. Für Patienten mit einem fortgeschrittenen Verlauf bestehe kein Nachweis eines Nutzens.[234]
Antikörperreiches Plasma genesener Patienten scheint geeignet, Akutfälle zu therapieren, kann aber einen Erfolg nur in der Frühphase der Erkrankung belegen.[235] Bisher gibt es keine Zulassung für den Einsatz von Rekonvaleszentenplasma. Es gibt jedoch Hinweise auf einen möglichen günstigen klinischen Effekt und eine geringere Sterblichkeit bei Patienten mit schwerer Erkrankung. Ebenso wird eine frühere Viruselimination erreicht. Das RKI empfiehlt den Einsatz von Rekonvaleszentenplasma im Rahmen von kontrollierten klinischen Studien oder individuellen Heilversuchen.[223] Nach Leitlinie der DIVI soll Rekonvaleszentenplasma bei Krankenhauspatienten nicht eingesetzt werden. Ob eingige Patientengruppen davon profitieren könnten sei aufgrund der Datenlage unklar.[236]
Bei Patienten, die aufgrund der Viruspneumonie ein akutes Lungenversagen entwickeln, gelten die üblichen Prinzipien der Beatmungstherapie bei Viruspneumonie. Dabei kann die Sicherstellung des Gasaustausches durch eine non-invasive Beatmung oder durch eine invasive Beatmung nach Intubation erfolgen. Es wird eine konservative Volumentherapie empfohlen, um eine Überwässerung des Patienten und die Gefahr eines zusätzlichen Lungenödems zu vermeiden. Im Rahmen des erweiterten hämodynamischen Monitorings sollte der Blutfluss kontinuierlich überwacht sowie nach Möglichkeit das extravaskuläre Lungenwasser bestimmt werden.[216] Eine non-invasive Beatmung über hochvolumigen Sauerstoff birgt die Gefahr einer Aerosolierung des Virus und damit eine erhöhte Ansteckungsgefahr für das am Patienten arbeitende Personal.[237]
Casirivimab/Imdevimab (REGN-COV2) ist ein Testmedikament, das vom amerikanischen Biotechnologieunternehmen Regeneron Pharmaceuticals entwickelt wurde. Es ist ein künstlicher Antikörper-Cocktail, der entwickelt wurde, um eine Resistenz gegen das SARS-CoV-2-Coronavirus zu erzeugen. Es besteht aus einer Mischung zweier monoklonaler Antikörper, Casirivimab (REGN10933) und Imdevimab (REGN10987).[238] Aktuell ist das Medikament in Europa noch nicht zugelassen. Belegt sind eine Senkung der Viruslast und ein positiver Einfluss auf den Krankheitsverlauf. Das RKI empfiehlt die Gabe im Rahmen kontrollierter klinischer Studien oder als individuellen Heilversuch in der Frühphase der Erkrankung oder auch als mögliche Prophylaxe nach Exposition gegenüber SARS-CoV-2.[223] Der Ausschuss für Humanarzneimittel (Human Medicine Committee, CHMP) der Europäischen Arzneimittel-Agentur (EMA) hat am 26. Februar 2021 seine Überprüfung der Verwendung der Kombinationstherapie mit den monoklonalen Antikörpern Casirivimab und Imdevimab zur Behandlung von Patienten mit COVID-19 abgeschlossen. Die EMA kam zu dem Schluss, dass die Kombination zur Behandlung von bestätigtem COVID-19 bei Patienten verwendet werden kann, die keine zusätzliche Sauerstoffzufuhr benötigen und ein hohes Risiko haben, eine schwere Form der COVID-19-Erkrankung zu erleiden. Parallel dazu läuft seit 1. Februar 2021 ein Rolling-Review-Verfahren dieser Kombination.[239]
Ob Vitamin D zur Behandlung einer akuten COVID-19-Erkrankung geeignet ist, wird noch erforscht (Stand: Februar 2021). Nach Einschätzung von Gesundheitsbehörden z. B. in USA, England und Deutschland gibt es hierfür aktuell keine ausreichende Evidenz.[240][241][223]
Stand 8. Januar 2021 sind 319 Medikamente in der Erforschung zur Therapie von COVID-19, davon befinden sich 35 in klinischen Studien.[242]
EXO-CD24 ist ein experimentelles Inhalationsmedikament für die Behandlung der schweren Atemwegserkrankung COVID-19, das vom israelischen Krebsspezialisten Nadir Arber gemeinsam mit dem Sourasky-Medizinzentrum in Tel Aviv entwickelt wurde. In der Entwicklung gegen COVÌD-19 befindet sich EXO-CD 24 seit September 2020 und befindet sich derzeit in einer Phase-1-Studie.[243]
VIR-7831 (vorgeschlagener internationaler Freiname: Sotrovimab) ist ein von VIR Biotechnology und GlaxoSmithKline in der Entwicklung befindliches Arzneimittel zur ambulanten Behandlung von COVID-19. Es handelt sich um einen gegen SARS-CoV-2 gerichteten monoklonalen Antikörper. Am 10. März 2021 wurde empfohlen, dass die Phase-3-Comet-Ice-Studie von VIR-7831 aus ethischen Gründen abgebrochen wird, da durch die bisher nachgewiesene hohe Wirksamkeit des Medikaments als Monotherapeutikum für die frühzeitige Behandlung von COVID-19 von Erwachsenen mit hohem Risiko einer stationären Behandlung, eine Notfall-Zulassung bei der Food and Drug Administration (FDA) und weiteren internationalen Behörden beantragt werden sollte.[244]
Die frühzeitige inhalatorische Gabe puderförmigem Budesonid mit 800 μg pro Gabe zweimal täglich konnte in einem Patientenkollektiv von 146 Probanden in einer RCT in UK einen um einen Tag verkürzten Krankenhausaufenthalt bewirken.[245] Über die Verringerung der Ausbildung schwerer Erkrankungsformen, die eine Notaufnahme erforderlich machen, bestehen hinsichtlich der Kriterien für die Kontrollgruppe allerdings Bedenken. Budesonid ist ebenfalls Bestandteil der PRINCIPLE-Phase III Studie, in der mit untersucht wurde, ob die frühe Gabe bei Patienten mit Risiko die Zahl anschließender Krankenhauseinweisungen minimierte. Die Hospitalisierungsrate in der Budesonid-Gruppe lag mit 8,5 % (59/692) gegenüber der Vergleichsgruppe (Standard-Therapie) bei 10,3 % (100/968) hoch, wie einer Vorabveröffentlichung entnehmbar ist.[246] Da in Großbritannien die COVID-Fallzahlen sowie die Krankenhauszuweisungen ohnehin weiter rückläufig seien, könne laut einer Presseerklärung nicht klar belegt werde, ob Budesonid die Hospitalisierungrate reduziere. Im Median konnte bei Risikopatienten jedoch eine 3 tägige Verkürzung der Genesungszeit ermittelt werden.[247] Eine ähnlich dämpfende Einschätzung gaben mehrere Fachgesellschaften in einer gemeinsamen Stellungnahme über die DGP heraus.[248]
Die European Respiratory Society veröffentlichte im März 2021 im European Respiratory Journal eine Leitlinie für die stationäre Behandlung von COVID-19-erkrankten Erwachsenen.[249]
Molnupiravir ist ein experimentelles antivirales Medikament, das oral verabreicht wird und zur Behandlung der Influenza entwickelt wurde. Das Arzneimittel wurde an der Emory University in Atlanta, Georgia entwickelt. Die Pharmaunternehmen Merck & Co. (MSD) und Ridgeback Biotherapeutics veröffentlichten Fortschritte im klinischen Entwicklungsprogramm von Molnupiravir, wonach das Arzneimittel therapeutisch für die Behandlung von ambulanten milden bis mäßigen Verläufen von COVID-19 eingesetzt werden kann. Molnupiravir ist ein Prodrug, resultiert aus dem synthetischen Nukleosid-Derivat N4-Hydroxycytidin und übt seine antivirale Wirkung durch Einführung von Kopierfehlern während der viralen RNA-Replikation durch virale RNA-Polymerase aus.[250]
Heilungsaussicht
Abschätzung des Sterberisikos
Es gibt verschiedene Kennzahlen, um das Sterberisiko der Erkrankung zu beschreiben:
- Der Infizierten-Verstorbenen-Anteil (IFR) beschreibt den Anteil der an der Erkrankung Verstorbenen an der Gesamtzahl aller Infizierter. Diesem Anteil kann man sich durch Schätzungen nähern.[251] Je nach Land oder Region variieren die Schätzungen des Infizierten-Verstorbenen-Anteils in Abhängigkeit verschiedener landesspezifischer Parameter, wie z. B. der Leistungsfähigkeit des Gesundheitssystems, der Altersstruktur der Bevölkerung oder sich unterscheidender Stichprobenentnahmeverfahren.[252]
- Der Fall-Verstorbenen-Anteil (CFR) bezieht sich auf die Zahl verstorbener gemeldeter Fälle durch die Zahl der insgesamt gemeldeten Fälle. Dadurch ist diese Zahl stark von der Effizienz des Diagnostik- und Meldesystems abhängig und kann die tatsächliche Letalität sowohl über- als auch unterschätzen.[11]
- Der symptomatische Fall-Verstorbenen-Anteil (sCFR) ist der Anteil infizierter Personen, die Symptome zeigen und die im Verlauf ihrer Infektion versterben. Dieser Anteil ist klinisch relevant für die Beurteilung der Prognose der Anforderungen an das Gesundheitswesen.[251] Laut dem Robert Koch-Institut ist zu der tatsächlichen Zahl der Erkrankten keine gesicherte Aussage möglich.[11] Es existieren verschiedene Möglichkeiten zur Schätzung dieses Anteils.

Eine Studie, die anhand der Daten des Diamond-Princess-Ausbruchs den Infizierten-Verstorbenen-Anteil in China abschätzte, kam zu dem Ergebnis, dieser habe 0,6 % betragen (95 %-Konfidenzintervall: 0,2–1,4 %).[255] In einer Modellierungsstudie aus Frankreich, die sich auf den Ausbruch auf der Diamond Princess und Daten französischer Krankenhäuser bezieht, zeigte sich ein Infizierten-Verstorbenen-Anteil bezogen auf die ganze Bevölkerung von 0,53 %. Dabei zeigte sich der höchste Infizierten-Verstorbenen-Anteil bei Menschen über 80 Jahren mit 8,3 %, in der Altersgruppe unter 20 von 0,001 %. Das mittlere Alter der Verstorbenen war 79 Jahre und rund 80 % der Verstorbenen waren über 70 Jahre alt.[256] Eine Studie, welche in Teilen Louisianas den Infizierten-Verstorbenen-Anteil mittels Antikörpertests und den vorhandenen Daten zur Übersterblichkeit zu ermitteln suchte, kam auf 1,63 %.[257] In Island schätzte eine Studie aufgrund von Antikörperbestimmungen einen Infizierten-Verstorbenen-Anteil von 0,3 % bezogen auf die Gesamtbevölkerung. In der Altersgruppe unter 70 Jahren war dieser 0,1 %. In der Altersgruppe über 70 Jahre 4,4 %.[258]
Eine systematische Übersichtsarbeit und Metaanalyse unter Einbezug von 111 Studien aus Industriestaaten (OECD-Mitglieder) schätzt den Infizierten-Verstorbenen-Anteil über verschiedene Bevölkerungen hinweg auf 0,68 % (95 %-Konfidenzintervall [0,53–0,82 %]). Dieser könne nach Alter und zugrundeliegenden Vorerkrankungen in der Population deutlich schwanken; ebenso könne das Sterberisiko durch Nichtmeldung von Todesfällen unterschätzt werden[259] Laut einer zusammenfassenden Betrachtung verschiedener Studien steigt der geschätzte Infizierten-Verstorbenen-Anteil von 0,004 % (0 bis 34 Jahre) auf 0,06 % (bis 44 Jahre), 0,2 % (bis 54), 0,7 % (bis 64), 2,3 % (bis 74) auf 7,6 % (bis 84) bzw. 22,3 % (85 und älter).[260]
Eine Schätzung des ECDC ging Ende April 2020 für ganz Europa von einem Fall-Verstorbenen-Anteil von 10,5 % aus.[261] In Deutschland wird der Fall-Verstorbenen-Anteil aktuell vom RKI nicht veröffentlicht, kann aber, aus den Daten des RKI zu 2,18 % berechnet werden (Stand 13. Januar 2021).[262]
Eine am 19. März 2020 veröffentlichte Studie chinesischer und US-amerikanischer Forscher unter Verwendung der Fallzahlen vom 29. Februar 2020 in Wuhan kam zu der Schätzung, dass der symptomatische CFR (die Wahrscheinlichkeit zu sterben, nachdem Symptome entwickelt wurden) dort 1,4 % betragen habe (95 %-KI: 0,9–2,1 %). Die Autoren betonen jedoch, dass sich Annahmen und Daten des Modells unmittelbar auf Wuhan beziehen, weshalb eine Generalisierung auf die Situation in anderen Ländern nicht möglich ist.[263]
Studien zufolge hat die Virusvariante B.1.1.7 eine höhere Sterblichkeit als die ursprünglichen Form des SARS-CoV-2-Virus (siehe hierzu: VOC-202012/01#Höhere Sterblichkeit).
Forschungsstand zu Spätfolgen
Aus den radiologischen Befunden eines Fallberichts haben taiwanische Ärzte geschlossen, dass wie bei SARS Spätfolgen an der Lunge im Sinne von fibrotischen Veränderungen möglich sind.[28][29] Aufgrund eines Falles von durch SARS-CoV-2 ausgelöster viraler Encephalitis und der Erfahrungen mit anderen Coronaviren stellen Forscher aus Peking die Möglichkeit einer Langzeitpersistenz des Virus in Nervenzellen in den Raum, welche zu neurologischen Folgeerkrankungen führen könnte.[30] Ein Review über COVID-19 und die Beteiligung am Herzen von US-amerikanischen Ärzten zieht die Möglichkeit von herzbedingten Spätfolgen in Betracht und beruft sich dabei auf die Erfahrungen mit SARS sowie einen italienischen Fallbericht einer tödlich verlaufenden Herzmuskelentzündung nach Ausheilung der Erkrankung.[27] In einer Studie an 100 Patienten zeigte eine Mehrheit der Patienten in der Magnetresonanztomografie auch nach symptomatischer Ausheilung von COVID-19 eine messbare Entzündung des Herzmuskels. Wegen der kleinen Untersuchungsgruppe und der Art der Auswahl der Untersuchten ist aber unklar, inwieweit diese Patienten für die Gesamtzahl der Erkrankungen repräsentativ sind.[264]
Eine Studie an 384 aus dem Krankenhaus Entlassenen stellte rund zwei Monate nach der Entlassung eine hohe Rate von Patienten fest, bei denen weiterhin Beschwerden bestanden. Mehr als die Hälfte klagte über Müdigkeit, rund die Hälfte über Atemnot und etwa ein Drittel über fortgesetzten Husten. Bei rund einem Drittel zeigte sich weiterhin ein erhöhter D-Dimer als Zeichen erhöhter Blutgerinnungsaktivität. Bei 38 % zeigten sich weiterhin abnorme Röntgenbefunde, bei 9 % waren diese schlechter als zum Entlasszeitpunkt.[265]
Wie bei anderen Infektionskrankheiten mit Lungenentzündung können längere Genesungszeiten auftreten. Nach einer akuten Erkrankung können Wochen oder Monate danach noch Beschwerden vorhanden sein oder neu auftreten. Neben organspezifischen Langzeitfolgen, die aus der Behandlung einer schweren Erkrankung resultieren, werden längerfristige Müdigkeitserscheinungen, Gedächtnis- und Wortfindungsstörungen, Schwindel und Übelkeit auch bei milderen Verläufen beobachtet. Daten aus England deuten darauf hin, dass rund 40 % der Krankenhauspatienten längerfristig medizinische Hilfe benötigen und rund 10 % der nicht im Krankenhaus Behandelten mehr als vier Wochen Beschwerden haben.[266]
Immunität
Bisher ist unklar, inwieweit eine durchgemachte Infektion eine Immunität verleiht. Jedoch scheinen erste Befunde dafür zu sprechen, dass eine anhaltende zelluläre Immunität die Antikörper bedingte Abwehr deutlich zu verstärken scheint.
Bis dato wird aus Erkenntnissen aus dem Tiermodell davon ausgegangen, dass eine akute Immunität besteht, jedoch ist unklar, wie lange diese andauert. Labortests, welche zuverlässig eine Immunität anzeigen, sind bisher nicht vorhanden.[267]
In einem Tierexperiment an Rhesusaffen konnte eine chinesische Forschergruppe in einer vorläufigen Studie zeigen, dass die Tiere nach einer durchgemachten COVID-19-Pneumonie und erneuter Virusexposition keine messbare Virus-RNA im Rachen aufwiesen oder über den Verdauungstrakt ausschieden. Die Forschergruppe geht aufgrund der Daten davon aus, dass bei durchgemachter COVID-19 keine akute Reinfektion möglich ist.[268][269] Ein vorveröffentlichtes Review stellt fest, dass eine Wiederinfektion bei anderen Coronaviren nach rund einem Jahr durch Re-Expositionsstudien nachgewiesen sei, aber die Möglichkeit eines milderen Krankheitsverlaufs bestehe. Die Autoren gehen davon aus, dass die Ergebnisse wahrscheinlich auf SARS-CoV-2 übertragbar seien, aber nur eine zeitweilige Immunität erreicht werden könne.[270] Die Universität Hongkong hat bei einem Patienten eine Zweitinfektion 142 Tage nach durchstandener erster Episode nachgewiesen. Der Patient hatte nur milde Symptome, allerdings waren CRP und IGg erhöht. Durch Vollsequenzierung beider Virusgenome wurde gezeigt, dass es sich in beiden Fällen um das SARS-CoV-2 Virus handelte, allerdings um unterschiedliche phylogenetische Varianten. Damit ist eine Verschleppung der ersten Infektion sicher ausschließbar.[271] In Nevada wurde eine weitere Reinfektion nach wenigen Monaten mit klinisch schwererem Verlauf mittels Genomsequenzierung bei einem jungen Patienten nachgewiesen.[272]
In einer Studie an 173 Patienten, bei denen in der Akutphase und der Heilungsphase die IgM und IgG-Antikörperbildung untersucht wurde, zeigten 80 % eine IgG-Bildung und fast alle Patienten IgM-Bildung. Die Antikörperkonzentration nahm dabei ebenso mit der Erkrankungsschwere zu.[273] Eine kleine Studie an asymptomatischen Patienten stellte einen schnellen Abfall der Antikörpertiter fest. Dabei zeigten rund 40 % der Patienten keine messbaren Antikörper gegen das N-Protein des Virus acht Wochen nach der Infektion.[274] Eine große Studie an Patienten und Mitarbeiten des Mount Sinai Health Systems stellten bei über neun von zehn Getesteten eine Bildung neutralisierender Antikörper gegen das Spike-Protein des Virus fest. Die Antikörpertiter blieben bei der großen Mehrheit der Untersuchten über den Beobachtungszeitraum von fünf Monaten stabil. Bei den Untersuchten handelte es sich mehrheitlich um nicht-hospitalisierte Erkrankungsfälle. Die Autoren folgerten, dass die Wirkung und Dauer der Antikörperantwort vom Zielantigen abhängig sein könnte. Ein Nachweis, ob die Antikörper vor einer Reinfektion schützen, wurde mit der Studie nicht erbracht. Die Autoren rechnen jedoch damit, dass die Untersuchten über einen gewissen Schutz bezüglich Infektionsrisiko und Krankheitsschwere verfügten.[275] Eine Studie an rund 12.000 Mitarbeitern des Gesundheitswesens in Großbritannien über sechs Monate zeigte bei 1.265 Probanden mit Antikörpern gegen das Spike-Protein nur zwei PCR-bestätigte Infektionen und keine symptomatische Infektion. Von den restlichen über 10.000 Untersuchten hatten 223 einen positiven PCR-Test. Bei 123 davon verlief die Infektion symptomatisch. Die Studienautoren gehen davon aus, dass das Vorhandensein von Antikörpern gegen das Spike-Protein das Risiko einer Infektion und Erkrankung drastisch reduziert.[276]
In einer Studie mit 25 COVID-19-Patienten und 68 Gesunden ohne IgG-Antikörper gegen SARS-CoV-2 fanden sich bei rund vier Fünfteln der COVID-19-Patienten und rund einem Drittel der gesunden Probanden T-Zellen, welche auf das S-Protein von SARS-CoV-2 reagierten.[277] Weitere Studien fanden ebenso reaktive T-Zellen bei rund einem Drittel bis zu vier Fünfteln der gesunder Menschen ohne Vorerkrankung. Die Autoren konnten zeigen, dass diese von zurückliegenden Infektionen durch andere Coronaviren herstammen. Die Autoren stellten die Hypothese auf, dass dies teilweise die unterschiedliche Schwere des Krankheitsbildes bei COVID-19 mit erklären könnte.[278][279]
Eine Untersuchung der T-Zell-Immunität bei asymptomatischen oder milden COVID-Fällen ergab eine robuste T-Zell-gestützte Immunantwort gegenüber dem Virus. Diese konnte auch bei Fehlen einer messbaren Antikörperantwort festgestellt werden.[280] Eine weitere Studie zeigte reaktive T-Zellen gegen das Spikeprotein in 89 % der Genesenen bei 89 % von 136 Untersuchten. Diese wiesen jedoch gegen andere Virusproteine reaktive T-Zellen auf. Bei Patienten ohne COVID-typische Beschwerden während der Infektion zeigte sich eine schwächere T-Zell-Antwort.[281]
Nach einer im Februar 2021 veröffentlichten Studie der Universitätsklinik Münster mit 60 Patienten könnte eine frühere Infektion mit dem saisonalen Coronavirus HCoV-HKU1 und HCoV-OC43 zu einem Teilschutz gegen schwere Verläufe von COVID-19 führen,[282] wobei die Autoren einräumen, dass nur eine statistisch signifikante Assoziation (aber noch keine Kausalität) zwischen dem Verlauf von COVID-19 und den Antikörpern gegen diese saisonalen Coronaviren nachgewiesen wurde. Die Ergebnis konnte in einer im April 2021 veröffentlichten Validierungsstudie mit 300 Patienten in Bezug auf Antikörper gegen das Nukleokapsid-Protein von HCoV-OC43 bestätigt werden.[283][284]
Vorbeugung
Individuelle Hygienemaßnahmen


Das Robert Koch-Institut (RKI) veröffentlichte am 28. Januar 2020 Empfehlungen, wie jeder Einzelne sich und andere vor einer Ansteckung mit dem neuartigen Coronavirus schützen kann:
- Jeder sollte auf eine gründliche Händehygiene achten. In erster Linie erfordert diese regelmäßiges Händewaschen, mindestens 20 Sekunden lang und mit Seife. Die Hände sollten zumindest beim Nach-Hause-Kommen, vor und nach dem Essen, vor und nach Kontakt mit anderen Personen, nach der Toilettenbenutzung und nach dem Niesen oder Husten gewaschen werden.
- Tragen eines Mund-Nasen-Schutzes oder einer Alltagsmaske in der Öffentlichkeit.
- Nach Kontakt mit möglicherweise viral kontaminierten Oberflächen, wie zum Beispiel Griffelementen in öffentlichen Verkehrsmitteln oder von Einkaufswagen in Supermärkten, sollten die Hände mit einem geeigneten Desinfektionsmittel desinfiziert werden.
- Zu anderen Personen sollte, wenn diese nicht zum persönlichen Lebensumfeld gehören (wie Lebenspartner und Verwandte ersten Grades), mindestens 1,5 bis 2 Meter Abstand gehalten werden. Grundsätzlich sind unmittelbare Körperkontakte, wie das Händeschütteln, Küssen oder ähnlich intensive Körperkontakte, sowie größere Menschenmengen zu vermeiden.[285]
- Da beim Sport und allgemein beim Bewegen in der Öffentlichkeit ein Abstand von nur zwei Metern meist nicht ausreichend ist, um eine Ansteckung durch Tröpfcheninfektion zu verhindern, sollte darauf geachtet werden, dass der Abstand zu anderen größer ist; das gilt insbesondere, wenn man sich im Windschatten eines anderen befindet.[286]
- Beim Singen oder Musizieren mit Blasinstrumenten soll ein Mindestabstand von drei Metern eingehalten werden.
- Das Husten oder Niesen sollte möglichst in die Armbeuge erfolgen, keinesfalls in die Hand.
- Geschlossene Räume sind bei Anwesenheit von mehreren Personen alle 20 Minuten mittels fünfminutigem Stoßlüften zu lüften.[8] Lüftungsgeräte mit einem HEPA-Filter H14 (Abscheidegrad > 99,995 Prozent) werden empfohlen.
Die Raumluftqualität kann hierbei auch mit Hilfe von Kohlenstoffdioxidmessungen überwacht werden. Der durch die ausgeatmete Luft angereicherte mittlere Gehalt an Kohlenstoffdioxid soll im Mittel nicht höher als 1000 parts per million liegen[287] und kann beispielsweise mit Hilfe von CO2-Ampeln ermittelt und angezeigt werden.
Die Weltgesundheitsorganisation (WHO) empfiehlt zusätzlich:[288]
- Augen, Nase oder Mund nicht mit ungewaschenen Händen zu berühren;
- zuhause zu bleiben, wenn man selbst oder ein Mitbewohner sich krank fühlt – auch bei milden Symptomen (wie z. B. leicht laufender Nase oder Kopfschmerzen);
- bei Krankheitssymptomen keinesfalls persönlich eine Praxis oder ein Krankenhaus aufzusuchen, sondern vorher dort anzurufen, um weiteren Anweisungen zu folgen.[289]
Bei Symptomen oder Beschwerden, die auf eine Infektion mit dem Coronavirus hinweisen könnten, sollte zunächst der Hausarzt angerufen werden; außerhalb der Öffnungszeiten der Hausarztpraxis kann in Deutschland der ärztliche Bereitschaftsdienst angerufen werden: »Rufnummer: 116 117«. Außerdem sollte man sich zuhause isolieren, um nicht weitere Menschen anzustecken.[290][291][292] Bei akuten Notfällen soll der Notruf: »Rufnummer: 112« angerufen werden. Das deutsche Bundesgesundheitsministerium warnt, dass niemand aus Angst vor einer Infektion mit SARS-CoV-2 („Coronavirus“) bei schwerwiegenden Krankheitssymptomen auf ärztliche Behandlung verzichten soll: „In den letzten Wochen haben wir beobachtet, dass sich deutlich weniger Patientinnen und Patienten z. B. mit einem akuten Herzinfarkt vorstellen. Dabei zählt gerade beim Infarkt jede Minute. Die Wahrscheinlichkeit, an einem Herzinfarkt zu sterben ist hoch, wenn man sich nicht rechtzeitig meldet. Die Wahrscheinlichkeit, sich [beim Arzt oder im Krankenhaus] mit dem Coronavirus zu infizieren, ist gering.“[293]
Die Bundeszentrale für gesundheitliche Aufklärung empfiehlt, sich beim Husten, Niesen oder Naseputzen sofort von anderen Menschen abzuwenden und möglichst in ein Taschentuch zu niesen/husten, das danach sofort entsorgt werden muss, sowie sich anschließend gründlich die Hände zu waschen.[294]
Im Verlauf des Jahres 2020 wurden mehrere Corona-Apps entwickelt, die dazu dienen, Infektionsketten nachzuvollziehen. In Deutschland ist dies die Corona-Warn-App, deren Gebrauch vom RKI dringend empfohlen wird.
Christian Drosten hat empfohlen, insbesondere in den Tagen vor einem Familientreffen mit älteren Menschen soziale Kontakte weitgehend zu verringern, indem man zum Beispiel Besprechungen vermeidet oder im Home-Office arbeitet („Vorquarantäne“).[295]
Angesichts einer sich anbahnenden 3. Welle in Deutschland gab das RKI am 31. März 2021 aktualisierte Empfehlungen für den Alltag heraus. In Form von acht „Tipps“ wurde betont:[296]
- das Social Distancing auch beim Besuch von Freunden einhalten;
- besser im Freien statt in Innenräumen treffen;
- im Fall eines Treffens in Innenräumen Abstand halten, Maske tragen und regelmäßig lüften: alle 20 Minuten die Fenster für 5 Minuten weit öffnen;
- von Freizeitreisen absehen;
- bei Symptomen zuhause bleiben und ärztlichen Rat einholen;
- bei positivem PCR-, Schnell- oder Selbsttest allen kürzlich getroffenen Personen Bescheid geben; außerdem einen positiven Schnell- oder Selbsttest mit einem PCR-Test überprüfen lassen;
- auch bei negativem Schnell- oder Selbsttest die AHA+L-Regeln (Abstand, Hygiene, im Alltag Maske tragen, Lüften) einhalten;
- eine angebotene Impfung annehmen.
WHO-Studie, Juni 2020
Mit einer Studie, die durch die WHO in Auftrag gegeben wurde, wurde systematisch der optimale Einsatz der genannten Schutzmaßnahmen untersucht. Ein internationales Forscherteam hat erstmals untersucht, wie sich körperliche Distanz, Gesichtsmasken und Augenschutz auf die Verbreitung von COVID-19 auswirken. Die Recherche ergab 172 Beobachtungsstudien in 16 Ländern und sechs Kontinenten ohne randomisierte kontrollierte Studien und 44 relevante Vergleichsstudien im Gesundheitswesen und außerhalb des Gesundheitswesens (n = 25.697 Patienten). Die Übertragung von Viren war bei einer physischen Entfernung von 1 m oder mehr geringer als bei einer Entfernung von weniger als 1 m. Der Schutz erhöhte sich, wenn die Entfernung vergrößert wurde. Die Verwendung von Gesichtsmasken kann zu einer starken Verringerung des Infektionsrisikos führen mit stärkeren Assoziationen zu N95 oder ähnlichen Atemschutzmasken (FFP2) im Vergleich zu chirurgischen Einwegmasken oder ähnlichen, beispielsweise wiederverwendbaren Masken. Die Ergebnisse dieser systematischen Überprüfung und Metaanalyse unterstützen eine physische Distanzierung von 1 m oder mehr und liefern quantitative Schätzungen für Modelle und Kontaktverfolgungen, um die politischen Entscheider zu informieren.
So betrug das Infektionsrisiko bei Personen, die mehr als einen Meter von der infizierten Person entfernt stehen, 3 Prozent gegenüber 13 Prozent bei einer Entfernung von einem Meter. Mit jedem weiteren Meter Distanz (bis 3 Meter Abstand) wurde das Risiko noch einmal halbiert. Eine körperliche Distanz von mehr als 1 Meter sowohl im Gesundheitswesen als auch in der Gesellschaft reduziert das Ansteckungsrisiko um 82 Prozent. Mit Augenschutz betrug das Infektions- oder Übertragungsrisiko 6 Prozent gegenüber 16 Prozent ohne Augenschutz. Für den Augenschutz ermittelten die Forscher insgesamt eine Schutzwirkung von 78 Prozent. Ein Mund-Nasen-Schutz senkt das Infektionsrisiko laut der Studie um 85 Prozent. Teilchen filtrierende Masken wie N95 (etwa „gauze masks“ oder wiederverwendbare Masken mit 12 bis 16 Lagen Baumwollstoff) könnten Beschäftigten in Gesundheitseinrichtungen möglicherweise einen besseren Schutz bieten als OP-Masken. Baumwollstoffmasken seien dabei auch für die Bevölkerung geeignet. Diese erreichten in einer Unteranalyse eine Schutzwirkung von 96 Prozent. Keine dieser Interventionen biete jedoch, selbst wenn sie richtig eingesetzt und kombiniert werden, einen vollständigen Schutz vor einer Infektion.[297]
Flächenreinigung und Desinfektion

Da die in Seife und Reinigungsmittel üblicherweise enthaltenen Tenside die Fetthülle von Coronaviren zerstören, reichen diese Tenside im Alltag aus, um Hände und andere Oberflächen weitgehend von Krankheitserregern zu befreien.[298][299] Eine routinemäßige Flächendesinfektion in häuslichen und öffentlichen Bereichen wird vom RKI nicht empfohlen; eine im Einzelfall nötige Desinfektion sollte als Wisch- und nicht als Sprühdesinfektion durchgeführt werden, da letztere weniger effektiv sei und das Desinfektionsmittel eingeatmet werden könne. Alkoholbasierte Produkte sollten aus Brandschutzgründen nur auf kleinen Flächen angewendet werden.[298]
Schutzmaske als Mittel zur Prävention
Eine experimentelle Studie von 2008 kommt zu dem Schluss, dass jede Art von Alltagsmaske selbst bei ungenügendem Sitz oder bei improvisiertem Material eine Virusexposition möglicherweise vermindert. Die Autoren schließen daraus, dass das generelle Tragen von Masken durch die Bevölkerung die Übertragung von Atemwegserkrankungen vermindern könne.[300]
In Ostasien gilt die Verwendung von Masken für die Allgemeinbevölkerung als zentrales Element der Prävention. Im März 2020 empfahlen Mediziner aus Hong Kong anderen Ländern, diese Praxis ebenso einzuführen.[301] Die US-amerikanische CDC empfahl unter Berufung auf die aktuelle Studienlage[302] allen Bürgern, in der Öffentlichkeit Mund und Nase zu bedecken.[303][304] Eine Übersicht über den Umgang mit und die Einschätzung von Gesichtsmasken in verschiedenen Ländern hat die Zeitschrift The Lancet erstellt.[305]
Obwohl die Wirksamkeit einer Mund-Nasen-Bedeckung als allgemeine Hygienemaßnahme kaum angezweifelt wird, ist die wissenschaftliche Datenlage mit randomisierten Vergleichsuntersuchungen, die dies statistisch zweifelsfrei für SARS-CoV-2 nachweisen, bisher eher dürftig.[108][306] Eine im April 2020 vorläufig veröffentlichte Metaanalyse einer internationalen Forschergruppe kam zu dem Schluss, dass das Tragen von Mund-Nasen-Masken die Übertragung von Atemwegserkrankungen und die Ausbreitung von Atemwegsinfektionen durch Gesundheitspersonal, aber auch unter der Bevölkerung erheblich reduzieren könne. Die Studienautoren sprachen sich explizit für den Schutz durch Masken aus, um die Übertragung von Atemwegsviren und damit die Ausbreitung von Atemwegserkrankungen zu verhindern oder zumindest zu behindern.[307]
Für die optimale Wirksamkeit ist es wichtig, dass die Mund-Nasen-Bedeckung korrekt sitzt, d. h. enganliegend getragen wird, bei Durchfeuchtung gewechselt wird und dass während des Tragens keine (unbewussten) Manipulationen daran vorgenommen werden.[308] Nach Angaben der WHO kann allerdings das Tragen einer Maske in Situationen, in denen dies nicht empfohlen ist, ein falsches Sicherheitsgefühl erzeugen, durch das zentrale Hygienemaßnahmen wie eine gute Händehygiene vernachlässigt werden können.[309]
Zu unterscheiden ist zwischen dem Schutz des Trägers (Eigenschutz) und dem Schutz der Umgebung (Fremdschutz). Masken mit Ausatemventil schützen den Träger, nicht aber die Umgebung. (Zu diesem Unterschied je nach Maskentyp siehe die Tabelle hier und die Grafik hier.)
Das Bundesinstitut für Arzneimittel und Medizinprodukte weist darauf hin, dass Alltagsmasken (im Gegensatz zu medizinischem Mund-Nasen-Schutz und Atemschutzmasken) nicht normiert sind und daher eine ausreichende Schutzwirkung gegen eine Übertragung von SARS-CoV-2 nicht garantiert werden kann. Dementsprechend könnten sich Träger nicht darauf verlassen, dass sie oder andere durch das Tragen solcher Masken vor einer Übertragung des Erregers geschützt seien, und müssen weiter die Abstandsregeln beachten.[310]
Die Gesellschaft für Virologie hat gemeinsam mit der Deutschen Gesellschaft für Hygiene und Mikrobiologie im November 2020 zusammenfassende Handlungsempfehlungen als S1-Leitlinie zum Thema der Infektionsprävention durch das Tragen von Masken im Zusammenhang mit COVID-19 herausgegeben.[311]
Viruzides Gurgeln und viruzider Nasenspray
Die Deutsche Gesellschaft für Krankenhaushygiene empfiehlt viruzides Gurgeln und viruzides Nasenspray, um bereits „die Viruslast an den Eintrittspforten zu reduzieren, da die Wahrscheinlichkeit einer Infektion mit der Exposition zunimmt und die anfängliche Viruslast Einfluss auf den Schweregrad der Infektion hat“. Studien, welche einen Einfluss auf die Erkrankungshäufigkeit oder den Verlauf belegen, sind jedoch bisher nicht vorhanden.[312]
Infrastrukturelle Minimierung der Tröpfchen- und Aerosolübertragung („source control“)
Besonders in geschlossenen Räumen kann eine Übertragung und Verbreitung virusbehafteter Aerosole durch Aerosol- und Tröpfcheninfektion vermutet werden. Außerdem können durch Klimatisierung bedingte Luftströme zur Verbreitung von Krankheitserregern beitragen. Durch eine raumbezogene Analyse des Tröpfchen- und Aerosoltransports können geeigneten infrastrukturelle Maßnahmen geplant und umgesetzt werden, um die Exposition nichtinfizierter Menschen in Innenräumen zu minimieren.[313]
Abfallentsorgung
Wenngleich bisher keine Fälle bekannt sind, bei denen sich Menschen durch die Berührung von kontaminierten Oberflächen mit dem SARS-CoV-2-Virus angesteckt haben, kann dieser Infektionsweg nicht ausgeschlossen werden. Um Hausmeister, Bewohner von Mehrfamilienhäusern und Mitarbeiter der Abfallentsorgung zu schützen, benennt das Bundesumweltministerium deshalb Vorsichtsmaßnahmen: Bei Haushalten mit infizierten Personen oder begründeten Verdachtsfällen entfällt die Pflicht zur Abfalltrennung. Neben Restmüll müssen diese Haushalte auch Verpackungsabfälle, Altpapier und Biomüll über den zur Verbrennung bestimmten Restabfall entsorgen. Die Abfälle dürfen nicht lose in die Tonne eingeworfen werden, sondern sicher verpackt in stabilen, reißfesten Abfallsäcken. Erst nach Genesung und beendeter Quarantäne soll die getrennte Entsorgung von Glasabfällen, Pfandverpackungen, Elektro- und Elektronikabfällen, Batterien und Schadstoffen angegangen werden.[314]
Die am 14. April 2020 von der EU-Kommission veröffentlichten Leitlinien zur Abfallentsorgung in der Coronavirus-Krise enthalten weitere Grundsätze im Falle einer Behandlung von Erkrankten in Privathaushalten: Taschentücher und Atemmasken sollten in einem eigenen Abfallbehälter im Zimmer des Patienten gesammelt werden, Handschuhe und Gesichtsmasken von Betreuern in einem zweiten Behälter in Türnähe. Die Abfallsäcke sind zu verschließen, bevor sie aus dem Patientenzimmer transportiert werden, können dann aber gemeinsam gesammelt und in den Restmüll gegeben werden.[315]
Prophylaktische Steigerung des Vitamin-D-Spiegels
In der Literatur wird ein Zusammenhang zwischen einem niedrigen Vitamin-D-Spiegel und der Schwere einer COVID-19-Erkrankung diskutiert.[316][317][318] Nach Einschätzung von Gesundheitsbehörden aus den USA[241], England[240] oder Deutschland[223] besteht aktuell (Februar 2021) keine Evidenz für eine Vitamin-D-Gabe zur Vorbeugung von COVID-19. Laut Bundesinstitut für Risikobewertung bestehe auf Basis der gegenwärtigen Studienlage kein Anlass, der gesunden Allgemeinbevölkerung die generelle Einnahme von Nahrungsergänzungsmitteln mit Vitamin D zu empfehlen, für Bewohner von Pflegeheimen allerdings könne eine generelle Vitamin-D-Einnahme von bis zu 20 µg (800 IE) pro Tag erwogen werden.[319]
Medizinisches Personal

Das Robert Koch-Institut gab am 24. Januar 2020 erste Hinweise, welche Hygienemaßnahmen zur Vermeidung einer Übertragung des Erregers durch Tröpfchen auf medizinisches Personal notwendig sind: Als Empfehlung wurde die konsequente Einhaltung der Basishygiene, besonders der Händehygiene, genannt.[320] Mit Änderung der Falldefinitionen am 14. Februar 2020 wurden die Hygienemaßnahmen präzisiert und in der Folge an neue Erkenntnisse angepasst (Stand 8. April 2020): So wird aus Gründen des Patientenschutzes während der Pandemie für alle Bereiche des Gesundheitswesens „das generelle Tragen von Mund-Nasen-Schutz (MNS) durch sämtliches Personal mit direktem Kontakt“ zu besonders gefährdeten Personengruppen empfohlen. Bei der Behandlung und Pflege von Patienten mit möglicher oder bestätigter SARS-CoV-2-Infektion sollte persönliche Schutzausrüstung (PSA) in Form von Schutzkittel, Schutzhandschuhen, Schutzbrille und mindestens dicht anliegendem MNS oder einer Atemschutzmaske getragen werden. Dabei sollte bevorzugt eine Maske des Standards FFP2 verwendet werden, die Schutz vor Aerosolen und Tröpfchen bietet. Wenn FFP2-Masken nicht zur Verfügung stehen, soll als Schutz gegen Tröpfchen zumindest ein MNS getragen werden. Für alle Tätigkeiten, die mit Aerosolproduktion einhergehen (z. B. Intubation oder Bronchoskopie), werden FFP2-Masken oder darüber hinausgehender Atemschutz empfohlen. Diese Angaben gelten auch bei der stationären Versorgung.[320]
Stehen keine CE-gekennzeichneten Masken zur Verfügung, können laut der Bundesanstalt für Arbeitsschutz und Arbeitsmedizin (BAuA) „bis auf Weiteres“ Masken verwendet werden, die mindestens dem NIOSH-Standard N95 entsprechen (Stand 6. April 2020).[321]
Bei Symptomen einer Atemwegserkrankung muss der Patient einen Mund-Nasen-Schutz tragen und wird in der Arztpraxis zur Verdachtsabklärung nach Möglichkeit in einen separaten Raum geführt, wo die weiteren Untersuchungen stattfinden.[185]
Zur chemischen Desinfektion der Hände und Flächen sind Desinfektionsmittel geeignet, die die Wirkungsbereiche „begrenzt viruzid“, „begrenzt viruzid PLUS“ oder „viruzid“ abdecken.[320][322] Eine Auswertung von 22 Studien, die sich mit der Persistenz und Inaktivierung von medizinisch relevanten Coronaviren (wie SARS-CoV und MERS-CoV) unter anderem in Gesundheitseinrichtungen beschäftigen, zeigt, dass für die Oberflächendesinfektion Mittel auf der Basis von Ethanol (mindestens 65 %), Wasserstoffperoxid oder Natriumhypochlorit in entsprechender Konzentration wirksam sind.[57]
Neben den Hygienemaßnahmen durch das medizinische Personal zählen außerdem die Unterbringung des Patienten in einem Isolierzimmer mit Vorraum oder Schleuse[320] und das Abstellen eventuell vorhandener raumlufttechnischer Anlagen, über die ein Luftaustausch mit anderen Räumen möglich ist, zu den Präventionsmaßnahmen.[320]
Zahnärztliche Behandlung
Bei einer zahnärztlichen Behandlung kommen meist Bohrinstrumente mit Wasserkühlung zum Einsatz. Dabei bildet sich Aerosol. Eine mögliche Übertragung durch diese Form von Aerosol ist noch nicht wissenschaftlich erwiesen, da in Zahnarztpraxen, anders als in Laborversuchen, umfassende Absaugungen zum Einsatz kommen. Bisherige Studien zur Virusmenge im Aerosol verwenden nicht den Speichel eines symptomlosen infizierten Menschen als Testsubstrat (Real-Szenario), sondern hoch kontaminierte, künstliche Reagenzien, die einem 1-ml-Rachenabstrich eines Patienten mit schwerem Verlauf ähneln.[323] Informationen aus der Zahnklinik der Universität Wuhan widerlegen ein erhöhtes Übertragungsrisiko für zahnmedizinisches Personal bei Einhaltung der bisherigen Hygiene-Maßnahmen (Mund-Nasen-Schutz, Schutzbrille, Untersuchungs-Handschuhe).[324]
Im März 2020 war die notwendige Schutzausrüstung bei der Behandlung von nachgewiesen mit COVID-19 infizierten Patienten (Atemschutzmaske FFP2, Schutzbrille mit Seitenschutz oder Visier, Untersuchungs-Handschuhe, langärmliger Schutzkittel, Kopfhaube) in vielen Zahnarztpraxen – auch wegen Lieferschwierigkeiten – nicht oder nur eingeschränkt vorhanden. Patienten sollten deshalb nur bei Notfällen und dringenden Behandlungen einen Zahnarzt aufsuchen.[325] Im Mai erklärte die Bundeszahnärztekammer, die Situation im Bereich Schutzausrüstung habe sich verbessert und die Hygienestandards seien auf die Pandemie-Situation angepasst worden. Also könnten alle zahnärztlichen Behandlungen wieder durchgeführt werden.[326] Umfangreiche aktuelle Informationen stellt die Bundeszahnärztekammer auf ihrer Webseite zur Verfügung.[327]
Abfälle aus der medizinischen Behandlung
Die RKI-Empfehlungen zur Abfallentsorgung im Rahmen der Behandlung und Pflege von Patienten mit einer Infektion durch SARS-CoV-2 basieren auf der Mitteilung 18 der Bund/Länder-Arbeitsgemeinschaft Abfall (LAGA). Sie werden regelmäßig an neue Erkenntnisse angepasst. Nach derzeitigem Wissen (Stand 24. April 2020) fallen bei der Behandlung von COVID-19-Patienten in der Regel keine gefährlichen Abfälle an. Wenn die üblichen Maßnahmen des Arbeitsschutzes eingehalten und geeignete persönliche Schutzausrüstungen getragen werden, stellen nicht flüssige Abfälle aus der Behandlung erkrankter Patienten kein besonderes Infektionsrisiko dar.[328] Atemschutzmasken, Verbände oder auch Aufwischtücher können so unter dem Abfallschlüssel 180104 geführt werden. Die Abfälle sind unmittelbar am Entstehungsort in reißfesten, feuchtigkeitsbeständigen und dichten Behältnissen zu sammeln und ohne Umfüllen oder Sortieren in sicher verschlossenen Behältern zu transportieren. Spitze und scharfe Gegenstände sollten in bruch- und durchstichsichere Einwegbehältnisse gegeben werden. Abfälle, die bei der mikrobiologischen und virologischen Diagnostik von COVID-19 entstehen und nicht durch ein anerkanntes Verfahren desinfiziert werden können, zählen hingegen regelhaft zu den infektiösen Abfällen des Abfallschlüssels 180103*. Für deren Sammlung und Entsorgung gelten aus infektionspräventiver Sicht besondere Anforderungen.[329]
Gesellschaftliche Vorbeugung

Wie alle Maßnahmen der Pandemiebekämpfung hat die gesellschaftliche Vorbeugung folgende Ziele:
- Verringerung der Morbidität und Mortalität Bevölkerung
- Sicherstellung der Versorgung erkrankter Personen
- Aufrechterhaltung essentieller, öffentlicher Dienstleistungen[330][331]
Diese übergeordneten Ziele werden je nach epidemiologischer Phase durch unterschiedliche Strategien erreicht. Solange die meisten Fälle isoliert oder in lokalen Clustern austreten, liegt der Schwerpunkt auf Containment. Dazu müssen Erkrankte isoliert und Kontaktpersonen möglichst lückenlos identifiziert und in (häuslicher) Quarantäne untergebracht werden. Damit sollen Infektionsketten so schnell wie möglich unterbrochen werden.[330][332] Bei einer anhaltenden Mensch-zu-Mensch-Übertragung empfiehlt das Europäische Zentrum für die Prävention und die Kontrolle von Krankheiten zur Eindämmung von COVID-19 eine Reihe weiterer nicht-pharmazeutischer Maßnahmen:
- Individuelle Hygienemaßnahmen wie Hand- und Atemhygiene und die Nutzung von Gesichtsmasken, wo immer keine ausreichende räumliche Distanz aufrechterhalten werden kann;
- umweltbezogene Maßnahmen wie Reinigung von Oberflächen und Belüftung geschlossener Räume;
- bevölkerungsbezogene Maßnahmen wie Räumliche Distanzierung, Einschränkungen von Reisen und Mobilität und Beschränkung des Zusammentreffens unterschiedlicher Personen.[332]
Das ECDC schließt nach Auswertung wissenschaftlicher Studien, dass die nicht-pharmazeutischen Maßnahmen nachweislich eine kritische Rolle bei der Eindämmung der COVID-19-Pandemie in Europa gespielt haben. Sie bleiben demnach notwendig, so lange kein Impfstoff zur Verfügung steht. Wegen der schweren negativen gesellschaftlichen Folgen der Maßnahmen sollten sie aber nur dort angewandt werden, wo die lokale epidemische Situation das nötig macht.[332] Drei systematische Übersichtsarbeiten im Rahmen der Cochrane Library zu Reisebeschränkungen, Massentestungen und Quarantäne von Kontaktpersonen stellen fest, dass keine dieser Maßnahmen allein einen großen nachweisbaren Effekt auf die Verbreitung von COVID-19 hat. Für die Wirksamkeit von Reisebeschränkungen gibt es immerhin Hinweise, für die Wirksamkeit von Quarantänen erkennbare Belege. Die Autoren schließen, dass die untersuchten Maßnahmen in Kombination mit anderen nicht-pharmazeutischen Maßnahmen eingesetzt werden sollten. Maßnahmen wie Gesichtsmasken und soziale Distanzierung bleiben demnach weiterhin wichtig zur Kontrolle der COVID-19-Pandemie.[333][334][335]
-
Besuchsverbotsschild in der München Klinik Bogenhausen
-
Abstandsregelung in einem Theater in Kavala / Griechenland
-
Urinale, die während der Pandemie zu Gunsten des Abstandhaltens blockiert wurden
Management von Kontaktpersonen durch öffentliche Behörden
Die Nachverfolgung von Kontaktpersonen erfolgt im Rahmen des Infektionsschutzes im Einklang mit der Einschätzung der Situation des Geschehens durch das lokal zuständige Gesundheitsamt. Das Robert Koch-Institut unterscheidet zwischen Kontaktpersonen mit höherem Infektionsrisiko (Kategorie I), Kontaktpersonen mit geringerem Infektionsrisiko (Kategorie II) und Kontaktpersonen der Kategorie III, dabei handelt es sich um medizinisches Personal mit einem geringen Expositionsrisiko. Ein höheres Infektionsrisiko gemäß Kategorie I kann durch engen Kontakt, Kontakt mit Sekreten des Infizierten oder einer Kontaktsituation mit hohem Übertragungsrisiko durch Aerosole entstehen.[336]
In Deutschland wird Personen der Kategorie I unter Abwägung der Möglichkeiten und nach Risikobewertung des Gesundheitsamtes eine häusliche Absonderung mit regelmäßiger Gesundheitsüberwachung (bis zum 14. Tag nach dem letzten Kontakt mit dem bestätigten Infektionsfall) empfohlen, dabei sollen die Kontaktpersonen ein Tagebuch führen, in dem die Körpertemperatur, Symptome und mögliche weitere Kontaktpersonen notiert werden. Das Gesundheitsamt meldet sich täglich, um sich über den Gesundheitszustand informieren zu lassen. Die Kontaktpersonen werden über das COVID-19-Krankheitsbild informiert und sollen namentlich registriert werden. Falls während der häuslichen Quarantäne Symptome auftreten, die auf eine SARS-CoV-2-Infektion hindeuten, wird die Kontaktperson als Verdachtsfall angesehen und nach Rücksprache mit dem Gesundheitsamt eine diagnostische Abklärung veranlasst.[336]
Personen der Kategorie II wird eine häusliche Absonderung auf freiwilliger Basis nahegelegt, eine namentliche Registrierung ist optional. Auch hier gilt, dass bei Eintreten von Symptomen unverzüglich das Gesundheitsamt zu informieren ist. Bei der häuslichen Absonderung ist u. a. die Kontaktperson zeitlich und räumlich von anderen Haushaltsmitgliedern zu trennen und auf die Hygiene (Händewaschen, Hustenetikette) zu achten.[336] Das Management von Personen der Kategorie III dient dazu, nosokomiale Übertragungen des Virus zu vermeiden. Dabei gilt, dass das medizinische Personal durch die Verwendung der persönlichen Schutzausrüstung (PSA) vor Infektionen geschützt ist, aber darüber hinaus durch Schulungen und organisatorische Maßnahmen verhindert werden soll, dass es zu Virusübertragungen im Arbeitsbereich kommt. Nach Möglichkeit soll das medizinische Personal, das COVID-19-Patienten versorgt, nicht mit der Versorgung anderer Patienten beauftragt werden. Das medizinische Personal soll sensibilisiert werden und sich selbst auf Symptome überwachen, die Ergebnisse wie auch die verwendete PSA sollen in einem Tagebuch notiert werden.[337]
Bei Kontaktpersonen I wird von einer häuslichen Absonderung abgesehen, wenn diese in den letzten drei Monaten selbst als laborbestätigter Fall die Infektion durchgemacht haben.[336]
Schutzimpfungen
Impfstoffe und Impfstoffkandidaten

Im Artikel SARS-CoV-2-Impfstoff sind in tabellarischer Form die bisher → zugelassenen COVID-19-Impfstoffe, die →Impfstoffkandidaten in klinischer Prüfung sowie die →Impfstoffkandidaten in präklinischer Prüfung erfasst. Außerdem können dem Artikel Informationen zur Impfstoffentwicklung, der Arzneimittelsicherheit, der Impfstoffwirksamkeit und zur Arzneimittelzulassung entnommen werden.
Weltweit sind laut Weltgesundheitsorganisation (Stand: 6. Januar 2021) 63 Vakzine in der klinischen Prüfung, davon 20 in der abschließenden Phase-III-Studie. Weitere 172 sind in der vorklinischen Entwicklung.[338] Die zugelassenen Impfstoffe werden inzwischen weltweit eingesetzt (s. Fortschritt der Impfkampagnen).
Da der Impfstoff Tozinameran (BioNTech/Pfizer) nicht sofort weltweit in ausreichender Menge vorhanden sein wird, erfordert die anfängliche Knappheit von COVID-19-Impfstoffe und begrenzten Impfkapazitäten Auswahlentscheidungen, eine Priorisierung der COVID-19-Impfmaßnahmen darüber, wer zuerst geimpft werden soll. Ebenso stellt die Logistik der Transport- und Lagerbedingungen des COVID-19-Impfstoffs eine große Herausforderung dar.
Allgemeine Impfprophylaxe
Die Berliner Senatsgesundheitsverwaltung empfahl Ende Februar 2020 allen Menschen über 60 Jahre und chronisch Kranken, ihren Impfstatus zu überprüfen und gegebenenfalls die Impfung gegen Pneumokokken und Keuchhusten (Pertussis) durchführen oder auffrischen zu lassen. Da Menschen über 60 Jahre und chronisch Kranke durch Mehrfachinfektionen besonders gefährdet sind, seien sie vorsorglich zu schützen.[339][340]
Effekt durch Grippeimpfung
Das American Journal of Infectious Diseases verweist am 22. Februar 2021 auf eine Studie, in der es heißt, eine Influenza-Impfung senke die Infektionsrate mit dem SARS-CoV-2-Virus um 24 %. Unter den auf COVID-19 positiv getesteten Patienten hatten die Influenza-geimpften gegenüber den ungeimpften ein geringeres Risiko eines Krankenhausaufenthalts oder einer künstlichen Beatmung und hatten eine kürzere Aufenthaltsdauer im Krankenhaus. Bis COVID-19-Impfstoffe ausreichend verfügbar sind, wird eine Impfung gegen Influenza empfohlen, um die Pandemie zu reduzieren. Das angeborene Immunsystem ist lernfähig. Auf epigenetischer Ebene finden bei einer Infektion biochemische Modifikationen der für die DNA-Verpackung im Zellkern maßgeblichen Histone statt, was „trainierte Immunität“ genannt wird.[341]
Maßnahmen bei Todesfällen
Laut den Empfehlungen des RKI ist beim Umgang mit an COVID-19 Verstorbenen jeglicher Körperkontakt oder die Abgabe von Flüssigkeiten und Aerosolen zu vermeiden. Eine notwendige Leichenschau ist unter Regelungen der Schutzstufe 3 durchzuführen. Auf dem Totenschein ist COVID-19 namentlich anzugeben und Särge sind zu markieren.[342]
Meldepflicht, ICD-10-Einordnung, Berufskrankheit
In Deutschland sind Verdacht einer Erkrankung, die Erkrankung sowie der Tod in Bezug auf die Coronavirus-Krankheit-2019 seit 23. Mai 2020 gemäß § 6 Abs. 1 Nr. 1 lit. t des Infektionsschutzgesetzes (IfSG) meldepflichtig. Die Meldepflicht wurde bereits zum 1. Februar 2020 durch Verordnung eingeführt. Seit der gesetzlichen Regelung durch das „Zweite Gesetz zum Schutz der Bevölkerung bei einer epidemischen Lage von nationaler Tragweite“ sind auch der Behandlungszustand zur Krankheit (einschließlich der Genesung[343][344]) und der Serostatus durch Ärzte und Gesundheitsämter anzugeben (§ 9 Abs. 1 Nr. 1 lit. n, § 11 Abs. 1 Nr. 1 lit. d und j IfSG). Die klinisch-epidemiologischen Kriterien für den Verdacht[345] werden wie nach der vorherigen Verordnung durch das Robert Koch-Institut festgelegt und veröffentlicht (als Falldefinitionen nach § 11 Absatz 2 IfSG).[344]
Zudem besteht in Deutschland für Labore eine Meldepflicht hinsichtlich des Virus SARS-CoV-2 in Bezug auf Menschen. Seit dem 2. Juli 2020 besteht eine Meldepflicht, wenn Haustiere positiv getestet wurden.[346]
In Österreich besteht ebenfalls Anzeigepflicht nach dem Epidemiegesetz[347] von 1950 zusammen mit einer Verordnung.[348] Die Pflicht zur Anzeige besteht für Verdachts-, Erkrankungs- und Todesfälle aufgrund dieses Virus. Zudem wurde auch die Absonderungsverordnung[349] um das neue Coronavirus erweitert.[350]
Auch in der Schweiz existiert eine Meldepflicht.[351] Diese folgt aus dem Epidemiengesetz[352] der Schweiz in Verbindung mit der Epidemienverordnung[353] und der Verordnung des Eidgenössischen Departements des Innern (EDI) über die Meldung von Beobachtungen übertragbarer Krankheiten des Menschen.[354] Nach Anhang 1 der Verordnung des EDI müssen Ärzte einen klinischen Verdacht und die Veranlassung einer erregerspezifischen Labordiagnostik und den nötigen epidemiologischen Zusammenhang melden. Nach Anhang 3 der Verordnung des EDI müssen Labore einen positiven und negativen Befund (also Nachweis) melden. Das Bundesamt für Gesundheit hat hierzu Verdachts-, Beprobungs-, Meldekriterien veröffentlicht.[355]
| Klassifikation nach ICD-10-GM | |
|---|---|
| U08.9 | COVID-19 in der Eigenanamnese, nicht näher bezeichnet |
| U09.9! | Post-COVID-19-Zustand, nicht näher bezeichnet |
| U10.9 | Multisystemisches Entzündungssyndrom in Verbindung mit COVID-19, nicht näher bezeichnet |
| U99.0! | Spezielle Verfahren zur Untersuchung auf SARS-CoV-2 |
| ICD-10 online (GM-Version 2023) | |
Am 17. Februar 2020 wurde die Krankheit durch die Weltgesundheitsorganisation (WHO) in die Internationale Klassifikation der Krankheiten (ICD) in der aktuellen, international gültigen Ausgabe ICD-10-WHO (Version 2019) unter Schlüsselnummer »U07.1« aufgenommen. Für die in Deutschland geltende ICD-10-GM (German Modification) wurde als sekundärer Kode die Ausrufezeichenschlüsselnummer »U07.1!« vergeben und die Krankheit als COVID-19 (Coronavirus-Krankheit-2019) bezeichnet.[356] Weiterhin erfolgte eine entsprechende Ergänzung für die Todesursachenkodierung in der ICD-10-GM.[108] Am 23. März 2020 wurde von der WHO eine Anpassung vorgenommen, die darauf abzielt, auch Verdachtsfälle kodieren zu können. Entsprechend werden mit der Schlüsselnummer »U07.1« per Labordiagnostik bestätigte COVID-19-Erkrankungen kodiert, während die »Schlüsselnummer U07.2« für Fälle vorgesehen ist, die zwar klinisch-epidemiologisch, aber nicht per Labordiagnostik bestätigt wurden. Für die ICD-10-GM erfolgt die Kodierung analog in Form der beiden sekundären Kodes »U07.1!« mit der Bezeichnung: COVID-19, Virus nachgewiesen und »U07.2!« mit der Bezeichnung: COVID-19, Virus nicht nachgewiesen.[2] Zweites gilt aber nur, soweit vorher ein Verdacht auf COVID-19 bestand.[357] Sofern kein Verdacht auf eine Erkrankung bestand, ein Test auf SARS-CoV-2 durchgeführt wurde und dieser Test negativ ausfällt, so ist mit »U99.0!« für Spezielle Verfahren zur Untersuchung auf SARS-CoV-2 zu kodieren zusammen mit »Z11« für Spezielle Verfahren zur Untersuchung auf infektiöse und parasitäre Krankheiten.[358]
| Klassifikation nach ICD-10-GM | |
|---|---|
| U11.9 | Notwendigkeit der Impfung gegen COVID-19, nicht näher bezeichnet |
| U12.9! | Unerwünschte Nebenwirkungen bei der Anwendung von COVID-19-Impfstoffen, nicht näher bezeichnet |
| ICD-10 online (GM-Version 2023) | |
Im November 2020 veröffentlicht das BfArM (früher DIMDI) in seinem Newsletter neue Codes, welche von der WHO am 11. November 2020 in die ICD-10 aufgenommen worden waren[359]. Diese Codes sind ab 2021 auch in der Schweiz zu verwenden.[360]
Im März 2021 werden vom BfArM neue Codes veröffentlicht, welche im Kontext zur Covid-19-Impfung stehen. In Deutschland sind diese Codes ab 10. März 2021 zu verwenden.[361]
Nach deutschem Recht kann COVID-19 als Berufskrankheit anerkannt werden, wenn der Erkrankte im Gesundheitsdienst, in der Wohlfahrtspflege oder in einem Laboratorium tätig oder durch eine andere Tätigkeit der Infektionsgefahr in ähnlichem Maße besonders ausgesetzt war.[362]
Ursprung
Es wird angenommen, dass das Virus natürlichen Ursprungs ist[363] und von einem Tier stammt und durch sog. Spillover-Infektion auf den Menschen übergegangen ist.[364] Es gibt unterschiedliche Theorien darüber, woher der erste Fall (der sogenannte Patient Null) stammt, Untersuchungen über den Ursprung der Pandemie sind im Gange.[365] Die Phylogenetik geht davon aus, dass SARS-CoV-2 im Oktober oder November 2019 entstanden ist.[366][367][368] Obwohl eine italienische Studie nahelegt, dass der Virus dort bereits im September 2019 vorhanden war.[369] Es gibt Hinweise darauf, dass es von einem Coronavirus abstammt, das wilde Fledermäuse infiziert und sich über einen Zwischenwirt in der Tierwelt auf den Menschen ausgebreitet hat.[370][371]
COVID-19, Tiere und Haustiere
Während innerhalb der Coronavirusfamilie Coronaviridae einzelne Viren, wie das CCoV und das FCoV, auch bei Haustieren Erkrankungen auslösen, wurde in den ersten Monaten der Coronapandemie zunächst kein Fall bekannt, in dem ein Haustier an SARS-CoV-2 erkrankte.[372][373][374][375] Obwohl das Virus bei Hunden in Abstrichen aus Nase und Schnauze nachgewiesen werden konnte, löste es keine Erkrankungen aus.[376][375] Nachdem zunächst nur ein Einzelfall einer Katze mit Krankheitssymptomen in Belgien bekannt geworden war, zeigte eine umfangreichere serologische Studie, dass bei knapp 15 % der untersuchten Tiere Antikörper und somit eine vorherige Infektion nachweisbar war.[377][378]
Es gibt laut WHO noch keine Hinweise, dass Haustiere das Virus als Träger weiterverbreiten.[373][375] Versuche mit Frettchen in Südkorea ergaben indes, dass nicht-infizierte Tiere durch anhaltenden direkten Kontakt mit infizierten Tieren (Haltung im selben Käfig) angesteckt werden können. Erkrankte Frettchen entwickeln mehrtägige Verläufe mit Symptomen wie leichtes Fieber, Husten und reduzierte körperliche Aktivität.[379] Anfang April wies eine weitere Studie diese Anfälligkeit auch bei Katzen nach. Den Autoren zufolge kommt dabei eine Aerosolübertragung in Betracht. In beiden Tierarten war die Viruslast im Nasen-Rachenraum am höchsten. Die Lungen von Frettchen sowie weitere Organe waren nicht befallen, bei Katzen dagegen schon. Hunde zeigten ein geringes Infektionsrisiko; bei Schweinen, Hühnern und Enten war sowohl der PCR-Abstrich als auch der ELISA-Antikörpertest nach 14 Tagen negativ.[380]
Im Januar 2021 wurden im Zoo von San Diego Gorillas positiv auf SARS-CoV-2 getestet; die ersten Menschenaffen, bei denen COVID-19 nachgewiesen wurde.[381]
Im US-Bundesstaat Utah starben einige Tausend Amerikanische Nerze, die sich wahrscheinlich bei Tierpflegern angesteckt hatten.[382]
In den Niederlanden gibt es zahlreiche Nerzfarmen. Niederländische Behörden meldeten Ende Mai 2020, „mit hoher Wahrscheinlichkeit“ seien zwei Arbeiter durch Kontakt mit Nerzen COVID-19-infiziert worden. Die WHO teilte mit, es könne sich um die „ersten bekannten Fälle“ einer Übertragung des Virus vom Tier auf den Menschen handeln (Näheres und Beleg → COVID-19-Pandemie im Königreich der Niederlande#Wirtschaft und Unternehmen).
In Dänemark untersucht(e) das Fødevarestyrelsen (Nahrungsmittelbehörde)[383] 120 Nerzfarmen. In der Gemeinde Hjørring fand sie unabhängig davon drei Farmen mit SARS-CoV-2-infizierten Nerzen; alle Nerze in diesen Farmen wurden getötet.[384]
Im Juni wurde bei Nerzen, Nerzzüchtern, dem Hund eines Nerzzüchters und 41 Bewohnern eines Pflegeheimes die gleiche Mutation eines SARS-CoV-2-Virus festgestellt. Von den Bewohnern starben drei. Auch bei Schülern an drei verschiedenen Schulen wurden SARS-CoV-2 gefunden.[385]
Im November entschied die dänische Regierung vorsorglich eine Keulung des gesamten nationalen Nerzbestands.[386] Am 5. November 2020 verhängte die dänische Regierung aufgrund zunehmender Verbreitung in Nerzen mutierter SARS-CoV-2-Viren (insbesondere der antikörperresistenteren „Cluster 5“-Variante) in der allgemeinen Öffentlichkeit einen „harten regionalen Lockdown“ über Teile Norddänemarks.[387][388]
Ein experimentelles Vakzin gegen COVID-19 wird an den in ihrem Bestand stark gefährdeten (Endangered, IUCN 3.1) Schwarzfußiltissen erprobt.[389] Finnland entwickelt einen Impfstoff für Marderhunde und Amerikanische Nerze (Minks), um in den Pelztierfarmmen keine Massenkeulungen vornehmen zu müssen.[390] Auch Russland entwickelt einen Impfstoff für Nerze, Katzen und Nagetiere. Dieser soll nach Planung Ende Januar 2021 verfügbar sein.[391]
Siehe auch
Literatur
Deutschsprachig
- Kristin Tolksdorf, Silke Buda, Ekkehard Schuler, Lothar H. Wieler, Walter Haas: Eine höhere Letalität und lange Beatmungsdauer unterscheiden COVID-19 von schwer verlaufenden Atemwegsinfektionen in Grippewellen. In: Epidemiologisches Bulletin. Nr. 41, 2020, S. 3–10, online 28. August 2020, doi:10.25646/7111.
- Julia Schilling, Michaela Diercke, Doris Altmann, Walter Haas, Silke Buda: Vorläufige Bewertung der Krankheitsschwere von COVID-19 in Deutschland basierend auf übermittelten Fällen gemäß Infektionsschutzgesetz. In: Epidemiologisches Bulletin. Nr. 17, 2020, S. 3–9, online 15. April 2020, doi:10.25646/6670.2.
- Ralf Stahlmann, Hartmut Lode: Therapie von COVID-19 – erste klinische Studien mit verschiedenen Wirkstoffen. In: Deutsches Ärzteblatt. Band 117, Nr. 13, 27. März 2020, S. 213–219, doi:10.3238/arztebl.2020.0213 (aerzteblatt.de).
- Kristin Tolksdorf, Silke Buda, Ekkehard Schuler, Lothar H. Wieler, Walter Haas: Schwereeinschätzung von COVID-19 mit Vergleichsdaten zu Pneumonien aus dem Krankenhaussentinel für schwere akute Atemwegserkrankungen am RKI (ICOSARI). In: Epidemiologisches Bulletin. Nr. 14, 2020, S. 3–9, online 27. März 2020, doi:10.25646/6601.
Englischsprachig
- Christian Drosten / Thijs Kuiken u. a.: Newly discovered coronavirus as the primary cause of severe acute respiratory syndrome, The Lancet, Band 362, 2003, S. 263–270.
- Tingbo Liang (Hrsg.): Handbook of COVID-19 Prevention and Treatment. First Affiliated Hospital, Zhejiang University School of Medicine, Onlineveröffenlichung 2020, abrufbar als PDF vom Cloudservice von Alibaba.com, zuletzt abgerufen am 8. April 2020.
Weblinks
- Steckbrief, FAQs, Aktuelles
- Steckbrief zu COVID-19 Robert Koch-Institut (Deutschland)
- Neuartiges Coronavirus (COVID-19) Bundesministerium für Soziales, Gesundheit, Pflege und Konsumentenschutz (Österreich) (mit Link zum amtlichen Dashboard zu COVID-19)
- Coronavirus: Krankheit, Symptome, Behandlung Bundesamt für Gesundheit (Schweiz)
- Questions and answers on COVID-19 Europäisches Zentrum für die Prävention und die Kontrolle von Krankheiten (englisch)
- Q&A: Coronavirus disease (COVID-19) Weltgesundheitsorganisation (englisch)
- CORD-19 - COVID-19 Open Research Dataset tausende wissenschaftliche Veröffentlichungen online
- Beiträge zum Thema Corona Website der WDR-Sendung Quarks
- S1-Leitlinie Infektionsprävention durch das Tragen von Masken der Gesellschaft für Virologie (GfV). In: AWMF online (Stand 11/2020)
- Dokumentationen
- Corona - Ende in Sicht? »Was die Wissenschaft über SARS-CoV-2 weiß«. In: ZDF – planet e., Video-Dokumentation, 28 Minuten. Hrsg. ZDF, 17. Januar 2021, abgerufen am 15. Februar 2021 (in der ZDF-Mediathek → verfügbar bis 13. Januar 2023).
- Wie sich Corona in Europa festsetzte (interaktiv) Zeit Online, 8. April 2021
- Auswirkungen auf den menschlichen Körper
- Covid-19: Auswirkungen auf den ganzen Körper NDR-Video (2:48 Min.), 4. Juni 2020
- Sars-CoV-2: Wie das Virus den Körper verwüstet Spektrum.de, 26. Juni 2020
- COVID-19-Medikamente
- COVID-19 Treatment and Vaccine Tracker Übersicht über laufende Projekte auf der Website des Milken Institute in Kalifornien (englisch)
- Treatments and vaccines for COVID-19 Übersicht der Europäischen Arzneimittel-Agentur (englisch)
Einzelnachweise
- ↑ § 6 Abs. 1 Nr. 1 lit. t des Infektionsschutzgesetzes (Deutschland)
- ↑ a b ICD-10 (WHO und GM): U07.2 kodiert Verdacht auf COVID-19. In: dimdi.de. Deutsches Institut für Medizinische Dokumentation und Information, 23. März 2020, abgerufen am 14. August 2020.
- ↑ Terminologiesammlung INFEC20 - Terminologie der übertragbaren Krankheiten, Stichwort COVID-19, hrsg. von der Schweiz. Bundeskanzlei.
- ↑ Schweiz: Alternative Begriffe: Krankheit Covid-19, Covid-19-Erkrankung. Französisch: maladie à coronavirus 2019; italienisch: malattia da coronavirus 2019; rätoromanisch: malsogna da coronavirus 2019
- ↑ Pressestelle des RKI: Epidemiologischer Steckbrief zu SARS-CoV-2 und COVID-19. (Abschnitt 7: Diagnostik). In: RKI-Website zu SARS-CoV-2. Robert Koch-Institut (RKI), 25. Januar 2021, abgerufen am 27. Januar 2021 (Stand: 25. Januar 2021).
- ↑ WHO Coronavirus Disease (COVID-19) Dashboard Stand: 20. Mai 2021
- ↑ SARS-CoV-2 Steckbrief zur Coronavirus-Krankheit-2019 (COVID-19) Auf: rki.de, Stand: 18. September 2020.
- ↑ a b Sars-CoV-2-Virus: Luftfeuchtigkeit spielt wichtige Rolle bei Aerosolen. In: Spiegel Online. 18. August 2020, abgerufen am 18. August 2020.
- ↑ Christian Honey: Coronavirus: Was tun gegen Aerosolübertragung? In: Spektrum.de. 10. Juli 2020, abgerufen am 14. August 2020.
- ↑ Why do some COVID-19 patients infect many others, whereas most don’t spread the virus at all? Science, 19. Mai 2020, abgerufen am 14. August 2020.
- ↑ a b c d e f g h i j k Epidemiologischer Steckbrief zu SARS-CoV-2 und COVID-19. Robert Koch-Institut, 9. Februar 2021, abgerufen am 21. Februar 2021.
- ↑ D. Baud, X. Qi, K. Nielsen-Saines at al.: Real estimates of mortality following COVID-19 infection. In: The Lancet. 12. März 2020, abgerufen am 14. August 2020.
- ↑ „Q&A on coronaviruses (COVID-19)“. Symptome von COVID-19. Weltgesundheitsorganisation (WHO), 17. April 2020, abgerufen am 14. August 2020 (englisch).
- ↑ a b Zunyou Wu, Jennifer M. McGoogan, CCDC: Characteristics of and Important Lessons From the Coronavirus Disease 2019 (COVID-19) Outbreak in China. In: Journal of the American Medical Association. 24. Februar 2020, doi:10.1001/jama.2020.2648 (englisch).
- ↑ Fu-Sheng Wang: Liver injury in COVID-19: management and challenges. In: Lancet Gastroenterology & Hepatology. 4. März 2020, doi:10.1016/S2468-1253(20)30057-1.
- ↑ Yeshun Wu et al.: Nervous system involvement after infection with COVID-19 and other coronaviruses. In: Brain, Behavior and Immunity. Elsevier, 30. März 2020, doi:10.1016/j.bbi.2020.03.031.
- ↑ Yongwen Chen et al.: Human Kidney is a Target for Novel Severe Acute Respiratory Syndrome Coronavirus 2 (SARS-CoV-2) Infection. In: MedRxiv. 10. April 2020, doi:10.1101/2020.03.04.20031120.
- ↑ Frank Ruschitzka et al.: Endothelial cell infection and endotheliitis in COVID-19. In: The Lancet. 17. April 2020, doi:10.1016/S0140-6736(20)30937-5.
- ↑ R. M. Inciardi, L. Lupi, G. Zaccone, et al.: Cardiac Involvement in a Patient With Coronavirus Disease 2019 (COVID-19). In: JAMA Cardiol. 27. März 2020, doi:10.1001/jamacardio.2020.1096.
- ↑ Valentina O. Puntmann, M. Ludovica Carerj, Imke Wieters, Masia Fahim, Christophe Arendt: Outcomes of Cardiovascular Magnetic Resonance Imaging in Patients Recently Recovered From Coronavirus Disease 2019 (COVID-19). In: JAMA Cardiology. 27. Juli 2020, doi:10.1001/jamacardio.2020.3557 (online [abgerufen am 14. August 2020]).
- ↑ How long does COVID-19 last? Abgerufen am 24. Dezember 2020.
- ↑ Gareth Iacobucci: Long covid: Damage to multiple organs presents in young, low risk patients. In: BMJ. Band 371, 17. November 2020, ISSN 1756-1833, doi:10.1136/bmj.m4470 (bmj.com [abgerufen am 24. Dezember 2020]).
- ↑ Elisabeth Mahase: Long covid could be four different syndromes, review suggests. In: BMJ. Band 371, 14. Oktober 2020, ISSN 1756-1833, doi:10.1136/bmj.m3981, PMID 33055076 (bmj.com [abgerufen am 24. Dezember 2020]).
- ↑ Fernando P. Polack et al.: Safety and Efficacy of the BNT162b2 mRNA Covid-19 Vaccine. In: New England Journal of Medicine. 10. Dezember 2020, doi:10.1056/NEJMoa2034577, PMID 33301246, PMC 7745181 (freier Volltext) – (nejm.org [abgerufen am 24. Dezember 2020]).
- ↑ Evan J. et al.: Safety and Immunogenicity of SARS-CoV-2 mRNA-1273 Vaccine in Older Adults. In: The New England Journal of Medicine. 29. September 2020, ISSN 0028-4793, doi:10.1056/NEJMoa2028436, PMID 32991794, PMC 7556339 (freier Volltext).
- ↑ Evan J. et al.: Safety and Immunogenicity of SARS-CoV-2 mRNA-1273 Vaccine in Older Adults. In: New England Journal of Medicine. 29. September 2020, doi:10.1056/NEJMoa2028436, PMID 32991794, PMC 7556339 (freier Volltext) – (nejm.org [abgerufen am 24. Dezember 2020]).
- ↑ a b c d Akbarshakh Akhmerov, Eduardo Marban: COVID-19 and the Heart. Circulation Research, 7. April 2020, doi:10.1161/CIRCRESAHA.120.317055
- ↑ a b P. Zhang, J. Li, H. Liu et al.: Long-term bone and lung consequences associated with hospital-acquired severe acute respiratory syndrome: a 15-year follow-up from a prospective cohort study. In: Bone Res. Band 8, Nr. 8, 2020, doi:10.1038/s41413-020-0084-5.
- ↑ a b Chia-Husn Huang, Yuan Nian Hsu: First case of Coronavirus Disease 2019 (COVID-19) pneumonia in Taiwan. In: Journal of the Formosan Medical Association. 3. Auflage. Band 119, März 2020, S. 747–751, doi:10.1016/j.jfma.2020.02.007.
- ↑ a b Jing Gao et al.: Sars-Cov-2: Underestimated damage to nervous system. In: Travel Medicine and Infectious Disease. 24. März 2020, doi:10.1016/j.tmaid.2020.101642.
- ↑ Michael A. Johansson, Daniela Saderi: Open peer-review platform for COVID-19 preprints. In: Nature. 3. März 2020, doi:10.1038/d41586-020-00613-4.
- ↑ Jon Cohen: Science's Breakthrough of the Year 2020: shots of hope in a pandemic-ravaged world. In: sciencemag.org. Science, 17. Dezember 2020, abgerufen am 18. Dezember 2020 (englisch).
- ↑ Na Zhu, Dingyu Zhang, Wenling Wang et al.: A Novel Coronavirus from Patients with Pneumonia in China. In: The New England Journal of Medicine. 2019, doi:10.1056/NEJMoa2001017 (englisch).
- ↑ a b Jasper Fuk-Woo Chan, Shuofeng Yuan, Kin-Hang Kok et al.: A familial cluster of pneumonia associated with the 2019 novel coronavirus indicating person-to-person transmission: a study of a family cluster. In: The Lancet. 24. Januar 2020, doi:10.1016/S0140-6736(20)30154-9 (englisch).
- ↑ Michelle L. Holshue, Chas DeBolt et al. for the Washington State 2019-nCoV Case Investigation Team: First Case of 2019 Novel Coronavirus in the United States. In: The New England Journal of Medicine. 31. Januar 2020, doi:10.1056/NEJMoa2001191 (englisch).
- ↑ Dongyu Guo: Evaluation of coronavirus in tears and conjunctival secretions of patients with SARS-CoV-2 infection. In: Journal of Medical Virology. 18. Februar 2020, doi:10.1002/jmv.25725.
- ↑ Nicky Phillips, Smriti Mallapaty, David Cyranoski: How quickly does the Wuhan virus spread? In: Nature. 21. Januar 2020, doi:10.1038/d41586-020-00146-w (englisch).
- ↑ a b c Zhangkai J. Cheng, Jing Shan: 2019 Novel coronavirus: where we are and what we know. In: Infection. 18. Februar 2020, doi:10.1007/s15010-020-01401-y (englisch).
- ↑ How COVID-19 Spreads. In: Website der US-amerikanischen Centers for Disease Control and Prevention (CDC). 17. Februar 2020, abgerufen am 23. Februar 2020 (englisch).
- ↑ a b SARS-CoV-2 Steckbrief zur Coronavirus-Krankheit-2019 (COVID-19), RKI, Stand 16. Oktober 2020, zuletzt abgerufen am 25. Oktober 2020
- ↑ Transmission of SARS-CoV-2: implications for infection prevention precautions, WHO Scientific Brief, 9. Juli 2020; zuletzt abgerufen am 4. Oktober 2020
- ↑ COVID-19-Pandemie: Aerosol-Forscher zu Corona: „Drinnen lauert die Gefahr“. In: Ärzte Zeitung. Springer Medizin Verlag GmbH, 4. Dezember 2021, abgerufen am 20. April 2021.
- ↑ a b Positionspapier der Gesellschaft für Aerosolforschung zum Verständnis der Rolle von Aerosolpartikeln beim SARS-CoV-2 Infektionsgeschehen. (PDF) Gesellschaft für Aerosolforschung (GAeF), 7. Dezember 2020, abgerufen am 20. April 2021.
- ↑ Patrick Hunziker: Minimizing exposure to respiratory droplets, ‘jet riders’ and aerosols in air-conditioned hospital rooms by a ‘Shield-and-Sink’ strategy. In: medRxiv. 16. Dezember 2020, S. 2020.12.08.20233056, doi:10.1101/2020.12.08.20233056 (medrxiv.org [abgerufen am 25. Dezember 2020]).
- ↑ Lydia Bouriba: Turbulent Gas Clouds and Respiratory Pathogen Emissions – Potential Implications for Reducing Transmission of COVID-19. In: JAMA. 26. März 2020, doi:10.1001/jama.2020.4756.
- ↑ Alexander Popa et al.: Genomic epidemiology of superspreading events in Austria reveals mutational dynamics and transmission properties of SARS-CoV-2. Science Translational Medicine 23 Nov 2020:eabe2555 doi:10.1126/scitranslmed.abe2555
- ↑ a b c Lirong Zou, Feng Ruan, Mingxing Huang et al.: SARS-CoV-2 Viral Load in Upper Respiratory Specimens of Infected Patients. In: The New England Journal of Medicine. 19. Februar 2020, doi:10.1056/NEJMc2001737 (englisch).
- ↑ Informationen der BAuA: Neuartiges Virus SARS-CoV-2 (bislang 2019-nCoV) durch den ABAS in Risikogruppe 3 eingestuft und Empfehlungen zur Labordiagnostik gegeben. In: Website der Bundesanstalt für Arbeitsschutz und Arbeitsmedizin (BAuA). 19. Februar 2020, abgerufen am 23. Februar 2020.
- ↑ a b c N. van Doremalen et al.: Aerosol and Surface Stability of SARS-CoV-2 as Compared with SARS-CoV-1. In: The New England Journal of Medicine 3-17. 17. März 2020, doi:10.1056/nejmc2004973 (englisch).
- ↑ Gabriel Birgand et al.: Assessment of Air Contamination by SARS-CoV-2 in Hospital Settings. JAMA Netw Open. 2020;3(12):e2033232. 23. Dezember 2020, doi:10.1001/jamanetworkopen.2020.33232
- ↑ Yunyun Zhou et al.: Ophthalmologic evidence against the interpersonal transmission of 2019 novel coronavirus through conjunctiva. In: Medrxiv. 12. Februar 2020, doi:10.1101/2020.02.11.20021956 (englisch).
- ↑ Wei Deng, Linlin Bao, Hong Gao et al.: Rhesus macaques can be effectively infected with SARS-CoV-2 via ocular conjunctival route. In: Biorxiv. 14. März 2020, doi:10.1101/2020.03.13.990036 (englisch).
- ↑ a b Roman Wölfel et al.: Virological assessment of hospitalized cases of coronavirus disease 2019. In: medRxiv. 9. März 2020, doi:10.1101/2020.03.05.20030502 (englisch).
- ↑ Christian Drosten et al.: An analysis of SARS-CoV-2 viral load by patient age. PDF (PDF) ist die erste Fassung, die 4. Fassung, aktuell ab 9. Juni 2020, ist: An analysis of SARS-CoV-2 viral load by patient age; zuletzt abgerufen am 13. Februar 2021
- ↑ Ong SWX, Tan YK, Chia PY, et al., JAMA online, 4. März 2020: [doi:10.1001/jama.2020.3227 Air, Surface Environmental, and Personal Protective Equipment Contamination by Severe Acute Respiratory Syndrome Coronavirus 2 (SARS-CoV-2) From a Symptomatic Patient.]
- ↑ FAQ des Bundesinstitutes für Risikobewertung (BfR), aktualisiert am 8. Juli 2020 (PDF)
- ↑ a b Günter Kampf, Daniel Todt, Stephanie Pfaender, Eike Steinmann: Persistence of coronaviruses on inanimate surfaces and its inactivation with biocidal agents. In: The Journal of Hospital Infection. 6. Februar 2020, doi:10.1016/j.jhin.2020.01.022 (englisch).
- ↑ Meike Drießen: Wie lang Coronaviren auf Flächen überleben und wie man sie inaktiviert. In: Internetseite des Informationsdienstes Wissenschaft (idw). 7. Februar 2020, abgerufen am 8. Februar 2020.
- ↑ ECDC: Coronavirus disease 2019 (COVID-19) pandemic: increased transmission in the EU/EEA and the UK – seventh update, 25. März 2020, zuletzt abgerufen am 19. April 2020
- ↑ News Release: New coronavirus stable for hours on surfaces – SARS-CoV-2-stability similar to original SARS virus. Pressemitteilung der NIH vom 19. März 2020
- ↑ Alex H. Chin et al.: Stability of SARS-CoV-2 in different environmental conditions. The Lancet Microbe, 2. April 2020, doi:10.1016/S2666-5247(20)30003-3
- ↑ Charleen Yeo, Sanghvi Kaushal, Danson Yeo: Enteric involvement of coronaviruses: is faecal–oral transmission of SARS-CoV-2 possible? In: The Lancet 19. Februar 2020 doi:10.1016/S2468-1253(20)30048-0
- ↑ W. Wang, Y. Xu, R. Gao et al.: Detection of SARS-CoV-2 in Different Types of Clinical Specimens. In: JAMA. online veröffentlicht, 11. März 2020, doi:10.1001/jama.2020.3786.
- ↑ F. Xiao, J. Sun, Y. Xu et al.: Infectious SARS-CoV-2 in feces of patient with severe COVID-19. In: Emerging Infectious Diseases. 18. Mai 2020 doi:10.3201/eid2608.200681
- ↑ Sandra Ciesek et al. : Detection of SARS-CoV-2 in raw and treated wastewater in Germany – Suitability for COVID-19 surveillance and potential transmission risks. Science of The Total Environment 18. Juli 2020, doi:10.1016/j.scitotenv.2020.141750
- ↑ A. J. Vivanti, C. Vauloup-Fellous, S. Prevot et al.: Transplacental transmission of SARS-CoV-2 infection. In: Nature Communications. Band 11, Nr. 3572, 2020, doi:10.1038/s41467-020-17436-6.
- ↑ Julide Sisman, Mambarambath A. Jaleel, Wilmer Jaleel, Veena Rajaram et al.: Intrauterine Transmission of SARS-COV-2 Infection in a Preterm Infant. In: The Pediatric Infectious Disease Journal. September 2020, Band 39, Heft 9, S. e265-e267, doi:10.1097/INF.0000000000002815.
- ↑ Robert Koch-Institut: SARS-CoV-2. Steckbrief zur Coronavirus-Krankheit-2019 (COVID-19) > Informationen aus internationalen Studien. 17. April 2020, abgerufen am 24. April 2020.
- ↑ a b Report of the WHO-China Joint Mission on Coronavirus Disease 2019 (COVID-19). (PDF; 1,6 MB) 16–24 February 2020. Weltgesundheitsorganisation (WHO), 28. Februar 2020, abgerufen am 2. März 2020.
- ↑ Hannah Peckhame et al.: Male sex identified by global COVID-19 meta-analysis as a risk factor for death and ITU admission. In: Nature Communications. Band 11, Nr. 1, 9. Dezember 2020, ISSN 2041-1723, S. 6317, doi:10.1038/s41467-020-19741-6 (nature.com [abgerufen am 7. Februar 2021]).
- ↑ Ärztezeitung über RKI-Analyse:COVID-19 kostet Deutsche über 300.000 Lebensjahre, veröffentlicht 15. Februar 2021, Originalarbeit am 12. Februar 2021 im Ärzteblatt: Alexander Rommel et al.: COVID-19-Krankheitslast in Deutschland im Jahr 2020 Durch Tod und Krankheit verlorene Lebensjahre im Verlauf der Pandemie
- ↑ SARS-CoV-2 Steckbrief zur Coronavirus-Krankheit-2019 (COVID-19), Robert Koch-Institut, Stand 18. September 2020, abgerufen am 28. September 2020
- ↑ Severe Outcomes Among Patients with Coronavirus Disease 2019 (COVID-19) — United States, February 12–March 16, 2020. In: Morbidity and Mortality Weekly Report. Band 69. Centers for Disease Control and Prevention, 18. März 2020, doi:10.15585/mmwr.mm6912e2 (englisch).
- ↑ Cernters for Disease Control and Prevention: COVID-19 Hospitalization and Death by Race/Ethnicity. U.S. Department of Health & Human Services, 18. August 2020, abgerufen am 11. Oktober 2020 (englisch).
- ↑ Beobachtungskohortenstudie „Ethnische Unterschiede bei SARS-CoV-2-Infektionen und COVID-19-bezogenen Krankenhausaufenthalten, Aufnahme auf der Intensivstation und Tod bei 17 Millionen Erwachsenen in England“
- ↑ Xiaoxia Lu et al.: SARS-CoV-2 Infection in Children. In: NEJM. 18. März 2020, doi:10.1056/NEJMc2005073.
- ↑ Daniel F. Gudbjartsson: Spread of SARS-CoV-2 in the Icelandic Population. In: NEJM. 14. April 2020, doi:10.1056/NEJMoa2006100.
- ↑ Yuanyuan Dong: Epidemiology of COVID-19 Among Children in China. In: Pediatrics. 1. April 2020, doi:10.1542/peds.2020-0702.
- ↑ Y. J. Park et al.: Contact tracing during coronavirus disease outbreak, South Korea, 2020. In: Emerging Infectious Diseases. Oktober 2020, doi:10.3201/eid2610.201315.
- ↑ Hugo Zeberg & Svante Pääbo: The major genetic risk factor for severe COVID-19 is inherited from Neanderthals. In: Nature. Nr. 587, 2020, S. 610–612 (nature.com).
- ↑ Deutscher Ärzteverlag GmbH, Redaktion Deutsches Ärzteblatt: Neandertaler-Gene erhöhen Risiko für schweren Coronaverlauf. 30. September 2020, abgerufen am 28. Februar 2021.
- ↑ M. Shkurnikov, et al.: Association of HLA Class I Genotypes With Severity of Coronavirus Disease-19. In: Frontiers in Immunology. Band 12, 23. Februar, 2021, Artikel: 641900, doi:10.3389/fimmu.2021.641900.
- ↑ PFAS exposure linked with worse COVID-19 outcomes. Harvard T.H. Chan School of Public Health, 5. Januar 2021, abgerufen am 4. Februar 2021 (amerikanisches Englisch).
- ↑ Philippe Grandjean, Clara Amalie Gade Timmermann, Marie Kruse, Flemming Nielsen, Pernille Just Vinholt: Severity of COVID-19 at elevated exposure to perfluorinated alkylates. In: PLOS ONE. Band 15, Nr. 12, 31. Dezember 2020, S. e0244815, doi:10.1371/journal.pone.0244815, PMID 33382826, PMC 7774856 (freier Volltext).
- ↑ RKI: Hierarchisierung von Risikofaktoren für schwere COVID-19-Erkrankungsverläufe im Kontext der COVID-19-SchutzimpfungenEine gepoolte GKV-Routinedatenanalyse basierend auf 30 Mio. Versicherten. In: Epidemiologisches Bulletin. Nr. 19/ 20211 vom 2. Mai 2021 (online vorab).
- ↑ a b c Q. Li, X. Guan, P. Wu et al.: Early Transmission Dynamics in Wuhan, China, of Novel Coronavirus–Infected Pneumonia. In: The New England Journal of Medicine. 29. Januar 2020, doi:10.1056/NEJMoa2001316 (englisch).
- ↑ Joseph T. Wu, Kathy Leung, Gabriel M. Leung: Nowcasting and forecasting the potential domestic and international spread of the 2019-nCoV outbreak originating in Wuhan, China: a modelling study. In: The Lancet. 31. Januar 2020, doi:10.1016/S0140-6736(20)30260-9 (englisch).
- ↑ Sheng Zhang et al.: (COVID-19) and the probable outbreak size on the Diamond Princess cruise ship: A data-driven analysis. In: International Journal of Infectious Diseases. 22. Februar 2020, doi:10.1016/j.ijid.2020.02.033.
- ↑ Tao Liu, Jianxiong Hu, Jianpeng Xiao et al.: Time-varying transmission dynamics of Novel Coronavirus Pneumonia in China. In: bioRxiv. 13. Februar 2020, doi:10.1101/2020.01.25.919787 (englisch).
- ↑ Ying Liu, Albert A. Gayle, Annelies Wilder-Smith, Joacim Rocklöv: The reproductive number of COVID-19 is higher compared to SARS coronavirus. In: Journal of Travel Medicine. 13. Februar 2020, S. taaa021, doi:10.1093/jtm/taaa021 (englisch).
- ↑ S. Sanche, V. T. Lin, C. Xu et al.: High Contagiousness and Rapid Spread of Severe Acute Respiratory Syndrome Coronavirus 2. In: Emerging Infectious Diseases. Band 26, Nr. 7, 2020, doi:10.3201/eid2607.200282 (englisch, Early Release).
- ↑ COVID-19 twice as contagious as previously thought – CDC study. thinkpol.ca, 8. April 2020, abgerufen am 9. April 2020.
- ↑ Ye Shen, Wenjie Xu, Changwei Li et al.: A Cluster of COVID-19 Infections Indicating Person-To-Person Transmission among Casual Contacts from Social Gatherings: An Outbreak Case-Contact Investigation. 28. März 2020, SSRN: doi:10.2139/ssrn.3563064.
- ↑ Luca Ferretti, Christophe Fraser et al.: Quantifying Sars-Cov-2 transmission suggests epidemic control with digital contact tracing. In: Science. vom 31. März 2020.
- ↑ Akira Endo, Adam Kucharski, Sebastian Funk u. a.: Estimating the overdispersion in COVID-19 transmission using outbreak sizes outside China, Wellcome Open Research, 2020.
- ↑ Julien Riou, Christian L. Althaus: Pattern of early human-to-human transmission of Wuhan 2019 novel coronavirus (2019-nCoV), December 2019 to January 2020. In: Eurosurveillance. 25. Jahrgang, Nr. 4, 2020, doi:10.2807/1560-7917.ES.2020.25.4.2000058, PMID 32019669, PMC 7001239 (freier Volltext).
- ↑ a b Bjarke Frost Nielsen, Kim Sneppen: COVID-19 superspreading suggests mitigation by social network modulation. medRxiv (2020).
- ↑ Kai Kupferschmidt: „Why do some COVID-19 patients infect many others, whereas most don’t spread the virus at all?“, Science, 19. Mai 2020
- ↑ Dillon Adam, et al.: Clustering and superspreading potential of severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2) infections in Hong Kong. (2020).
- ↑ RKI: 10. Inkubationszeit und serielles Intervall RKI SARS-CoV-2 Steckbrief zur Coronavirus-Krankheit-2019 (COVID-19), Stand 7. August 2020.
- ↑ Coronavirus disease 2019 (COVID-19). (PDF; 1,1 MB) Situation Report – 30. Weltgesundheitsorganisation (WHO), 19. Februar 2020, abgerufen am 23. Februar 2020.
- ↑ Eunjung Lee et al.: Clinical Course and Molecular Viral Shedding Among Asymptomatic and Symptomatic Patients With SARS-CoV-2 Infection in a Community Treatment Center in the Republic of Korea. In: JAMA, 6. August 2020, doi:10.1001/jamainternmed.2020.3862.
- ↑ Camilla Rothe, Mirjam Schunk, Peter Sothmann et al.: Transmission of 2019-nCoV Infection from an Asymptomatic Contact in Germany. In: The New England Journal of Medicine. 30. Januar 2020, doi:10.1056/NEJMc2001468 (englisch).
- ↑ Sandra Ciesek et al.: Evidence of SARS-CoV-2 Infection in Returning Travelers from Wuhan, China. In: The New England Journal of Medicine. 18. Februar 2018, doi:10.1056/NEJMc2001899.
- ↑ Jing Liu: Asymptomatic cases in a family cluster with SARS-CoV-2 infection. In: Lancet. 19. Februar 2020, doi:10.1016/S1473-3099(20)30114-6.
- ↑ 2019-nCoV offenbar schon bei sehr leichten Symptomen übertragbar. In: Website Deutsches Ärzteblatt. 4. Februar 2020, abgerufen am 5. Februar 2020.
- ↑ Lars Fischer, Alina Schadwinkel: Verursacht das Coronavirus Engpässe bei Medikamenten? Stammt das Virus aus dem Pangolin? Website Spektrum.de, 10. Februar 2020, abgerufen am 15. Februar 2020.
- ↑ a b c d e Antworten auf häufig gestellte Fragen zum Coronavirus SARS-CoV-2. In: Website des Robert Koch-Instituts. 26. März 2020, abgerufen am 27. März 2020.
- ↑ Yan Bai, Lingsheng Yao, Tao Wei et al.: Presumed Asymptomatic Carrier Transmission of COVID-19. In: Journal of the American Medical Association. 21. Februar 2020, doi:10.1001/jama.2020.2565 (englisch).
- ↑ Z: Hu, C. Song, C. Xu et al.: Clinical characteristics of 24 asymptomatic infections with COVID-19 screened among close contacts in Nanjing, China. In: Science China Life Sciences. (Sci. China Life Sci.) Band 63, 2020, S. 706–711 (doi:10.1007/s11427-020-1661-4).
- ↑ J. Liu, J. Huang, D. Xiang: Large SARS-CoV-2 outbreak caused by asymptomatic traveler. China. In: Emerging Infectious Diseases, (Emerg Infect Dis.) September 2020, doi:10.3201/eid2609.201798.
- ↑ a b F. Zhou et al.: Clinical course and risk factors for mortality of adult inpatients with COVID-19 in Wuhan, China: a retrospective cohort study., In: Lancet. 9. März 2020, doi:10.1016/S0140-6736(20)30566-3.
- ↑ Tapiwa Ganyani et al.: Estimating the generation interval for COVID-19 based on symptom onset data. In: medRxiv. 8. März 2020, doi:10.1101/2020.03.05.20031815
- ↑ a b 2019-nCoV: Erste Bilder vom Virus und Erkenntnisse zum klinischen Verlauf. In: Website Deutsches Ärzteblatt. 27. Januar 2020, abgerufen am 11. Februar 2020.
- ↑ Xi He, Gabriel Leung u. a.: Temporal dynamics in viral shedding and transmissibility of COVID-19. In: Nature Medicine. 15. April 2020.
- ↑ Coronavirus-Infizierte früher ansteckend als gedacht. Im: Bayerischer Rundfunk. 18. August 2020.
- ↑ Peter Ashcroft, Jana S. Huisman, Sonja Lehtinen, Judith A. Bouman, Christian L. Althaus, Roland Regoes, Sebastian Bonhoeffer: COVID-19 infectivity profile correction. In: Swiss Medical Weekly. 5. August 2020, Band 150, Artikel: w20336 (Online).
- ↑ Liang Peng et al.: Recurrence of positive SARS-CoV-2 RNA in COVID-19: A case report. In: International Journal of Infectious Diseases. Band 93, April 2020, S. 297–299, doi:10.1016/j.ijid.2020.03.003.
- ↑ C. Chen, G. Gao, Y. Xu et al.: SARS-CoV-2–Positive Sputum and Feces After Conversion of Pharyngeal Samples in Patients With COVID-19. In: Annals of Internal Medicine . (Ann Intern Med.) 30. März 2020, doi:10.7326/M20-0991.
- ↑ Hiroshi Nishiura, Natalie Linton, Andrei Akhmetzhanov: Serial interval of novel 1 coronavirus (COVID-19) infections. Preprint, 2020, medRxive, doi:10.1101/2020.02.03.20019497, abgerufen am 25. März 2020.
- ↑ Zhanwei Du, Lin Wang, Lauren Meyers u. a.: The serial interval of COVID-19 from publicly reported confirmed cases. Preprint, CDC Emergent Effective Diseases Research Letter 2020 (CDC, Abstract abgerufen am 25. März 2020).
- ↑ Schätzung des seriellen Intervalles von COVID-19, Österreich, Abbildung 1, 9. April 2020, AGES, TU Graz.
- ↑ a b Peng Zhou, Xing-Lou Yang, Xian-Guang Wang et al.: A pneumonia outbreak associated with a new coronavirus of probable bat origin. In: Nature. 3. Februar 2020, doi:10.1038/s41586-020-2012-7 (englisch, dieser Artikel wurde am 23. Januar 2020 vorab ohne Peer-Review auf bioRxiv veröffentlicht).
- ↑ Markus Hoffmann, Hannah Kleine-Weber, Simon Schroeder, Christian Drosten, Stefan Pöhlmann et al.: SARS-CoV-2 Cell Entry Depends on ACE2 and TMPRSS2 and Is Blocked by a Clinically Proven Protease Inhibitor. In: Cell. 4. März 2020, doi:10.1016/j.cell.2020.02.052 (englisch).
- ↑ Sungnak, W., Huang, N., Bécavin, C. et al.: SARS-CoV-2 entry factors are highly expressed in nasal epithelial cells together with innate immune genes. Nature Medicine (2020). doi:10.1038/s41591-020-0868-6
- ↑ Carly G. K. Ziegler et al.: „SARS-CoV-2 receptor ACE2 is an interferon-stimulated gene in human airway epithelial cells and is detected in specific cell subsets across tissues“, cell, doi:10.1016/j.cell.2020.04.035
- ↑ a b Yu Zhao, Zixian Zhao, Yujia Wang, Yueqing Zhou, Yu Ma, Wei Zuo: Single-cell RNA expression profiling of ACE2, the putative receptor of Wuhan 2019-nCov. In: BioRxiv. 26. Januar 2020, doi:10.1101/2020.01.26.919985 (englisch).
- ↑ a b Haibo Zhang, Josef M. Penninger, Yimin Li, Nanshan Zhong & Arthur S. Slutsky: Angiotensin‑converting enzyme 2 (ACE2) as a SARS‑CoV‑2 receptor: molecular mechanisms and potential therapeutic target. In: Intensive Care Medicine. 3. März 2020, doi:10.1007/s00134-020-05985-9 (englisch).
- ↑ Daniel Lingenhöhl: Enzym lässt Männer häufiger und schwerer erkranken. In: Spektrum. 11. Mai 2020, abgerufen am 14. Mai 2020.
- ↑ Soeren Lukassen, Robert Lorenz et al.: SARS‐CoV‐2 receptor ACE2 and TMPRSS2 are primarily expressed in bronchial transient secretory cells. In: EMBO J. 14. April 2020, doi:10.15252/embj.20105114 (englisch).
- ↑ Hans Clevers et al.: SARS-CoV-2 productively infects human gut enterocytes. Science, 1. Mai 2020 doi:10.1126/science.abc1669
- ↑ Peter K. Jackson et al.: SARS-CoV-2 infects human pancreatic β-cells and elicits β-cell impairment. Cell Metabolism, 18. Mai 2021 doi:10.1016/j.cmet.2021.05.013
- ↑ Bin Cao et al.: SARS-CoV-2 and viral sepsis: observations and hypotheses. Lancet, 17. April 2020, doi:10.1016/S0140-6736(20)30920-X
- ↑ Felix K.F. Kommoss : Pathologie der schweren COVID-19 bedingten Lungenschädigun – Hinweise auf Mechanismen und therapeutrische Ansätze. Dtsch Arztebl Int 2020; 117: 500–6. doi:10.3238/arztebl.2020.0500
- ↑ Meinhardt, J., Radke, J., Dittmayer, C. et al. Olfactory transmucosal SARS-CoV-2 invasion as a port of central nervous system entry in individuals with COVID-19. Nat Neurosci (2020). doi:10.1038/s41593-020-00758-5
- ↑ Gianpaolo Toscano et al.:Guillain–Barré Syndrome Associated with SARS-CoV-2. NEJM, 17. April 2020, doi:10.1056/NEJMc2009191
- ↑ Takeshi Moriguchi et al.: A first case of meningitis/encephalitis associated with SARS-Coronavirus-2. In: International Journal of Infectious Diseases (IJID). Band 94, 25. März 2020, S. 55–58, doi:10.1016/j.ijid.2020.03.062 (englisch).
- ↑ DGN: AWMF LL 030/144 Neurologische Manifestationen bei COVID-19, Deutsche Gesellschaft für Neurologie, Stand 18. August 2020
- ↑ Luciano Gattinoni et al.: COVID-19 pneumonia: different respiratory treatments for different phenotypes? Intensive Care Medicine, 14. April 2020, doi:10.1007/s00134-020-06033-2
- ↑ a b Positionspapier zur praktischen Umsetzung der apparativen Differenzialtherapie der akuten respiratorischen Insuffizienz bei COVID-19. (PDF) In: Website DGP. 17. April 2020, abgerufen am 17. April 2020.
- ↑ John J. Marini, Luciano Gattinoni: Management of COVID-19 Respiratory Distress. In: JAMA. Band 22, Nr. 323, 22. April 2020, S. 2329–2330, doi:10.1001/jama.2020.6825 (englisch).
- ↑ Copin, M., Parmentier, E., Duburcq, T. et al. Time to consider histologic pattern of lung injury to treat critically ill patients with COVID-19 infection. Intensive Care Med, 23. April 2020 doi:10.1007/s00134-020-06057-8
- ↑ Danny Jonigk et al.: Pulmonary Vascular Endothelialitis, Thrombosis, and Angiogenesis in Covid-19. NEJM, 21. Mai 2020, doi:10.1056/NEJMoa2015432.
- ↑ Hui Li, Bin Cao et al.: SARS-CoV-2 and viral sepsis: observations and hypotheses. Lancet, 17. April 2020, doi:10.1016/S0140-6736(20)30920-X
- ↑ Christian R. Schulze-Florey et al. : Reappearance of effector T cells is associated with recovery from COVID-19. EBioMedicine, Volume 57, July 2020, 102885, doi:10.1016/j.ebiom.2020.102885
- ↑ Galit Alter et al. : Distinct early serological signatures track with SARS-CoV-2 survival. Immunity, 23. Juli 2020, doi:10.1016/j.immuni.2020.07.020.
- ↑ S. Eguchi, T. Kawai, R. Scalia, V. Rizzo: Understanding Angiotensin II Type 1 Receptor Signaling in Vascular Pathophysiology. In: Hypertension. Band 71, Nummer 5, 05 2018, S. 804–810, doi:10.1161/HYPERTENSIONAHA.118.10266, PMID 29581215, PMC 5897153 (freier Volltext) (Review).
- ↑ a b M. Murakami, D. Kamimura, T. Hirano: Pleiotropy and Specificity: Insights from the Interleukin 6 Family of Cytokines. In: Immunity. Band 50, Nummer 4, 04 2019, S. 812–831, doi:10.1016/j.immuni.2019.03.027, PMID 30995501 (Review).
- ↑ Toshio Hirano, Masaaki Murakami: COVID-19: A New Virus, but a Familiar Receptor and Cytokine Release Syndrome, Cell, 22. April 2020, doi:10.1016/j.immuni.2020.04.003
- ↑ Daniel E. Leisman et al.: Cytokine elevation in severe and critical COVID-19: a rapid systematic review, meta-analysis, and comparison with other inflammatory syndromes. Landet Resp Med, 16. Oktober 2020, doi:10.1016/S2213-2600(20)30404-5
- ↑ Blanco-Melo D, Nilsson-Payant BE, Liu WC, et al. Imbalanced Host Response to SARS-CoV-2 Drives Development of COVID-19. Cell. 2020;181(5):1036-1045.e9. doi:10.1016/j.cell.2020.04.026
- ↑ Jiang, H., Zhang, H., Meng, Q. et al. SARS-CoV-2 Orf9b suppresses type I interferon responses by targeting TOM70. Cell Mol Immunol (2020). doi:10.1038/s41423-020-0514-8.
- ↑ Jean Laurent Casanova et al. : Inborn errors of type I IFN immunity in patients with life-threatening COVID-19. Science, 23. Oktober, 2020, doi:10.1126/science.abd4570
- ↑ Shaobo Shi, Mu Qin, Bo Shen et al.: Association of Cardiac Injury With Mortality in Hospitalized Patients With COVID-19 in Wuhan, China. In: JAMA Cardiology. 25. März 2020, doi:10.1001/jamacardio.2020.0950 (englisch).
- ↑ Riccardo M. Inciardi et al.: Cardiac Involvement in a Patient With Coronavirus Disease 2019 (COVID-19). JAMA Cardiol, 27. März 2020, doi:10.1001/jamacardio.2020.1096.
- ↑ Robinson et al.: „Genes encoding ACE2, TMPRSS2 and related proteins mediating SARS-CoV-2 viral entry are upregulated with age in human cardiomyocytes“, JMCC, 17. August 2020, doi:10.1016/j.yjmcc.2020.08.009
- ↑ Wenzel et al: „Evidence of SARS-CoV-2 mRNA in endomyocardial biopsies of patients with clinically suspected myocarditis tested negative for COVID-19 in nasopharyngeal swab“, Cardiovascular Research, 20. Juni 2020, doi:10.1093/cvr/cvaa160
- ↑ Wenzel et al. :„Detection of viral SARS‐CoV‐2 genomes and histopathological changes in endomyocardial biopsies“, ESC Heart Failure, 12. Juni 2020, doi:10.1002/ehf2.12805
- ↑ Yongwen Chen et al.: Human Kidney is a Target for Novel Severe Acute Respiratory Syndrome Coronavirus 2 (SARS-CoV-2) Infection. medRxiv, 10. April 2020, doi:10.1101/2020.03.04.20031120
- ↑ Royal College of Paediatrics and Child Health: Guidance: „Paediatric multisystem inflammatory syndrome temporally associated with COVID-19“ (Volltext, PDF) In: Webseite RCPCH (englisch)
- ↑ Jones VG, Mills M, Suarez D, et al. „COVID-19 and Kawasaki disease: novel virus and novel case“. Hosp Pediatr. 2020; doi:10.1542/hpeds.2020-0123
- ↑ Multisystem inflammatory syndrome in children and adolescents with COVID-19. In: Scientific brief, who.int. WHO, 15. Mai 2020, abgerufen am 17. Mai 2020 (englisch).
- ↑ A. Randolph et al.: „Multisystem Inflammatory Syndrome in U.S. Children and Adolescents“; NEJM, 29. Juni 2020; doi:10.1056/NEJMoa2021680
- ↑ a b Menni, C., Valdes, A.M., Freidin, M.B. et al.: Real-time tracking of self-reported symptoms to predict potential COVID-19. Nat Med 26, S. 1037–1040, 11. Mai 2020, doi:10.1038/s41591-020-0916-2.
- ↑ Claire Hopkins: Loss of sense of smell as marker of COVID-19 infection. In: Ear, Nose and Throat surgery body of United Kingdom. Abgerufen am 28. März 2020.
- ↑ Gareth Iacobucci: Sixty seconds on … anosmia. In: BMJ. Band 368, 2020, ISSN 1756-1833, S. m1202, doi:10.1136/bmj.m1202, PMID 32209546.
- ↑ a b CH Yan et al.: Association of chemosensory dysfunction and Covid-19 in patients presenting with influenza-like symptoms. In: International Forum of Allergy & Rhinology. (Int Forum Allergy Rhinol.) 12. April 2020, doi:10.1002/alr.22579.
- ↑ Neues Coronavirus – Informationen für die hausärztliche Praxis. DEGAM S1-Handlungsempfehlung. AWMF-Register-Nr. 053-054. Deutsche Gesellschaft für Allgemeinmedizin und Familienmedizin e. V., 23. September 2020 (degam.de [PDF; abgerufen am 20. Oktober 2020]).
- ↑ Jasper Fuk-Woo Chan, Shuofeng Yuan, Kin-Hang Kok et al.: A familial cluster of pneumonia associated with the 2019 novel coronavirus indicating person-to-person transmission: a study of a family cluster. In: The Lancet. 24. Januar 2020, doi:10.1016/S0140-6736(20)30154-9 (englisch).
- ↑ a b C. Huang, Y. Wang, X. Li et al.: Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. In: The Lancet. 24. Januar 2020, doi:10.1016/S0140-6736(20)30183-5 (englisch).
- ↑ Mengfei Chen et al.: Elevated ACE2 expression in the olfactory neuroepithelium: implications for anosmia and upper respiratory SARS-CoV-2 entry and replication. In: European Respiratory Journal. 18. August 2020, doi:10.1183/13993003.01948-2020.
- ↑ a b Tedros Adhanom Ghebreyesus: WHO Director-General’s opening remarks at the media briefing on COVID-19 – 24 February 2020. Weltgesundheitsorganisation (WHO), 24. Februar 2020, abgerufen am 14. August 2020 (englisch).
- ↑ Nanshan Chen, Min Zhou, Xuan Dong et al.: Epidemiological and clinical characteristics of 99 cases of 2019 novel coronavirus pneumonia in Wuhan, China: a descriptive study. In: The Lancet. 30. Januar 2020, doi:10.1016/S0140-6736(20)30211-7.
- ↑ Jennifer Couzin-Frankel: The mystery of the pandemic's ‘happy hypoxia’. In: Science. 1. Mai 2020, doi:10.1126/science.368.6490.455.
- ↑ L. Meng et al.: Intubation and Ventilation amid the COVID-19 Outbreak: Wuhan's Experience. In: Anesthesiology. 26. März 2020, PMID 32195705.
- ↑ J. F. Bermejo-Martin, R. Almansa u. a.: Lymphopenic community acquired pneumonia as signature of severe COVID-19 infection. In: The Journal of Infection. [elektronische Veröffentlichung vor dem Druck] März 2020, doi:10.1016/j.jinf.2020.02.029, PMID 32145214.
- ↑ Janne Kieselbach: Coronavirus: Trifft es Männer härter? Abgerufen am 31. März 2020.
- ↑ Katarina Zimmer: Why Some COVID-19 Cases Are Worse than Others. In: the-scientist.com. 24. Februar 2020, abgerufen am 22. März 2020 (englisch).
- ↑ P. Mehta, D. F. McAuley u. a.: COVID-19: consider cytokine storm syndromes and immunosuppression. In: The Lancet. [elektronische Veröffentlichung vor dem Druck] März 2020, doi:10.1016/S0140-6736(20)30628-0, PMID 32192578.
- ↑ Kluge, S., Janssens, U., Welte, T. et al. Empfehlungen zur intensivmedizinischen Therapie von Patienten mit COVID-19 – 3. Version. Anaesthesist 69, 653–664 (2020). doi:10.1007/s00101-020-00833-3
- ↑ Sven Siebenand: Diagnosestellung: Lymphopenie als Marker für schweren Verlauf von Covid-19. In: pharmazeutische-zeitung.de. 16. März 2020, abgerufen am 22. März 2020.
- ↑ M. Dreher, A. Kersten et al.: The characteristics of 50 hospitalized COVID-19 patients with and without ARDS. In: Deutsches Ärzteblatt international. 1. April 2020, abgerufen am 4. April 2020.
- ↑ SARS-CoV-2 Steckbrief zur Coronavirus-Krankheit-2019 (COVID-19) Abschnitt:16. Schwangere, Kinder und Jugendliche. In: rki. 4. September 2020, abgerufen am 22. September 2020.
- ↑ a b c d e Falldefinition Coronavirus-Krankheit-2019 (COVID-19). (PDF; 82 kB) In: Website des Robert Koch-Instituts. 29. Mai 2020, abgerufen am 19. Juni 2020.
- ↑ a b c d e f g COVID-19 Verdacht: Maßnahmen und Testkriterien – Orientierungshilfe für Ärztinnen und Ärzte. (PDF; 106 kB) In: Website des Robert Koch-Instituts. 6. April 2020, abgerufen am 13. April 2020.
- ↑ COVID-19: Bin ich betroffen und was ist zu tun? Orientierungshilfe für Bürgerinnen und Bürger. (PDF) In: rki.de. Robert Koch-Institut, 9. April 2020, abgerufen am 13. April 2020.
- ↑ Victor M Corman, Olfert Landt, Marco Kaiser, Richard Molenkamp, Adam Meijer: Detection of 2019 novel coronavirus (2019-nCoV) by real-time RT-PCR. In: Eurosurveillance. Band 25, Nr. 3, 23. Januar 2020, ISSN 1560-7917, doi:10.2807/1560-7917.ES.2020.25.3.2000045, PMID 31992387, PMC 6988269 (freier Volltext) – (eurosurveillance.org [abgerufen am 15. Mai 2020]).
- ↑ a b c d e Laboratory testing for 2019 novel coronavirus (2019-nCoV) in suspected human cases. In: Website WHO. Weltgesundheitsorganisation (WHO), 19. März 2020, abgerufen am 26. März 2020 (englisch).
- ↑ Roman Wölfel, Victor M. Corman, Wolfgang Guggemos, Michael Seilmaier, Sabine Zange: Virological assessment of hospitalized patients with COVID-2019. In: Nature. 1. April 2020, ISSN 1476-4687, S. 1–10, doi:10.1038/s41586-020-2196-x (nature.com [abgerufen am 5. April 2020]).
- ↑ Diese Institute bieten den SARS-CoV-2 PCR Test an. In: Website Gesellschaft für Virologie e. V. (GfV). Abgerufen am 13. April 2020.
- ↑ a b c Jaffar Al-Tawfiq, Ziad A. Memish: Diagnosis of SARS-CoV-2 Infection based on CT scan vs. RT-PCR: Reflecting on Experience from MERS-CoV. In: The Journal of Hospital Infection. 5. März 2020, doi:10.1016/j.jhin.2020.03.001 (englisch).
- ↑ a b Global Surveillance for human infection with coronavirus disease (COVID-19). Weltgesundheitsorganisation (WHO), 20. März 2020, abgerufen am 13. April 2020 (englisch).
- ↑ RKI - Coronavirus SARS-CoV-2 - Falldefinition Coronavirus Disease 2019 (COVID-19) (SARS-CoV-2), Stand: 23.12.2020. Abgerufen am 24. April 2021.
- ↑ Corona: Mehr als 70.000 Todesfälle in Deutschland. In: Deutsches Ärzteblatt. Hrsg.: Bundesärztekammer und Kassenärztliche Bundesvereinigung, 1. März 2021, abgerufen am 4. März 2021.
- ↑ RKI: SARS-CoV-2 Steckbrief zur Coronavirus-Krankheit-2019 (COVID-19), Stand 21. August 2020, Abruf 30. August 2020
- ↑ RKI: Hinweise zur Testung von Patienten auf Infektion mit dem neuartigen Coronavirus SARS-CoV-2, Stand 11. August 2020, Abruf 30. August 2020
- ↑ RKI: zeitliche Verhältnisse von Transmission – Latenz – Inkubation – PCR-Nachweis – Infektiosität – AK-Nachweis bei SARS-CoV-2, 3. Juli 2020, Abruf 30. August 2020, Grafik PNG
- ↑ COVID-19: Entlassungskriterien aus der Isolierung – In Abstimmung mit der Arbeitsgruppe Infektionsschutz der AOLG, zuletzt abgerufen am 15. Oktober 2020
- ↑ SARS-Coronavirus-2 PCR: Wie aussagekräftig ist der Ct-Wert? In: LADR. Abgerufen am 27. Januar 2021.
- ↑ Wenling Wang, Yanli Xu, Ruqin Gao et al.: Detection of SARS-CoV-2 in Different Types of Clinical Specimens. In: JAMA. 11. März 2020, doi:10.1001/jama.2020.3786 (englisch).
- ↑ Chest CT may be considered as a primary tool for the current COVID-19 detection in epidemic areas(…) Chest CT had higher sensitivity for diagnosis of COVID-19 as compared with initial reverse-transcription polymerase chain reaction from swab samples in the epidemic area of China. / Tao Ai, Zenlu Yang, Hongyan Hu, Chenao Zhan, Chong Chen, Wenzhi Lv, Qian Tao, Ziyong Sun, Liming Xia: Correlation of Chest CT and RT-PCR Testing in Coronavirus Disease 2019 (COVID-19) in China: A Report of 1014 Cases.; Radiology 26. Februar 2020, doi:10.1148/radiol.2020200642
- ↑ Hinweise zur Testung von Patienten auf Infektion mit dem neuartigen Coronavirus SARS-CoV-2. In: Website des Robert Koch-Instituts (RKI). 21. März 2020, abgerufen am 26. März 2020.
- ↑ Anja Martini, Christian Drosten: Coronavirus-Update. (PDF; 136 kB) Folge 22. In: ndr.de. Norddeutscher Rundfunk, 26. März 2020, S. 1–8, abgerufen am 27. März 2020.
- ↑ Lauren M. Kucirka: Variation in False-Negative Rate of Reverse Transcriptase Polymerase Chain Reaction–Based SARS-CoV-2 Tests by Time Since Exposure. Annals of Internal Medicine, 18. August 2020, doi:10.7326/M20-1495
- ↑ CDC Tests for 2019-nCoV. In: Website der US-amerikanischen Centers for Disease Control and Prevention (CDC). 5. Februar 2020, abgerufen am 10. Februar 2020 (englisch).
- ↑ Ria Lassaunière, Anders Frische, Zitta B. Harboe, Alex C. Y. Nielsen, Anders Fomsgaard, Karen A. Krogfelt, Charlotte S. Jørgensen: Evaluation of nine commercial SARS-CoV-2 immunoassays. In: MedRxiv. 10. April 2020, doi:10.1101/2020.04.09.20056325.
- ↑ a b c RKI – Coronavirus SARS-CoV-2 – Hinweise zur Testung von Patienten auf Infektion mit dem neuartigen Coronavirus SARS-CoV-2. Abgerufen am 10. Dezember 2020.
- ↑ a b Victor M. Corman, Verena Claudia Haage, Tobias Bleicker, Marie Luisa Schmidt, Barbara Mühlemann: Comparison of seven commercial SARS-CoV-2 rapid Point-of-Care Antigen tests. In: medRxiv. 13. November 2020, S. 2020.11.12.20230292, doi:10.1101/2020.11.12.20230292 (medrxiv.org [abgerufen am 10. Dezember 2020]).
- ↑ Beitrag des WDR vom 21. April 2021
- ↑ Heshui Shi, Xiaoyu Han, Nanchuan Jiang, Yukun Cao, Osamah Alwalid, Jin Gu, Yanqing Fan, Chuansheng Zheng: Radiological findings from 81 patients with COVID-19 pneumonia in Wuhan, China: a descriptive study. In: The Lancet Infectious Diseases. 24. Februar 2020, doi:10.1016/S1473-3099(20)30086-4 (englisch).
- ↑ a b Jinnong Zhang, Luqian Zhou, Yuqiong Yang, Wei Peng, Wenjing Wang, Xuelin Chen: Therapeutic and triage strategies for 2019 novel coronavirus disease in fever clinics. In: The Lancet Respiratory Medicine. 13. Februar 2020, doi:10.1016/S2213-2600(20)30071-0 (englisch).
- ↑ Yi Huang, Sihan Wang, Yue Liu, Yaohui Zhang, Chuyun Zheng, Yu Zheng, Chaoyang Zhang, Weili Min, Huihui Zhou, Ming Yu, Mingjun Hu: A Preliminary Study on the Ultrasonic Manifestations of Peripulmonary Lesions of Non-Critical Novel Coronavirus Pneumonia (COVID-19). In: SSRN. 28. Februar 2020, doi:10.2139/ssrn.3544750 (englisch).
- ↑ Xingzhi Xie, Zheng Zhong, Wei Zhao, Chao Zheng, Fei Wang, Jun Liu: Chest CT for Typical 2019-nCoV Pneumonia: Relationship to Negative RT-PCR Testing. In: Radiology. 12. Februar 2020, S. 1–11, doi:10.1148/radiol.2020200343 (englisch).
- ↑ ACTT-1 Study Group Members: Remdesivir for the Treatment of Covid-19 — Preliminary Report. In: NEJM. doi:10.1056/NEJMoa2007764.
- ↑ EMA-Factsheet Veklury, zuletzt abgerufen am 3. August 2020.
- ↑ a b c Stefan Kluge: S3-Leitlinie: Empfehlungen zur stationären Therapie von Patienten mit COVID-19. 23. Februar 2021, zuletzt abgerufen am 26. März 2021.
- ↑ a b Chalmers JD, Crichton ML, Goeminne PC, et al. Management of hospitalised adults with coronavirus disease-19 (COVID-19): A European Respiratory Society living guideline. Eur Respir J 2021; in press doi:10.1183/13993003.00048-2021.
- ↑ RECOVERY (Randomised Evaluation of COVid-19 thERapY)
- ↑ RECOVERY Collaborative Group: Effect of Dexamethasone in Hospitalized Patients with COVID-19: Preliminary Report. In: NEJM. 17. Juli 2020, doi:10.1056/NEJMoa2021436.
- ↑ Waleed Alhazzani et al.: Surviving Sepsis Campaign: Guidelines on the Management of Critically Ill Adults with Coronavirus Disease 2019 (COVID-19). In: Critical Care Medicine. 21. April 2020, PMID 32224769.
- ↑ DGP: Therapie mit Dexamethason bei Patienten mit COVID-19. (PDF) Positionspapier DGP (Deutsche Gesellschaft f. Pneumologie), 28. Juli 2020, abgerufen am 7. August 2020.
- ↑ Seda Bilaloglu et al.: Thrombosis in Hospitalized Patients With COVID-19 in a New York City Health System. In: JAMA. Band 324, Nr. 8, 25. August 2020, S. 799, doi:10.1001/jama.2020.13372.
- ↑ a b c d e f g Fachgruppe COVRIIN am Robert Koch-Institut: Medikamentöse Therapie bei COVID-19 mit Bewertung durch die Fachgruppe COVRIIN am Robert Koch-Institut. 5. Februar 2021, abgerufen am 21. Februar 2021.
- ↑ Manli Wang, Ruiyuan Cao, Leike Zhang, Xinglou Yang, Jia Liu, Mingyue Xu, Zhengli Shi, Zhihong Hu, Wu Zhong, Gengfu Xiao: Remdesivir and chloroquine effectively inhibit the recently emerged novel coronavirus (2019-nCoV) in vitro. Letter to the Editor. In: Cell Research. Band 30, 4. Februar 2020, doi:10.1038/s41422-020-0282-0.
- ↑ Mitteilung der WHO, zuletzt abgerufen am 19. Juni 2020
- ↑ Mitteilung der FDA vom 15. Juni 2020, zuletzt abgerufen am 19. Juni 2020
- ↑ P. Maisonnasse, J. Guedj, V. Contreras et al.: Hydroxychloroquine use against SARS-CoV-2 infection in non-human primates. In: Nature. 2020, doi:10.1038/s41586-020-2558-4.
- ↑ M. Hoffmann, K. Mösbauer, H. Hofmann-Winkler et al.: Chloroquine does not inhibit infection of human lung cells with SARS-CoV-2. In: Nature. 2020, doi:10.1038/s41586-020-2575-3.
- ↑ Hongchao Pan, Richard Peto, Quarraisha Abdool Karim, Marissa Alejandria, Ana Maria Henao Restrepo, Cesar Hernandez Garcia, Marie Paule Kieny, Reza Malekzadeh, Srinivas Murthy, Marie-Pierre Preziosi, Srinath Reddy, Mirta Roses, Vasee Sathiyamoorthy, John-Arne Rottingen, Soumya Swaminathan: Repurposed antiviral drugs for COVID-19; interim WHO SOLIDARITY trial results. Weltgesundheitsorganisation, 15. Oktober 2020, abgerufen am 15. Oktober 2020.
- ↑ Repurposed antiviral drugs for COVID-19–interim WHO SOLIDARITY trial results. (PDF) In: medrxiv.org. WHO Solidarity trial consortium, 15. Oktober 2020, S. 2 f., 9 15, abgerufen am 17. Oktober 2020 (englisch, Preprint).
- ↑ The RECOVERY Collaborative Group: Effect of Hydroxychloroquine in Hospitalized Patients with Covid-19. In: The New England Journal of Medicine. Nr. 383, 19. November 2020, S. 2030–2040, doi:10.1056/NEJMoa2022926 (online).
- ↑ RoActemra – tocilizumab Committee for Medicinal Products for Human Use (CHMP), vom 28. Juni 2018
- ↑ Coronavirus (COVID-19) Update: FDA Authorizes Monoclonal Antibody for Treatment of COVID-19. U.S. Food and Drrug Administration (FDA), 9. November 2020, abgerufen am 11. November 2020.
- ↑ Stefan Kluge et al.: S3-Leitlinie - Empfehlungen zur stationären Therapie von Patienten mit COVID-19. AWMF-Register-Nr. 113/001S, Stand 17. Mai 2021, S. 36f, online abrufbar als pdf; zuletzt abgerufen am 23. Mai 2021
- ↑ James M. Musser et al.: Treatment of COVID-19 Patients with Convalescent Plasma Reveals a Signal of Significantly Decreased Mortality. In: American Journal of Pathology. 10. August 2020, doi:10.1016/j.ajpath.2020.08.001.
- ↑ Stefan Kluge et al.: S3-Leitlinie - Empfehlungen zur stationären Therapie von Patienten mit COVID-19. AWMF-Register-Nr. 113/001S, Stand 17. Mai 2021, S. 38, online abrufbar als pdf; zuletzt abgerufen am 23. Mai 2021
- ↑ Robert E. Fowelr: Care for Critically Ill Patients With COVID-19. In: Journal of the American Medical Association. 11. März 2020, doi:10.1001/jama.2020.3633.
- ↑ Safety, Tolerability, and Efficacy of Anti-Spike (S) SARS-CoV-2 Monoclonal Antibodies for Hospitalized Adult Patients With COVID-19, ClinicalTrials.gov, Identifier: NCT04426695. Stand 20. November 2020. Abgerufen am 22. November 2020.
- ↑ EMA issues advice on use of REGN-COV2 antibody combination (casirivimab / imdevimab), EMA, 26. Februar 2021. Abgerufen am 26. Februar 2021.
- ↑ a b COVID-19 rapid guideline: vitamin D, Recommendations. In: National Institute for Health and Care Excellence. 17. Dezember 2020, abgerufen am 7. Januar 2021 (englisch).
- ↑ a b Information on COVID-19 Treatment, Prevention and Research, Chapter: Vitamin D. In: NIH. 17. Juli 2020, abgerufen am 21. Februar 2021 (englisch).
- ↑ Treatments, covid-19-tracker. Abgerufen am 16. November 2020.
- ↑ Evaluation of the Safety of CD24-Exosomes in Patients With COVID-19 Infection, Clinical Trials, 10. Februar 2021. Abgerufen am 15. Februar 2021.
- ↑ COVID-19 Monotherapy Study Stopped 'Due to Evidence of Profound Efficacy', Precision Vaccinations, 10. März 2021. Abgerufen am 11. März 2021.
- ↑ Mona Bafadhel et al. :“Inhaled budesonide in the treatment of early COVID-19 (STOIC): a phase 2, open-label, randomised controlled trial”, The Lancet. 9. April 2021, doi: 10.1016/S2213-2600(21)00160-0
- ↑ The PRINCIPLE Trial Collaborative Group; Mona Bafadhel et al. :"Inhaled budesonide for COVID-19 in people at higher risk of adverse outcomes in the community: interim analyses from the PRINCIPLE trial" medRxiv, 12. April 2021, doi: 10.1101/2021.04.10.21254672
- ↑ University of Oxford News Release: Asthma drug budesonide shortens recovery time in non-hospitalised patients with COVID-19, (Direktlink PDF), Pressemitteilung Oxford University, 12. April 2021
- ↑ DGP, ÖGP, DGAKI : Stellungnahme: Therapie mit inhalativen Glukokortikoiden bei COVID-19, (Direktlink PDF), DGP, 20. April 2021
- ↑ J. D. Chalmers u. a.: Management of hospitalised adults with coronavirus disease-19 (COVID-19): A European Respiratory Society living guideline. In: The European Respiratory Journal. 2021, doi:10.1183/13993003.00048-2021, PMID 33692120, PMC 7947358 (freier Volltext).
- ↑ Merck and Ridgeback Biotherapeutics Provide Update on Progress of Clinical Development Program for Molnupiravir, an Investigational Oral Therapeutic for the Treatment of Mild-to-Moderate COVID-19, Merck, 15. April 2021. Abgerufen am 16. April 2021.
- ↑ a b Julien Rio et al.: Estimation of SARS-CoV-2 mortality during the early stages of an epidemic: A modeling study in Hubei, China, and six regions in Europe. PLOS Medicine, 28. Juli 2020, doi:10.1371/journal.pmed.1003189
- ↑ Richard E. Grewelle, Giulio A. De Leo: Estimating the Global Infection Fatality Rate of COVID-19. In: medRxiv. 18. Mai 2020.
- ↑ M. Joannidis, S. J. Klein, P. Metnitz, A. Valentin: Vergütung intensivmedizinischer Leistungen in Österreich. In: Medizinische Klinik – Intensivmedizin und Notfallmedizin. Band 113, Nr. 1, 1. Februar 2018, ISSN 2193-6226, S. 28–32, doi:10.1007/s00063-017-0391-9.
- ↑ Andres Wysling, Rom: Spitäler in Norditalien nah am Kollaps – keine Intensivpflege für alte Patienten mehr? In: Neue Zürcher Zeitung. (nzz.ch [abgerufen am 12. März 2020]).
- ↑ Timothy W. Russell, Joel Hellewell, Christopher Jarvis,Kevin van Zandvoort et al.: Estimating the infection and case fatality ratio for coronavirus disease (COVID-19) using age-adjusted data from the outbreak on the Diamond Princess cruise ship. In: Euro Surveill. Februar 2020, doi:10.2807/1560-7917.ES.2020.25.12.2000256.
- ↑ Henrik Salje et al.: Estimating the burden of SARS-CoV-2 in France. In: Science. 10. Juli 2020, doi:10.1126/science.abc3517.
- ↑ Feehan AK, Fort D, Garcia-Diaz J, Price-Haywood E, Velasco C, Sapp E, et al.: Seroprevalence of SARS-CoV-2 and infection fatality ratio, Orleans and Jefferson parishes, Louisiana, USA, May 2020. In: Emerg Infect Dis. 2020. 30. Juli 2020, doi:10.3201/eid2611.203029.
- ↑ Daniel F. Gudbjartsson : Humoral Immune Response to SARS-CoV-2 in Iceland. In: NEJM. 1. September 2020, doi:10.1056/NEJMoa2026116.
- ↑ Gideon Meyerowitz-Katz, Lea Merone: A systematic review and meta-analysis of published research data on COVID-19 infection-fatality rates. International Journal of Infectious Diseases, 29. September 2020, doi:10.1016/j.ijid.2020.09.1464
- ↑ Gideon Meyerowitz-Katz et al.: Assessing the age specificity of infection fatality rates for COVID-19: systematic review, meta-analysis, and public policy implications. Eur J Epidemiol 8. Dezember 2020, doi:10.1007/s10654-020-00698-1
- ↑ Europäisches Zentrum für die Prävention und die Kontrolle von Krankheiten (Hrsg.): Coronavirus disease 2019 (COVID-19)in the EU / EEA and the UK. Ninth update. 23. April 2020 (europa.eu [PDF]).
- ↑ Aktueller Lage-/Situationsbericht des RKI zu COVID-19. Robert Koch-Institut, abgerufen am 13. Januar 2021.
- ↑ Joseph T. Wu, Kathy Leung, Mary Bushman et al.: Estimating clinical severity of COVID-19 from the transmission dynamics in Wuhan, China. In: Nature Medicine. 19. März 2020, doi:10.1038/s41591-020-0822-7 (englisch).
- ↑ Puntmann VO, Carerj ML, Wieters I, et al. Outcomes of Cardiovascular Magnetic Resonance Imaging in Patients Recently Recovered From Coronavirus Disease 2019 (COVID-19). JAMA Cardiol. Published online July 27, 2020. doi:10.1001/jamacardio.2020.3557
- ↑ ARC Study Group: ‘Long-COVID’: a cross-sectional study of persisting symptoms, biomarker and imaging abnormalities following hospitalisation for COVID-19. Thorax. 10. November, 2020 doi:10.1136/thoraxjnl-2020-215818
- ↑ SARS-CoV-2 Steckbrief zur Coronavirus-Krankheit 2019 (COVID-19), RKI, Stand 30. Oktober 2020
- ↑ ECDC : Immune responses and immunity to SARS-CoV-2, Stand : 30. Juni 2020, zuletzt abgerufen am 24. August 2020
- ↑ Chuan Qin et al.: Reinfection could not occur in SARS-CoV-2 infected rhesus macaques. In: bioRxiv. 14. März 2020, doi:10.1101/2020.03.13.990226.
- ↑ Keine Mehrfachansteckung mit SARS-CoV-2 bei Affen. In: Deutsches Ärzteblatt. Deutscher Ärzteverlag, 18. März 2020, archiviert vom (nicht mehr online verfügbar) am 19. März 2020; abgerufen am 19. März 2020. Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.
- ↑ Derek Cummings et al.: A systematic review of antibody mediated immunity to coronaviruses: antibody kinetics, correlates of protection, and association of antibody responses with severity of disease. medRxiv, 17. April 2020, doi:10.1101/2020.04.14.20065771
- ↑ Kwok-Yung Yuen et al.: „COVID-19 re-infection by a phylogenetically distinct SARS-coronavirus-2 strain confirmed by whole genome sequencing“, Clinical Infectious Diseases, 25. August 2020, ciaa1275, doi:10.1093/cid/ciaa1275
- ↑ Mark Pandori et al. : Genomic evidence for reinfection with SARS-CoV-2: a case study The Lancet Infectious Disease, 12. Oktober 2020, doi:10.1016/S1473-3099(20)30764-7
- ↑ Shengxiang Ge, Lei Liu, Jun Zhang, Ningshao Xia, Zhen Zhang et al.: Antibody responses to SARS-CoV-2 in patients of novel coronavirus disease 2019.Clinical Infectious Diseases, 28. März 2020, doi:10.1093/cid/ciaa344
- ↑ Quan-Xin Long et al. : Clinical and immunological assessment of asymptomatic SARS-CoV-2 infections. Nature Medicine, 18. Juni 2020 doi:10.1038/s41591-020-0965-6
- ↑ Ania Wajnberg et al.: Robust neutralizing antibodies to SARS-CoV-2 infection persist for months. In: Science. 28 Oktober 2020, doi:10.1126/science.abd7728.
- ↑ Sheila F. Lumley et al.: Antibody Status and Incidence of SARS-CoV-2 Infection in Health Care Workers. In: NEJM. vom 23. Dezember 2020, doi:10.1056/NEJMoa2034545.
- ↑ J. Braun, L. Loyal, M. Frentsch et al.: SARS-CoV-2-reactive T cells in healthy donors and patients with COVID-19. In: Nature. von 2020, doi:10.1038/s41586-020-2598-9.
- ↑ Jose Mateus et al.: Selective and cross-reactive SARS-CoV-2 T cell epitopes in unexposed humans. In: Science. Band 370, Nr. 6512, 2020, S. 89–94, doi:10.1126/science.abd3871.
- ↑ Nelde, A., Bilich, T., Heitmann, J.S. et al. SARS-CoV-2-derived peptides define heterologous and COVID-19-induced T cell recognition. In: Nat Immunol von 2020, doi:10.1038/s41590-020-00808-x.
- ↑ Takuya Sekina et al.: Robust T cell immunity in convalescent individuals with asymptomatic or mild COVID-19. In: Cell. Band 183, Nr. 1, 2020, P158-168.e14, doi:10.1016/j.cell.2020.08.017.
- ↑ Catherine J. Reynolds et al.: Discordant neutralizing antibody and T cell responses in asymptomatic and mild SARS-CoV-2 infection. In: Science Immunology. 23. Dezember 2020, Band 5, Nr. 54, Artikel: eabf3698, doi:10.1126/sciimmunol.abf3698.
- ↑ Less severe course of COVID-19 is associated with elevated levels of antibodies against seasonal human coronaviruses OC43 and HKU1 (HCoV OC43, HCoV HKU1). In: ijidonline.com. 21. Februar 2021, abgerufen am 28. April 2021.
- ↑ Lack of antibodies against seasonal coronavirus OC43 nucleocapsid protein identifies patients at risk of critical COVID-19. In: sciencedirect.com. 24. April 2021, abgerufen am 28. April 2021.
- ↑ Teilschutz durch „saisonale“ Coronaviren. In: orf.at. 28. April 2021, abgerufen am 28. April 2021.
- ↑ Bundesministerium für Gesundheit: Basiswissen zum Coronavirus BMG, (fortlaufende Aktualisierung), abgerufen am 6. August 2020
- ↑ Deutsche Welle: Corona und Sport: Zwei Meter reichen nicht www.dw.com, 9. April 2020
- ↑ Umweltbundesamt: Anforderungen an Lüftungskonzeptionen in Gebäuden - Bildungseinrichtungen. Umweltbundesamt, 22. November 2017 (umweltbundesamt.de [abgerufen am 9. Februar 2021]).
- ↑ Coronavirus disease (COVID-19) advice for the public. Weltgesundheitsorganisation (WHO), 18. März 2020, abgerufen am 2. April 2020 (englisch).
- ↑ BZgA – Infektionsschutz.de: Verdacht auf eine Infektion und Test
- ↑ Bundesministerium für Gesundheit (Deutschland) (Hrsg.): Was sollten Sie tun, wenn Sie den Verdacht haben, sich mit dem neuartigen Coronavirus infiziert zu haben?, 5. Mai 2020, abgerufen am 15. Oktober 2020.
- ↑ Ippen Digital GmbH & Co. KG (Hrsg.): Bei Corona-Verdacht nicht zum Arzt: Wie Sie sich richtig verhalten. Internetseite des Westfälischen Anzeigers, 30. November 2020, abgerufen am 26. April 2021.
- ↑ Coronavirus disease (COVID-19) advice for the public. Weltgesundheitsorganisation (WHO), 2020, archiviert vom (nicht mehr online verfügbar) am 15. März 2020; abgerufen am 15. März 2020 (englisch).
- ↑ Bundesministerium für Gesundheit (Deutschland) (Hrsg.): Ihre Fragen – unsere Antworten. „Wenn Sie krank sind, gehen Sie zum Arzt oder ins Krankenhaus“. 25. Mai 2020 (Memento vom 23. Oktober 2020 im Internet Archive)
- ↑ Hygiene beim Husten & Niesen. Bundeszentrale für gesundheitliche Aufklärung, archiviert vom (nicht mehr online verfügbar) am 13. März 2020; abgerufen am 15. März 2020.
- ↑ Christian Drosten. Interview: Florian Schumann und Jakob Simmank: Wir haben es selbst in der Hand. In: zeit.de. 6. Oktober 2020, abgerufen am 7. Oktober 2020.
- ↑ 8 einfache Tipps für den Alltag in der Corona-Pandemie. In: rki.de. RKI, 31. März 2020, abgerufen am 31. März 2021.
- ↑ Derek K. Chu, Elie A. Akl u. a.: Physical distancing, face masks, and eye protection to prevent person-to-person transmission of SARS-CoV-2 and COVID-19: a systematic review and meta-analysis. In: The Lancet. 1. Juni 2020, doi:10.1016/S0140-6736(20)31142-9.
- ↑ a b Hinweise zu Reinigung und Desinfektion von Oberflächen außerhalb von Gesundheitseinrichtungen im Zusammenhang mit der COVID-19-Pandemie. Robert Koch-Institut, 3. Juli 2020, abgerufen am 15. August 2020.
- ↑ BfR Bund: Kann das neuartige Coronavirus über Lebensmittel und Gegenstände übertragen werden? BfR, Fragen und Antworten, Stand 29. Juni 2020, (auch als PDF), abgerufen am 6. August 2020
- ↑ Marianne van der Sande, Peter Teunis, Rob Sabel: Professional and Home-Made Face Masks Reduce Exposure to Respiratory Infections among the General Population. PLOS ONE, 9. Juli 2008, doi:10.1371/journal.pone.0002618
- ↑ Chi Chiu Leung: Mass masking in the COVID-19 epidemic: people need guidance. Lancet, 3. März 2020, doi:10.1016/S0140-6736(20)30520-1
- ↑ J.T. Brooks, J.C. Butler, R.R. Redfield: Universal Masking to Prevent SARS-CoV-2 Transmission—The Time Is Now. JAMA, 14. Juli 2020. doi:10.1001/jama.2020.13107
- ↑ CDC: CDC calls on Americans to wear masks to prevent COVID-19 spread CDC, Stand 14. Juli 2020, abgerufen am 6. August 2020
- ↑ CDC: Coronavirus Disease 2019 (COVID-19) – Prevention & Treatment. 3. April 2020, abgerufen am 3. April 2020 (amerikanisches Englisch).
- ↑ Shuo Feng, Chen Shen, Nan Xia, Wei Song, Mengzhen Fan: Rational use of face masks in the COVID-19 pandemic. In: The Lancet Respiratory Medicine. Band 0, Nr. 0, 20. März 2020, ISSN 2213-2600, doi:10.1016/S2213-2600(20)30134-X, PMID 32203710 (thelancet.com [abgerufen am 27. März 2020]).
- ↑ Korinna Hennig, Christian Drosten: Coronavirusupdate. (PDF) Folge 19. In: ndr.de. Norddeutscher Rundfunk, 23. März 2020, S. 2–4, abgerufen am 25. März 2020.
- ↑ Mingming Liang, Liang Gao, Ce Cheng, Qin Zhou, John Patrick Uy, Kurt Heiner, Chenyu Sun: Efficacy of face mask in preventing respiratory virus transmission: a systematic review and meta-analysis. medRxiv, doi:10.1101/2020.04.03.20051649
- ↑ Deutsche Gesetzliche Unfallversicherung e. V. (DGUV): FAQ Coronavirus Disease 2019 (COVID-19). Abgerufen am 26. April 2020.
- ↑ Frankfurter Rundschau: Schutz gegen das Coronavirus: Was Mundschutz- und Atemschutzmasken wirklich bringen. Abgerufen am 28. April 2020.
- ↑ BfArM: Hinweise des BfArM zur Verwendung von selbst hergestellten Masken (sog. „Community-Masken“), medizinischen Gesichtsmasken, sowie filtrierenden Halbmasken (FFP1, FFP2 und FFP3) im Zusammenhang mit dem Coronavirus (SARS-CoV-2/Covid-19) BfArM, Stand 26. Juni 2020, abgerufen am 6. August 2020
- ↑ Infektionsprävention durch das Tragen von Masken. Deutsche Gesellschaft für Hygiene und Mikrobiologie und Gesellschaft für Virologie, 4. November 2020, abgerufen am 7. Mai 2021.
- ↑ Deutsche Gesellschaft für Krankenhaushygiene (PDF)
- ↑ Patrick Hunziker: Minimizing exposure to respiratory droplets, ‘jet riders’ and aerosols in air-conditioned hospital rooms by a ‘Shield-and-Sink’ strategy. In: medRxiv. 16. Dezember 2020, S. 2020.12.08.20233056, doi:10.1101/2020.12.08.20233056 (medrxiv.org [abgerufen am 24. Dezember 2020]).
- ↑ Abfalltrennung in Zeiten der Coronavirus-Pandemie wichtiger denn je – BMU-Pressemitteilung. Abgerufen am 30. April 2020.
- ↑ Waste management in the context of the coronavirus crisis. (PDF) European Commission, 14. April 2020, abgerufen am 30. April 2020.
- ↑ George Griffin et al.Vitamin D and COVID-19: evidence and recommendations for supplementation, R. Soc. open sci. 7: 201912. http://dx.doi.org/10.1098/rsos.201912.
- ↑ Marcos Pereira et al. Vitamin D deficiency aggravates COVID-19: systematic review and meta-analysis, Crit Rev Food Sci Nutr, 2020 Nov 4;1-9. doi: 10.1080/10408398.2020.1841090. https://pubmed.ncbi.nlm.nih.gov/33146028/
- ↑ William B. Grant et al., Evidence Regarding Vitamin D and Risk of COVID-19 and Its Severity, Nutrients 2020, 12(11), 3361; https://doi.org/10.3390/nu12113361
- ↑ Debatte um Vitamin D: Doch keine Kehrtwende des BfR. In: tagesschau.de. 17. Mai 2020, abgerufen am 19. Mai 2021.
- ↑ a b c d e Hygienemaßnahmen bei der Behandlung und Pflege von COVID-19-Patienten. In: Website des Robert Koch-Instituts. 27. März 2020, abgerufen am 28. März 2020.
- ↑ Dürfen auch FFP-Masken ohne CE-Kennzeichnung verwendet und in Verkehr gebracht werden? BAuA.de, Stand: 6. April 2020; abgerufen am 13. April 2020
- ↑ Liste der vom Robert Koch-Institut geprüften und anerkannten Desinfektionsmittel und -verfahren. In: Website des Robert Koch-Instituts. 12. März 2020, abgerufen am 28. März 2020.
- ↑ Emmie de Wit, Vincent J. Munster et al.: „Aerosol and Surface Stability of SARS-CoV-2 as Compared with SARS-CoV-1“, NEJM, 16. April 2020, doi:10.1056/NEJMc2004973
- ↑ Einordnung der Vorkommnisse in China von Prof. Christoph Benz. Abgerufen am 29. März 2020.
- ↑ Muss mich der Zahnarzt auch in Corona-Zeiten behandeln? br.de, 1. April 2020, abgerufen am 6. August 2020.
- ↑ Alle zahnärztlichen Behandlungen wieder möglich. In: dentalmagazin.de. 15. Mai 2020, abgerufen am 6. August 2020.
- ↑ Sars-CoV-2/COVID 19. Bundeszahnärztekammer, 27. Juli 2020, abgerufen am 6. August 2020.
- ↑ RKI – Coronavirus SARS-CoV-2 – Empfehlungen des RKI zu Hygienemaßnahmen im Rahmen der Behandlung und Pflege von Patienten mit einer Infektion durch SARS-CoV-2. Abgerufen am 30. April 2020.
- ↑ Mit Corona infizierte Abfälle entsorgen. In: Abfallmanager Medizin. Abgerufen am 30. April 2020.
- ↑ a b RKI (Hrsg.): Nationaler Pandemieplan Teil I – Strukturen und Maßnahmen. 2017 (rki.de).
- ↑ RKI (Hrsg.): Ergänzung zum Nationalen Pandemieplan – COVID-19 – neuartige Coronaviruserkrankung. 4. März 2020 (rki.de [PDF]).
- ↑ a b c ECDC (Hrsg.): Guidelines for the implementation of non-pharmaceutical interventions against COVID-19. 25. September 2020 (europa.eu).
- ↑ Jacob Burns u. a.: Reisebezogene Kontrollmaßnahmen zur Eindämmung der COVID‐19‐Pandemie: ein Rapid Review. In: Cochrane Database of Systematic Reviews. 16. September 2020, doi:10.1002/14651858.CD013717.
- ↑ Meera Viswanathan u. a.: Universal screening for SARS‐CoV‐2 infection: a rapid review. In: Cochrane Database of Systematic Reviews. 15. September 2020, doi:10.1002/14651858.CD013718.
- ↑ Barbara Nussbaumer-Streit u. a.: Quarantine alone or in combination with other public health measures to control COVID‐19: a rapid review. In: Cochrane Database of Systematic Reviews. 14. September 2020, doi:10.1002/14651858.CD013574.pub2.
- ↑ a b c d Kontaktpersonen-Nachverfolgung bei SARS-CoV-2-Infektionen. RKI, Stand 5. Februar 2021, zuletzt abgerufen am 7. Februar 2021.
- ↑ Kontaktpersonennachverfolgung bei respiratorischen Erkrankungen durch das Coronavirus SARS-CoV-2. In: Website des Robert Koch-Instituts. 19. Oktober 2020, abgerufen am 14. November 2020.
- ↑ Draft landscape of COVID-19 candidate vaccines. (XLS) In: who.int. Weltgesundheitsorganisation, 6. Januar 2021, abgerufen am 7. Januar 2021 (englisch, Excel-Datei 20210106-Novel Coronavirus_Landscape_COVID.xlsx in verlinktem ZIP-Archiv).
- ↑ Gesundheitssenatorin begrüßt Ausweitung des Risikogebiets durch Robert-Koch-Institut. In: berlin.de. 26. Februar 2020, abgerufen am 29. Februar 2020.
- ↑ Coronavirus: Wann gilt der Katastrophenfall – und was folgt? In: rbb24.de. 26. Februar 2020, abgerufen am 29. Februar 2020.
- ↑ Anna Conlon, Carmel Ashur, Laraine Washer, Kim A. Eagle, Marion A. Hofmann Bowman: Impact of the Influenza Vaccine on COVID-19 Infection Rates and Severity. In: American Journal of Infection Control. 2021, doi:10.1016/j.ajic.2021.02.012.
- ↑ Empfehlungen zum Umgang mit SARS-CoV-2-infizierten Verstorbenen. In: Robert Koch-Institut. 7. April 2020, abgerufen am 22. April 2020.
- ↑ Schutzpaket für mehr Coronatests und Pflege-Prämien beschlossen. Deutscher Bundestag, 14. Mai 2020, abgerufen am 14. Mai 2020.
- ↑ a b Gesetzentwurf der Fraktionen der CDU/CSU und SPD. (PDF) Entwurf eines Zweiten Gesetzes zum Schutz der Bevölkerung bei einer epidemischen Lage von nationaler Tragweite. In: Bundestags-Drucksache 19/18967. 5. Mai 2020, S. 2, 54 f., abgerufen am 14. Mai 2020.
- ↑ Empfehlungen des Robert Koch-Instituts zur Meldung von Verdachtsfällen von COVID-19. Robert Koch-Institut, 29. Mai 2020, abgerufen am 31. Mai 2020.
- ↑ Meldepflicht bei Corona-Infektionen von Haustieren. Presse- und Informationsamt der Bundesregierung, 2. Juli 2020, abgerufen am 1. November 2020.
- ↑ Epidemiegesetz 1950. Bundesrecht konsolidiert, Gesamte Rechtsvorschrift. In: RIS. 14. Juni 2018, abgerufen am 6. März 2020: „Der Anzeigepflicht unterliegen: […] (2) Der Bundesminister für Gesundheit und Frauen kann, […], durch Verordnung weitere übertragbare Krankheiten der Meldepflicht unterwerfen oder bestehende Meldepflichten erweitern.“
- ↑ 15. Verordnung des Bundesministers für Arbeit, Soziales, Gesundheit und Konsumentenschutz betreffend anzeigepflichtige übertragbare Krankheiten 2020. In: Bundesgesetzblatt für die Republik Österreich. 26. Januar 2020, abgerufen am 4. März 2020: „Der Anzeigepflicht nach dem Epidemiegesetz1950 unterliegen Verdachts-, Erkrankungs- und Todesfälle an 2019-nCoV (‚2019 neuartiges Coronavirus‘).“
- ↑ Absonderungsverordnung. Bundesrecht konsolidiert: Gesamte Rechtsvorschrift für Absonderung Kranker, Krankheitsverdächtiger und Ansteckungsverdächtiger und Bezeichnung von Häusern und Wohnungen, Fassung vom 6. März 2020. In: RIS, Bundesrecht konsolidiert. 31. Januar 2020, abgerufen am 6. März 2020: „Bei Masern oder Infektion mit 2019-nCoV (‘2019 neuartiges Coronavirus‚) sind die Kranken und Krankheitsverdächtigen abzusondern oder nach den Umständen des Falles lediglich bestimmten Verkehrsbeschränkungen zu unterwerfen.“
- ↑ Verordnung vom 31. Jänner 2020. 21. Verordnung des Bundesministers für Soziales, Gesundheit, Pflege und Konsumentenschutz, mit der die Verordnung des Ministers des Innern im Einvernehmen mit dem Minister für Kultus und Unterricht vom 22. Februar 1915, betreffend die Absonderung Kranker, Krankheitsverdächtiger und Ansteckungsverdächtiger und die Bezeichnung von Häusern und Wohnungen geändert wird. In: Bundesgesetzblatt für die Republik Österreich. 31. Januar 2020, abgerufen am 6. März 2020: „In § 4 3. Satz wird nach dem Wort ‚Masern‘ die Wortfolge‚ oder Infektion mit 2019-nCoV (‘2019 neuartiges Coronavirus‚)‘ eingefügt.“
- ↑ Neues Coronavirus: Informationen für Gesundheitsfachpersonen. Verdachts- und Meldekriterien sowie Meldeformular. Bundesamt für Gesundheit, 5. März 2020, abgerufen am 5. März 2020.
- ↑ Bundesgesetz über die Bekämpfung übertragbarer Krankheiten des Menschen. Epidemiengesetz, EpG. Bundeskanzlei, 1. Januar 2017, abgerufen am 6. März 2020.
- ↑ Verordnung über die Bekämpfung übertragbarer Krankheiten des Menschen. (Epidemienverordnung, EpV) vom 29. April 2015 (Stand am 1. März 2019). Bundeskanzlei, abgerufen am 6. März 2020.
- ↑ Verordnung des EDI über die Meldung von Beobachtungen übertragbarer Krankheiten des Menschen. vom 1. Dezember 2015 (Stand am 1. Februar 2020). Bundeskanzlei, abgerufen am 6. März 2020.
- ↑ Meldeformulare. COVID-19 Meldung. Bundesamt für Gesundheit, 24. März 2020, abgerufen am 31. März 2020.
- ↑ ICD-10 (WHO und GM): U07.1 kodiert COVID-19, Coronavirus-Krankheit-2019. Deutsches Institut für Medizinische Dokumentation und Information (DIMDI), 17. Februar 2020, abgerufen am 14. Mai 2020.
- ↑ ICD-10-GM 2020: Neuer U-Kode U99.0! und neue Kodierfrage zu Testung auf SARS-CoV-2. DIMDI, 25. Mai 2020, abgerufen am 27. Mai 2020.
- ↑ Ist U07.2! bei Personen zu kodieren, bei denen kein Verdacht auf eine Infektion mit SARS-CoV-2 besteht, jedoch ein Test auf SARS-CoV-2 durchgeführt wurde, welcher negativ ausfällt? (ICD-10-GM Nr. 1019). DIMDI, abgerufen am 27. Mai 2020.
- ↑ ICD-10-GM 2020: Weitere neue U-Kodes im Zusammenhang mit COVID-19 publiziert. Abgerufen am 18. Januar 2021.
- ↑ Bundesamt für Statistik: Offizielle Kommunikation 2021 Nr. 1 – Kodierung COVID-19 – Anzuwenden bei Fällen mit Austrittsdatum ab 1. Januar 2021 | Publikation. 3. Dezember 2020, abgerufen am 18. Januar 2021.
- ↑ ICD-10-GM 2021: Neue U-Kodes im Zusammenhang mit Impfungen gegen COVID-19 publiziert. Abgerufen am 24. April 2021.
- ↑ Berufsgenossenschaft Rohstoffe und chemische Industrie: Informationen zu dem neuen Coronavirus (SARS-CoV-2). bgrci.de, abgerufen am 31. März 2020.
- ↑ Kristian G. Andersen, Andrew Rambaut, W. Ian Lipkin, Edward C. Holmes, Robert F. Garry: The proximal origin of SARS-CoV-2. In: Nature Medicine. Band 26, Nr. 4, April 2020, ISSN 1546-170X, S. 450–452, doi:10.1038/s41591-020-0820-9, PMID 32284615, PMC 7095063 (freier Volltext) – (nih.gov [abgerufen am 24. Mai 2021]).
- ↑ Kevin Berger: The Man Who Saw the Pandemic Coming. 12. März 2020, abgerufen am 24. Mai 2021.
- ↑ Fernando Duarte: Who is 'patient zero' in the coronavirus outbreak? Abgerufen am 24. Mai 2021 (englisch).
- ↑ Xingguang Li, Junjie Zai, Qiang Zhao, Qing Nie, Yi Li: Evolutionary history, potential intermediate animal host, and cross-species analyses of SARS-CoV-2. In: Journal of Medical Virology. Band 92, Nr. 6, Juni 2020, ISSN 1096-9071, S. 602–611, doi:10.1002/jmv.25731, PMID 32104911, PMC 7228310 (freier Volltext) – (nih.gov [abgerufen am 24. Mai 2021]).
- ↑ Kristian G. Andersen, Andrew Rambaut, W. Ian Lipkin, Edward C. Holmes, Robert F. Garry: The proximal origin of SARS-CoV-2. In: Nature Medicine. Band 26, Nr. 4, April 2020, ISSN 1546-170X, S. 450–452, doi:10.1038/s41591-020-0820-9 (nature.com [abgerufen am 24. Mai 2021]).
- ↑ Lucy van Dorp, Mislav Acman, Damien Richard, Liam P. Shaw, Charlotte E. Ford: Emergence of genomic diversity and recurrent mutations in SARS-CoV-2. In: Infection, Genetics and Evolution. Band 83, 2020-9, ISSN 1567-1348, S. 104351, doi:10.1016/j.meegid.2020.104351, PMID 32387564, PMC 7199730 (freier Volltext) – (nih.gov [abgerufen am 24. Mai 2021]).
- ↑ Giselda Vagnoni: Researchers find coronavirus was circulating in Italy earlier than thought. In: Reuters. 16. November 2020 (reuters.com [abgerufen am 24. Mai 2021]).
- ↑ Deutsche Welle (www.dw.com): Coronavirus: From bats to pangolins, how do viruses reach us? | DW | 26.03.2020. Abgerufen am 24. Mai 2021 (britisches Englisch).
- ↑ WHO Points To Wildlife Farms In Southern China As Likely Source Of Pandemic. Abgerufen am 24. Mai 2021 (englisch).
- ↑ Eine Tierärztin informiert: Coronaviren können für Hund und Katze gefährlich werden. In: Frankfurter Neue Presse. 6. März 2020, abgerufen am 5. April 2020.
- ↑ a b Q&A on coronaviruses (COVID-19). Weltgesundheitsorganisation, 9. März 2020, abgerufen am 5. April 2020 (englisch).
- ↑ Juliane Gutmann: Covid-19: Können Haustiere das Coronavirus übertragen? In: Münchner Merkur. 6. März 2020, abgerufen am 6. März 2020.
- ↑ a b c Coronavirus: Nein, Hunde erkranken nicht an Covid-19. In: Der Spiegel. 3. März 2020, abgerufen am 6. März 2020.
- ↑ Information received on 01/03/2020 from Dr Thomas Sit, Chief Veterinary Officer. Weltorganisation für Tiergesundheit, 1. März 2020, abgerufen am 5. April 2020 (englisch).
- ↑ Katze steckt sich bei einem Menschen mit Coronavirus an. In: Neue Westfälische. 29. März 2020, abgerufen am 29. März 2020.
- ↑ Qiang Zhang, Zhengli Shi et al.: SARS-CoV-2 neutralizing serum antibodies in cats: a serological investigation. In: bioRxiv. 1. April 2020, doi:10.1101/2020.04.01.021196.
- ↑ Young-Il Kim et al.: Infection and Rapid Transmission of SARS-CoV-2 in Ferrets. In: Cellpress-Preprint doi:10.1016/j.chom.2020.03.023 (Volltext als PDF).
- ↑ Jianzhong Shi et al.: Susceptibility of ferrets, cats, dogs, and other domesticated animals to SARS–coronavirus 2. In: Science. doi:10.1126/science.abb7015 (Volltext als PDF).
- ↑ Nadja Podbregar: Erste Gorillas mit dem Coronavirus infiziert – Menschenaffen im Zoo von San Diego sind an Covid-19 erkrankt, auf: scinexx.de vom 12. Januar 2021
- ↑ Ausbruch in der Nerzfarm – Tausende Nerze wegen Corona-Infektion verendet. In: faz.net. 9. Oktober 2020, abgerufen am 10. Oktober 2020.
- ↑ foedevarestyrelsen.dk (englisch)
- ↑ Danmarks Radio: Tredje minkfarm i Nordjylland ramt af corona. Auf: dr.dk vom 1. Juli 2020.
- ↑ Udbrud i Hjørring: Samme virus-mutation fundet hos mink, minkavler og på plejehjem. (übersetzt Ausbruch in Hjørring: Gleiche Virusmutation bei Nerzen, Nerzzüchtern und einem Pflegeheim) Auf: dr.dk vom 19. Juni 2020.
- ↑ Dänemark tötet aus Sorge vor Corona-Virus alle Nerze: Millionen Nerze müssen wegen Corona sterben. Auf: Stuttgarter Zeitung. vom 5. November 2020, abgerufen am 5. November 2020.
- ↑ Reuters Staff: Denmark to impose tight regional lockdown after spread of mink coronavirus mutation. In: Reuters. 5. November 2020 (reuters.com [abgerufen am 5. November 2020]).
- ↑ NDR: Dänemark: Wie gefährlich ist das mutierte Corona-Virus? Abgerufen am 7. November 2020.
- ↑ Stephanie Pappas: Endangered ferrets get experimental COVID-19 vaccine. Auf: livescience.com vom 1. Januar 2021.
- ↑ Nach Massentötungen in Dänemark – Finnland entwickelt Corona-Impfung für Nerze, auf: n-tv vom 12. Januar 2021
- ↑ Entscheidende Testphase läuft – Russland entwickelt Corona-Impfstoff für Tiere, auf: n-tv vom 13. Dezember 2020





