1,4-Dioxin
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||
| Allgemeines | ||||||||||
| Name | 1,4-Dioxin | |||||||||
| Andere Namen |
| |||||||||
| Summenformel | C4H4O2 | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 84,07 g·mol−1 | |||||||||
| Aggregatzustand |
flüssig | |||||||||
| Siedepunkt | ||||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||
1,4-Dioxin, auch p-Dioxin, ist eine sauerstoffhaltige heterocyclische organische Verbindung, die formal als ringförmig geschlossener doppelter Ether des zweiwertigen Alkohols Ethendiol (HO–CH=CH–OH) aufgefasst werden kann bzw. als Sauerstoffheterocycle des Cyclohexadien: 1,4-Dioxa-2,5-cyclohexadien. Neben 1,4-Dioxin existiert das Isomer 1,2-Dioxin (o-Dioxin).
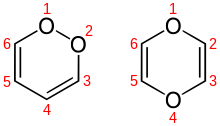
Aus der Struktur des Dioxins und des chemisch verwandten Furans leiten sich die giftigen, krebserregenden und langlebigen polychlorierten Dibenzodioxine und -furane ab. Der Begriff Dioxin wird außerhalb der Fachwelt sehr häufig für diese Stoffklasse verwendet, zu der auch das sogenannte Sevesogift 2,3,7,8-Tetrachlordibenzodioxin (TCDD) zählt, das beim Chemieunfall in Seveso, dem Sevesounglück, freigesetzt wurde.
Gewinnung und Darstellung[Bearbeiten | Quelltext bearbeiten]
1,4-Dioxin kann man herstellen, indem man die Doppelbindung des Produkts der Diels-Alder-Reaktion von Furan und Maleinsäureanhydrid epoxidiert und durch eine Retro-Diels-Alder-Reaktion zu Maleinsäureanhydrid und 1,4-Dioxin spaltet.[3]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ R. C. Weast, J. G. Grasselli (Hrsg.): CRC Handbook of Data on Organic Compounds. 2. Auflage. CRC Press, Boca Raton, FL, 1989, S. 1.
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ R. Alan Aitken, J. I. G. Cadogan, Ian Gosneya: Effect of ring strain on the formation and pyrolysis of some Diels–Alder adducts of 2-sulfolene (2,3-dihydrothiophene 1,1-dioxide) and maleic anhydride with 1,3-dienes and products derived therefrom. In: J. Chem. Soc., Perkin Trans. 1. 1994, S. 927–931, doi:10.1039/p19940000927.
