1,5,9-Cyclododecatrien
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||||||||
| 1,5,9-Cyclododecatrien a) trans,trans,trans-Isomer (E,E,E-Isomer) | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | 1,5,9-Cyclododecatrien | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C12H18 | |||||||||||||||
| Kurzbeschreibung |
farblose bis gelbliche Flüssigkeit mit beißendem Geruch[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 162,27 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||
| Dichte | ||||||||||||||||
| Schmelzpunkt |
−1,5 °C (Z,Z,Z)[4] | |||||||||||||||
| Siedepunkt |
108 °C (2266 Pa) (Z,Z,Z)[4] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit |
praktisch unlöslich in Wasser (5 mg·l−1 bei 20 °C)[1] | |||||||||||||||
| Brechungsindex | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
1,5,9-Cyclododecatrien (CDT) ist eine chemische Verbindung aus der Gruppe der ungesättigten zyklischen Kohlenwasserstoffe, genauer der Cycloalkene, mit drei Doppelbindungen, die in vier isomeren Formen vorkommt.
Vorkommen[Bearbeiten | Quelltext bearbeiten]
Cyclododecatrien ist ein Edukt und das Hauptabbauprodukt von Hexabromcyclododecan (HBCDD).[7]
Gewinnung und Darstellung[Bearbeiten | Quelltext bearbeiten]
Das industriell bedeutsame trans-trans-cis-Isomer (2) kann durch Cyclotrimerisation von 1,3-Butadien (1) mit Titantetrachlorid und dem Organoaluminium-Co-Katalysator Al(C2H5)Cl2-Al(C2H5)2Cl bei Temperaturen von 30–75 °C und einem Druck von 1–10 bar mit einer Gesamtselektivität von über 90 % gewonnen werden.[8][9]

In Gegenwart von Nickel- oder Chromkatalysatoren führt die Cyclotrimerisation bevorzugt zum 1,5,9-trans-trans-trans-Isomer [(E,E,E)-Isomer].[10]
Verwendung[Bearbeiten | Quelltext bearbeiten]
Cyclododecatrien wird als Zwischenprodukt bei der Herstellung von chemischen Verbindungen wie Additiven in Baustoffen, Füll- und Dämmstoffen, Harz für Styrol-Butadien-Kautschuk, Schmiermitteln, Duftstoffen, Klebstoffen und als Stabilisatoren und Weichmacher für thermoplastische Polymere verwendet.[11]
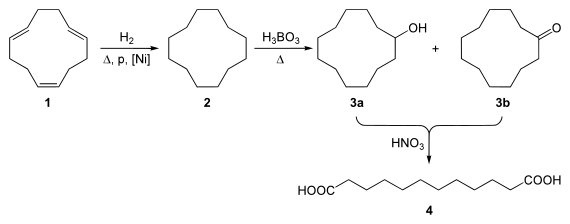
So dient sie als Ausgangsstoff für die Herstellung von 1,12-Dodecandisäure (die bei der Produktion von Polyamiden eingesetzt wird) durch Hydrierung zu Cyclododecan (2) gefolgt Oxidation in der Gegenwart von Borsäure. Dabei entstehen ein Alkohol (3a) und ein Keton (3b), welche weiter mit Salpetersäure zu 1,12-Dodecandisäure (4) umgesetzt werden:
Durch die vollständige Bromierung wurde das vor dem Verbot unter dem Stockholmer Übereinkommen als Flammschutzmittel verwendete Hexabromcyclododecan hergestellt.[10]
Sicherheitshinweise[Bearbeiten | Quelltext bearbeiten]
1,5,9-Cyclododecatrien bildet bei erhöhter Temperatur entzündliche Dampf-Luft-Gemische. Mit den Flammpunkten von 88 °C für ein Isomerengemisch[1], 81 °C für das (E,E,E)-Isomer[12] und 93 °C für das (E,E,Z)-Isomer[12] gilt die Substanz als schwer entflammbar. Der Explosionsbereich liegt zwischen 1 Vol.‑% als untere Explosionsgrenze (UEG) und 4 Vol.‑% als obere Explosionsgrenze (OEG).[1] Die Zündtemperatur beträgt 244 °C.[1][12] Der Stoff fällt somit in die Temperaturklasse T3.
Unfall in der CDT-Produktion in Marl[Bearbeiten | Quelltext bearbeiten]
In Deutschland wird CDT von Evonik Industries im Chemiepark Marl produziert. Am 31. März 2012 entstand in der Anlage ein schwerer Brand, in dessen Folge zwei Arbeiter starben. Als Ursache für den Brand wird Ermittlungen zufolge die Überdosierung eines Katalysators angenommen. Der Ausfall des Werks führte zeitweilig zu Lieferengpässen bei CDT-basierten Produkten, die hauptsächlich die Automobil- und Photovoltaikindustrie betrafen.[13][14][15]
Weblinks[Bearbeiten | Quelltext bearbeiten]
- GPS Safety Summary Cyclododeca-1,5,9-triene. (PDF; 118 kB)
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c d e f g h i Eintrag zu Cyclododeca-1,5,9-trien in der GESTIS-Stoffdatenbank des IFA, abgerufen am 1. Februar 2016. (JavaScript erforderlich)
- ↑ N. N. Greenwood, J. H. Morris: 589. Boron-carbon heterocyclic compounds. Part I. Synthesis and reactions of perhydro-9b-boraphenalene. In: Journal of the Chemical Society (Resumed). 1960, S. 2922, doi:10.1039/JR9600002922.
- ↑ a b c Hirosi Takahasi, Muneaki Yamaguchi: Synthesis of 1,5,9-Cyclododecatriene. In: The Journal of Organic Chemistry. Band 28, Nr. 5, 1963, S. 1409–1411, doi:10.1021/jo01040a519.
- ↑ a b c d e Longiave et al.: Trimerizzarione ciclica del butadiene con catalizzatori solubili a base di titanio. In: Chimica e l'Industria. Nr. 49, 1967, S. 497–498.
- ↑ a b c d e Von H. Breil, P. Heimbach, M. Kroener, H. Mueller, G. Wilke: Synthese von cyclododecatrienen—(1,5,9). I. Mitt. Über die katalytische Umwandlung von Olefinen. In: Die Makromolekulare Chemie. Band 69, Nr. 1, 1963, S. 18–40, doi:10.1002/macp.1963.020690102.
- ↑ Patent US3354229: Oxonation of cyclododecatriene to C13 alcohol. Veröffentlicht am 21. November 1967, Anmelder: Esso Research & Engineering, Erfinder: Neville L. Cull, Lloyd A. Pine.
- ↑ Hexabromocyclododecane as a possible global POP. (PDF; 802 kB) Nordic Council of Ministers, 2008, S. 28, abgerufen am 23. Mai 2012 (englisch).
- ↑ Hans-Jürgen Arpe: Industrielle Organische Chemie: Bedeutende Vor- und Zwischenprodukte. 6. Auflage. Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim 2007, ISBN 978-3-527-31540-6, S. 268.
- ↑ Patent EP1860086B1: Verfahren zur Herstellung von Cyclododecatrien. Veröffentlicht am 14. Mai 2014, Anmelder: Evonik Degussa GmbH, Erfinder: Jürgen Herwig, Wilhelm Brügging, Martin Roos, Norbert Wilczok.
- ↑ a b G. Oenbrink, T. Schiffer: Cyclododecatriene, Cyclooctadiene, and 4-Vinylcyclohexene, in: Ullmanns Enzyklopädie der Technischen Chemie. Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim 2012, doi:10.1002/14356007.a08_205.pub2.
- ↑ Roland Streck, Herbert Hartig: Herstellung und Anwendungsmöglichkeiten von Cyclododecatrien und Cyclooctadien. In: Chemie Ingenieur Technik. Band 62, Nr. 11, 1990, S. 888–891, doi:10.1002/cite.330621105.
- ↑ a b c E. Brandes, W. Möller: Sicherheitstechnische Kenngrößen - Band 1: Brennbare Flüssigkeiten und Gase, Wirtschaftsverlag NW – Verlag für neue Wissenschaft GmbH, Bremerhaven 2003.
- ↑ Fire at the CDT plant on the grounds of the Marl Chemicals Park. Evonik Industries, 4. April 2012, abgerufen am 23. Mai 2012.
- ↑ Betriebsgenehmigung für CDT-Anlage in Marl durch Bezirksregierung Münster erteilt. Evonik Industries, 4. Dezember 2012, abgerufen am 26. Juni 2023.
- ↑ Evonik-Störfall lässt Automanager unruhig werden. In: automobil-produktion.de. 18. April 2012, archiviert vom am 29. April 2012; abgerufen am 23. Mai 2012.

