2,5-Dimethoxy-4-bromamphetamin
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
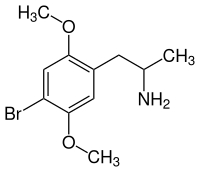
| ||||||||||||||||
| Vereinfachte Strukturformel ohne Stereochemie | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | 2,5-Dimethoxy-4-bromamphetamin | |||||||||||||||
| Andere Namen | ||||||||||||||||
| Summenformel | C11H16BrNO2 | |||||||||||||||
| Kurzbeschreibung | ||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | ||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
2,5-Dimethoxy-4-bromamphetamin (Abk. DOB) ist ein wirkungsstarkes psychedelisches Halluzinogen. Chemisch gehört es zur Strukturklasse der Amphetamine.
Isomerie[Bearbeiten | Quelltext bearbeiten]
2,5-Dimethoxy-4-bromamphetamin ist chiral, folglich gibt es zwei enantiomere Formen:
- (R)-2,5-Dimethoxy-4-bromamphetamin und
- (S)-2,5-Dimethoxy-4-bromamphetamin.
| Isomere von 2,5-Dimethoxy-4-bromamphetamin | ||
| Name | (R)-2,5-Dimethoxy-4-bromamphetamin | (S)-2,5-Dimethoxy-4-bromamphetamin |
| Andere Namen | (−)-2,5-Dimethoxy-4-bromamphetamin | (+)-2,5-Dimethoxy-4-bromamphetamin |
| Strukturformel |  |

|
| CAS-Nummer | 43061-15-0 (Base) 50505-92-5 (Hydrochlorid) 53581-79-6 (Hydrobromid) |
43061-16-1 (Base) 50505-93-6 (Hydrochlorid) 53581-80-9 (Hydrobromid) |
| 64638-07-9 (Base, unspez.) 29705-96-2 (Hydrochlorid, unspez.) 53581-53-6 (Hydrobromid, unspez.) | ||
| PubChem | 12626561 (Base) | 23983765 (Base) |
| 62065 (Base, unspez.) | ||
| DrugBank | - | - |
| DB01484 | ||
| Wikidata | Q27275334 (Base) | Q27285094 (Base) |
| Q209241 (Base, unspez.) | ||
Geschichte[Bearbeiten | Quelltext bearbeiten]
DOB wurde erstmals 1967 durch Alexander Shulgin synthetisiert. Erste Berichte über die Wirkung und die unerwartet hohe Potenz von DOB erschienen 1971.
Synthese[Bearbeiten | Quelltext bearbeiten]
Ein möglicher Syntheseweg ist in PiHKAL durch Bromierung von 2,5-Dimethoxyamphetamin beschrieben.[4]
Pharmakologische Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Pharmakokinetik[Bearbeiten | Quelltext bearbeiten]
Dimethoxybromamphetamin ist bereits in Dosen von 1–3 mg wirksam und hat eine sehr lange Wirkdauer von 18–30 Stunden. Die Wirkung setzt erst recht spät ein.[2]
Die Verteilung und Verstoffwechselung im Körper wurde mit radioaktiv markiertem DOB als Radioligand untersucht. Die Substanz sammelt sich über mehrere Stunden in der Lunge an und erreicht erst später das Gehirn. Dies legt die Vermutung nah, dass DOB in der Lunge metabolisiert wird und erst der Metabolit hauptsächlich psychoaktiv ist. Dies würde sowohl das späte Einsetzen der Wirkung als auch die hohe Wirkdauer erklären.
Wirkung[Bearbeiten | Quelltext bearbeiten]
DOB scheint u. a. eine entaktogene Wirkung zu haben und vor allem das Farbempfinden und den Tastsinn zu verstärken. Wie viele andere psychoaktive Substanzen birgt auch DOB die Gefahr der Auslösung einer latenten Psychose (Siehe auch HPPD), bei ungünstigen Veranlagungen kann schon eine „normale“ Dosis zu einer kaum mehr kontrollierbaren Wirkung führen. Hohe Überdosierungen können zu schweren Vergiftungen und Lähmungserscheinungen führen, auch Todesfälle wurden schon dokumentiert. Bereits bei der oben angegebenen Wirkungsdosis wurden von Konsumenten physische Nebenwirkungen wie Tremor und Krämpfe berichtet.[5] Wie andere 2,5-Dimethoxy-4-substituierte Amphetamine wirkt DOB unter anderem als Agonist der Serotonin-Rezeptoren 5-HT2A/2C.[6]
Betäubungsmittelrechtliche Regelungen[Bearbeiten | Quelltext bearbeiten]
DOB wurde durch den Suchtstoffkontrollrat der UNO im Schedule I der Konvention über Psychotrope Substanzen eingeführt und ist damit praktisch weltweit illegal.
In der Bundesrepublik Deutschland wurde DOB 1984[7] als nicht verkehrsfähiges Betäubungsmittel in die Anlage I des Betäubungsmittelgesetz aufgenommen. Zum Februar 1998 wurde die amtliche Bezeichnung von Dimethoxybromamphetamin im deutschen Betäubungsmittelgesetz in den internationalen Freinamen (INN) Brolamfetamin geändert.[8] Der Umgang ohne Erlaubnis ist grundsätzlich strafbar.
Siehe auch[Bearbeiten | Quelltext bearbeiten]
Literatur[Bearbeiten | Quelltext bearbeiten]
- Alexander Shulgin, Ann Shulgin: PIHKAL – A Chemical Love Story Transform Press, ISBN 0-9630096-0-5.
Weblinks[Bearbeiten | Quelltext bearbeiten]
- DOB in PIHKAL
- DOB. In: Erowid. (englisch)
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ INN Recommended List 26, World Health Organisation (WHO), 9. Juni 1986.
- ↑ a b c PiHKAL #62 DOB
- ↑ a b c d Datenblatt (±)-2,5-Dimethoxy-4-bromoamphetamine hydrobromide bei Sigma-Aldrich, abgerufen am 22. Dezember 2011 (PDF).
- ↑ PIHKAL: #62
- ↑ Daniel Trachsel, Nicolas Richard: Psychedelische Chemie Nachtschatten, 2000, S. 112 und 114.
- ↑ Pablo R. Moya, Kelly A. Berg, Manuel A. Gutiérrez-Hernandez, Patricio Sáez-Briones, Miguel Reyes-Parada, Bruce K. Cassels, William P. Clarke: „Functional Selectivity of Hallucinogenic Phenethylamine and Phenylisopropylamine Derivatives at Human 5-Hydroxytryptamine (5-HT)2A and 5-HT2C Receptors“, in: Journal of Pharmacology and Experimental Therapeutics, 2007, 321 (3), 1054–1061; doi:10.1124/jpet.106.117507.
- ↑ Erste Betäubungsmittelrechts-Änderungsverordnung (1. BtMÄndV) vom 6. August 1984 (BGBl. 1984 I S. 1081); bei Eve & Rave einsehbar: (PDF).
- ↑ Zehnte Verordnung zur Änderung betäubungsmittelrechtlicher Vorschriften (10. BtMÄndV) vom 20. Januar 1998 (BGBl. I S. 74); bei Eve & Rave einsehbar: (PDF).