5-Hydroxytryptophan
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||||||||||||||
| L-5-Hydroxytryptophan | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Oxitriptan | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C11H12N2O3 | |||||||||||||||||||||
| Kurzbeschreibung |
weißliches Pulver, feinkristallin[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Wirkmechanismus |
Hormonvorstufe | |||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 220,23 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Dichte | ||||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Löslichkeit |
schwer löslich in Wasser[1] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
5-Hydroxytryptophan (5-HTP), genauer L-5-Hydroxytryptophan [Synonym: (S)-5-Hydroxytryptophan], Freiname: Oxitriptan, ist eine nicht-proteinogene α-Aminosäure mit lipophiler aromatischer Seitenkette. Es ist ein Zwischenprodukt bei der Serotoninsynthese aus L-Tryptophan in Organismen.
Vorkommen und Gewinnung[Bearbeiten | Quelltext bearbeiten]
L-5-Hydroxytryptophan kommt wie L-Tryptophan und Serotonin in verschiedenen Bananensorten vor. Kommerziell wird es aus den Samen von Griffonia simplicifolia gewonnen, in denen es in reichlicher Menge vorhanden ist.
Biologische Bedeutung beim Menschen[Bearbeiten | Quelltext bearbeiten]
Stoffwechsel[Bearbeiten | Quelltext bearbeiten]
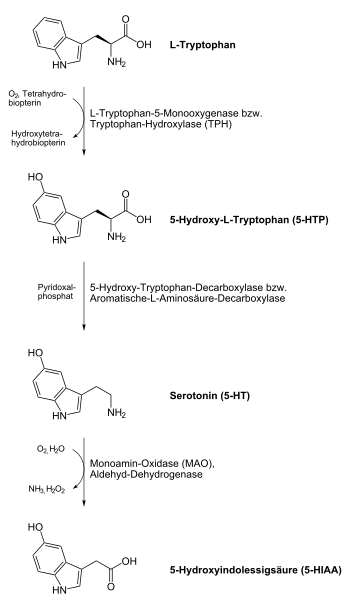
L-5-Hydroxytryptophan hat keine eigene biologische Funktion im menschlichen Körper, sondern wird im menschlichen Körper zur Serotoninsynthese (und infolgedessen auch zur Melatoninsynthese) verwendet. Dabei hat es im Gegensatz zu seiner chemischen Vorstufe L-Tryptophan keine nennenswerten anderen Stoffwechselwege, wird also vollständig zu Serotonin umgesetzt. Zudem läuft die Umsetzung von L-5-HTP zu Serotonin wesentlich schneller ab als die von L-Tryptophan zu 5-HTP. Aus diesen beiden Gründen ist die Wirkung von L-5-HTP auf den Serotoninhaushalt schneller und stärker als bei L-Tryptophan.
Der Großteil des über die Nahrung aufgenommenen L-5-HTP wird in der Leber verstoffwechselt und als Serotonin in das Blut abgegeben, wo es teils von Blutplättchen, teils von Darmzellen aufgenommen wird, teils rasch wieder durch das Monoamino-Oxidase-System der Lunge abgebaut wird. Ein anderer Teil gelangt über die Blut-Hirn-Schranke in das Gehirn und wird dort von den serotonergen Nervenzellen zur Serotoninsynthese herangezogen.
Besonders ist hier noch die im Darm befindliche besondere Zellart der enterochromaffinen Zellen zu nennen, die eine Zwischenform zwischen Nervenzelle und einfacher Darmzelle darstellen und ebenfalls Serotonin zur Signalübertragung benutzten. Da diese Zellen zwar das Enzym Hydroxytryptophan-Decarboxylase besitzen, nicht aber Tryptophan-Hydroxylase, können sie normalerweise selbst kein Serotonin aus der Nahrung herstellen; denn unsere Nahrung enthält gemeinhin nur L-Tryptophan und kein (oder kaum) L-5-HTP. Sie sind daher auf das L-5-HTP angewiesen, welches in der Leber aus L-Tryptophan hergestellt und noch nicht zu Serotonin umgesetzt wurde. Wird nun L-5-HTP direkt mit der Nahrung bzw. als Nahrungsergänzung zugeführt, ist die Menge an L-5-HTP, die diese Zellen erreicht, üblicherweise sehr viel größer als sonst und sie beginnen sehr viel Serotonin daraus zu produzieren. Die Folge sind gerade einige der Nebenwirkungen von L-5-HTP, die L-Tryptophan nicht hat, und zwar – je nach Dosis – Appetitlosigkeit, Übelkeit und Erbrechen.
5-HTP- und Serotoninbiosynthese[Bearbeiten | Quelltext bearbeiten]
L-Tryptophan wird durch das Enzym Tryptophan-Hydroxylase (TPH) in L-5-Hydroxytryptophan (L-5-HTP) überführt. Da der Übergang vom L-Tryptophan zum L-5-HTP bei der körpereigenen Serotoninsynthese der geschwindigkeitsbestimmende Schritt ist, kommt der Tryptophan-Hydroxylase eine wichtige Regelfunktion dieses Syntheseweges zu.
L-5-HTP wird durch das Enzym Hydroxytryptophan-Decarboxylase (genauer: Aromatische-L-Aminosäure-Decarboxylase, AADC) in Serotonin überführt. Das Vitamin-B6-Derivat Pyridoxalphosphat wirkt dabei als Cofaktor und verstärkt oder vermindert in Abhängigkeit seines Vorhandenseins die Aktivität der Hydroxytryptophan-Decarboxylase.[5][6]
Pharmakologie[Bearbeiten | Quelltext bearbeiten]
Für L-5-Hydroxytryptophan (wie auch von L-Tryptophan) wird eine stimmungsaufhellende, beruhigende und gewichtsreduzierende Wirkung angenommen. So zeigte etwa eine Studie an Ratten mit in Griffonia simplicifolia natürlich vorkommendem L-5-HTP eine Verminderung der Angst vor offenen Flächen, woraus die Forscher eine potentielle Anwendung beim Menschen als Anxiolytikum ableiten.[7] Die Wirkung beruht auf der Verstoffwechslung zu Serotonin im menschlichen Körper. Es wird angenommen, dass durch einen erhöhten Serotoninspiegel die Stimmung aufgehellt und Depressionen gelindert werden können. Ungeachtet dessen gilt die klinische Wirksamkeit von L-5-Hydroxytryptophan aufgrund älterer und qualitativ unzureichender Studiendaten als nicht ausreichend belegt.[8] In einer kleinen Studie an 20 übergewichtigen Personen erhöhte L-5-HTP nach oraler Anwendung als Spray das Sättigungsgefühl bei gleichzeitiger Senkung des Body Mass Indexes (BMI).[9]
Um die peripheren Serotoninwirkungen zu minimieren, die unerwünschte Wirkungen einer systemischen L-5-Hydroxytryptophan-Gabe darstellen, wird L-5-Hydroxytryptophan oft zusammen mit einem „peripheren“ Decarboxylase-Inhibitor (PDI) angewendet. Diese Arzneistoffe, zu denen beispielsweise Carbidopa zählt, hemmen die Verstoffwechslung von L-5-Hydroxytryptophan zu Serotonin in der Peripherie, aber nicht im Gehirn, da sie nicht die Blut-Hirn-Schranke passieren.[10]
Pharmakokinetik[Bearbeiten | Quelltext bearbeiten]
Nach oraler Verabreichung wird L-5-Hydroxytryptophan zu 50–85 % in den systemischen Kreislauf aufgenommen. Hier liegt es zu etwa 60 % an Plasmaproteine gebunden vor.[11] Es wird fast vollständig zu Serotonin metabolisiert und in Form von 5-Hydroxyindolylessigsäure über den Urin ausgeschieden. Seine Plasmahalbwertzeit beträgt etwa 2 bis 7 Stunden.[12]
Neben- und Wechselwirkungen[Bearbeiten | Quelltext bearbeiten]
Bei einer therapeutischen Verwendung können bei höheren Dosierungen Nebenwirkungen des Magen-Darm-Trakts auftreten, insbesondere Übelkeit, Erbrechen und Durchfall. Seltener treten Kopfschmerzen, Schlaflosigkeit und Palpitation auf. Die Rate peripherer Nebenwirkungen ist bei gleichzeitiger Gabe eines peripheren Decarboxylasehemmers geringer.[13]
1998 berichtete die FDA von bis zu diesem Zeitpunkt zehn Personen weltweit, bei denen möglicherweise ein Eosinophilie-Myalgie-Syndrom (EMS) in Zusammenhang mit der Einnahme der von L-5-Hydroxytryptophan-Präparaten aufgetreten ist. Hinweise auf einen ursächlichen Zusammenhang mit dem Wirkstoff konnten aber nicht erhärtet werden. Stattdessen wurde eine Verunreinigung mit Tryptophan-4,5-dion in früheren L-5-Hydroxytryptophan-Präparaten als Ursache für das Auftreten des Syndroms angesehen.[14]
Bei gleichzeitiger Anwendung von L-5-Hydroxytryptophan mit anderen Arzneistoffen mit Wirkung auf das Serotoninsystem, wie selektive Serotonin-Wiederaufnahmehemmer sowie zumindest theoretisch MAO-Hemmer und trizyklische Antidepressiva, besteht die Gefahr eines sogenannten Serotonin-Syndroms. Dieses wird durch unkontrolliert hohe Serotoninspiegel hervorgerufen und zeichnet sich unter anderem durch Bluthochdruck, Fieber, Erröten, Schwindel, Verwirrung und Krämpfe aus.[14]
Verwendung[Bearbeiten | Quelltext bearbeiten]
Unter dem Handelsnamen Levothym wurde L-5-Hydroxytryptophan insbesondere in den 1970er und 1980er Jahren als verschreibungspflichtiges Arzneimittel zur Behandlung von Depressionen eingesetzt. Die Marktrücknahme in Deutschland erfolgte 1992.[15] Seit der Einführung der sogenannten selektiven Serotonin-Wiederaufnahmehemmer (SSRI) gegen Ende der 1980er Jahre besitzt L-5-Hydroxytryptophan in dieser Indikation kaum noch eine therapeutische Bedeutung.[14] In Deutschland ist kein zugelassenes Arzneimittel mit dem Wirkstoff L-5-Hydroxytryptophan auf dem Markt. Weitere Anwendungsgebiete sind die Behandlung des postanoxischen Myoklonus,[16][17][18] die substituierende Behandlung bei einem Biopterin-Synthese-Defekt[18] und die Migräne- und Kopfschmerzprophylaxe.[19]
5-HTP-reiche Griffoniaextrakte werden in Deutschland als Nahrungsergänzungsmittel verkauft. Gemäß Löbell-Behrends et al.[20] handelt es sich bei Samenextrakten von Griffonia simplicifolia jedoch um als Novel Food (neuartige Lebensmittel, neuartige Lebensmittelzutaten) einzustufende Produkte, die in der Europäischen Union einer Genehmigungspflicht (Zulassung) unterliegen. Ob Griffoniaextrakte legal in Verkehr sind bzw. in Verkehr gebracht werden dürfen, ist im Einzelfall zu prüfen und obliegt den zuständigen Behörden.
Es sind keine gesundheitsbezogenen Werbeaussagen gemäß der Health-Claims-Verordnung zugelassen.[21]
Weblinks[Bearbeiten | Quelltext bearbeiten]
- Alexander Römmler: 5-Hydroxy-Tryptophan (5HTP). Eine hilfreiche Vorstufe des Serotonins. (PDF; 481 kB) 2010.
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c d e f Datenblatt 5-Hydroxy-L-tryptophan - CAS 895096 - Calbiochem bei Merck, abgerufen am 25. Dezember 2019.
- ↑ Eintrag zu L-5-Hydroxytryptophan bei Thermo Fisher Scientific, abgerufen am 13. Oktober 2023.
- ↑ a b Iyakuhin Kenkyu. Study of Medical Supplies, 6(307), 1975
- ↑ K. Omori, H. Orima, T. Kojima, H. Takahira: [Pharmacological studies on 5-hydroxy-L-tryptophan (L-5HTP). 1. Influence of L-5HTP on the central nervous system]. In: Nihon yakurigaku zasshi. Folia pharmacologica Japonica. Band 69, Nummer 4, Juli 1973, S. 523–541, PMID 4546003.
- ↑ M. K. Rahman, T. Nagatsu, T. Sakurai, S. Hori, M. Abe, M. Matsuda: Effect of pyridoxal phosphate deficiency on aromatic L-amino acid decarboxylase activity with L-DOPA and L-5-hydroxytryptophan as substrates in rats. In: Jpn J Pharmacol. Band 32, Nr. 5, Oktober 1982, S. 803–811, PMID 6983619.
- ↑ Aromatic-L-amino-acid decarboxylase (EC 4.1.1.28). In: Expasy.org
- ↑ G. Carnevale u. a.: Anxiolytic-like effect of „Griffonia simplicifolia“ Baill. seed extract in rats. In: Phytomedicine. 18, 2011, S. 848–851. PMID 21353511.
- ↑ K. Shaw, J. Turner, C. Del Mar: Tryptophan and 5-Hydroxytryptophan for depression. In: Cochrane Database of Systematic Reviews. Issue 1, 2002, Art. No.: CD003198. doi:10.1002/14651858.CD003198
- ↑ M. Rondanelli, A. Opizzi, M. Faliva, M. Bucci, S. Perna: Relationship between the absorption of 5-hydroxytryptophan from an integrated diet, by means of Griffonia simplicifolia extract, and the effect on satiety in overweight females after oral spray administration. In: Eat Weight Disord. 17(1), 2012, S. e22–e28. doi:10.3275/8165. Epub 2011 Dec 5
- ↑ H. J. Gijsman, J. M. van Gerven, M. L. de Kam u. a.: Placebo-controlled comparison of three dose-regimens of 5-hydroxytryptophan challenge test in healthy volunteers. In: J Clin Psychopharmacol. Band 22, Nr. 2, April 2002, S. 183–189, PMID 11910264.
- ↑ Open Drug Database | Medikamente | Fachinformation zu Tript-OH®. (Memento vom 5. Dezember 2009 im Internet Archive)
- ↑ H. G. Westenberg, T. W. Gerritsen, B. A. Meijer, H. M. van Praag: Kinetics of l-5-hydroxytryptophan in healthy subjects. In: Psychiatry Res. Band 7, Nr. 3, Dezember 1982, S. 373–385, PMID 6187038.
- ↑ W. F. Byerley, L. L. Judd, F. W. Reimherr, B. I. Grosser: 5-Hydroxytryptophan: a review of its antidepressant efficacy and adverse effects. In: J. Clin. Psychopharmacol. Band 7, Nr. 3, Juni 1987, S. 127–137, PMID 3298325.
- ↑ a b c E. H. Turner, J. M. Loftis, A. D. Blackwell: Serotonin a la carte: supplementation with the serotonin precursor 5-hydroxytryptophan. In: Pharmacol Ther. Band 109, Nr. 3, März 2006, S. 325–338, doi:10.1016/j.pharmthera.2005.06.004, PMID 16023217.
- ↑ Marktrücknahme von Oxitriptan (LEVOTHYM). arznei-telegramm 2/92.
- ↑ Fachinformation Tript-OH, Sigma-Tau S.p.A (Italien), Stand Juni 2016.
- ↑ Levotonine, Haute Autorité de santé (Frankreich), März 2014.
- ↑ a b Levothym, Information im AMIS der deutschen Arzneimittelbehörden, Stand September 1992.
- ↑ Fachinformation Cincofarm, Angelini Farmacêutica, Lda. (Portugal), Stand Juli 2007.
- ↑ S. Löbell-Behrends et al.: Borderlineprodukte - Kontrolle des Internethandels mit Anti-Aging- und Schlankheitsmitteln. Eine Pilot-Studie. (Memento vom 6. Januar 2018 im Internet Archive) (PDF) In: Deutsche Lebensmittel-Rundschau, 104. Jahrgang, Heft 6, 2008, S. 268.
- ↑ EU Register on nutrition and health claims. ec.europa.eu