Acyloin-Kondensation
Als Acyloin-Kondensation bezeichnet man in der Organischen Chemie die Kondensation zweier Ester zu α-Hydroxycarbonylverbindungen (Acyloine) durch Umsetzung in der Wärme mit Natrium in Toluol oder Xylol. Die Reaktion zählt zu den Radikalreaktionen.
Übersichtsreaktion[Bearbeiten | Quelltext bearbeiten]
Bei der Acyloin-Kondensation reagieren zwei Ester zu einem Acyloin:
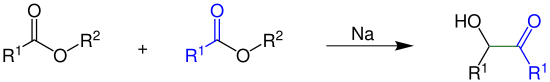
Die Reste R1 und R2 sind Organyl-Reste. Die grüne Bindung im Acyloin ist die neu geknüpfte Verbindung zwischen den beiden Estern.[1]
Mechanismus[Bearbeiten | Quelltext bearbeiten]
Der Mechanismus der Acyloin-Kondensation wird an dem obigen Beispiel erläutert.

Zuerst reagiert der Ester 1 mit Natrium zum Radikalanion 2, das mit einem weiteren Radikalanion zu dem Dianion 3 dimerisert. Durch Abspaltung von zwei Alkoholat-Resten (R2O−) entsteht ein Diketon 4, welches mit überschüssigem Natrium zum Dianion 5 reduziert wird. Dieses Dianion wird dann bei wässriger Aufarbeitung zum α-Hydroxyketon 6, dem Acyloin, hydrolysiert.[1][2]
Rühlmann-Variante[Bearbeiten | Quelltext bearbeiten]
Zur drastischen Verbesserung der Ausbeute kann Trimethylsilylchlorid (TMSCl) zugesetzt werden, das als Abfangreagenz für die basischen Alkoholate dient. Konkurrenzreaktionen werden so unterdrückt.[3]
Durch Hydrolyse der Silylether erhält man die Acyloine.

Intramolekulare Variante[Bearbeiten | Quelltext bearbeiten]
Auch die intramolekulare Variante (Prelog-Stoll-Cyclisierung) ist aus Edukten mit zwei Estergruppen möglich. Über diese Methode sind aus geeigneten Dicarbonsäurediestern entsprechende Ringsysteme zugänglich – je nach Kettenlänge des Einsatzmaterials. Die Ausbeuten für die cyclische Variante variieren in Bezug auf die Kettenlänge – einige Systeme bilden sich leichter als andere. Von präparativer Bedeutung ist vor allem die Bildung von größeren Ringen (10- oder 12-gliedrige) unter Anwendung des Ziegler-Ruggli-Verdünnungsprinzips. Die Gegenwart von Doppel- oder Dreifachbindungen im Kohlenstoffsystem stört die Reaktion im Allgemeinen nicht.

Catenane
Mittels der innermolekularen Variante lassen sich auch Catenane synthetisieren.
Literatur[Bearbeiten | Quelltext bearbeiten]
- Hans Beyer, Wolfgang Walter: Lehrbuch der Organischen Chemie. S. Hirzel Verlag, Stuttgart / Leipzig 1998, 23. überarb. und aktualisierte Auflage, ISBN 3-7776-0808-4.
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b Z. Wang: Comprehensive Organic Name Reactions and Reagents, 3 Volume Set. John Wiley & Sons, Hoboken, New Jersey 2009, ISBN 978-0-471-70450-8, S. 13.
- ↑ L. Kürti, B. Czakó: Stratigic Applications of Named Reactions in Organic Synthesis. Elsevier Academic Press, Amsterdam 2005, ISBN 978-0-12-429785-2, S. 4–5.
- ↑ K. Rühlmann: Die Umsetzung von Carbonsäureestern mit Natrium in Gegenwart von Trimethylchlorsilan. In: Synthesis. Nr. 5, 1971, S. 236–253, doi:10.1055/s-1971-21707.
