Kohlenstoff
| Eigenschaften | |||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Allgemein | |||||||||||||||||||||||||||||||||||||||||||||||||
| Name, Symbol, Ordnungszahl | Kohlenstoff, C, 6 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Elementkategorie | Nichtmetalle | ||||||||||||||||||||||||||||||||||||||||||||||||
| Gruppe, Periode, Block | 14, 2, p | ||||||||||||||||||||||||||||||||||||||||||||||||
| Aussehen | schwarz (Graphit) farblos (Diamant) gelbbraun (Lonsdaleit) dunkelgrau (Chaoit) | ||||||||||||||||||||||||||||||||||||||||||||||||
| CAS-Nummer | |||||||||||||||||||||||||||||||||||||||||||||||||
| EG-Nummer | 231-153-3 | ||||||||||||||||||||||||||||||||||||||||||||||||
| ECHA-InfoCard | 100.028.321 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Massenanteil an der Erdhülle | 0,087 % (13. Rang)[1] | ||||||||||||||||||||||||||||||||||||||||||||||||
| Atomar[2] | |||||||||||||||||||||||||||||||||||||||||||||||||
| Atommasse | 12,011 (12,0096 – 12,0116)[3][4] u | ||||||||||||||||||||||||||||||||||||||||||||||||
| Atomradius (berechnet) | 70 (67) pm | ||||||||||||||||||||||||||||||||||||||||||||||||
| Kovalenter Radius | 76 pm | ||||||||||||||||||||||||||||||||||||||||||||||||
| Van-der-Waals-Radius | 170 pm | ||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronenkonfiguration | [He] 2s2 2p2 | ||||||||||||||||||||||||||||||||||||||||||||||||
| 1. Ionisierungsenergie | 11.2602880(11) eV[5] ≈ 1086.45 kJ/mol[6] | ||||||||||||||||||||||||||||||||||||||||||||||||
| 2. Ionisierungsenergie | 24.383154(16) eV[5] ≈ 2352.62 kJ/mol[6] | ||||||||||||||||||||||||||||||||||||||||||||||||
| 3. Ionisierungsenergie | 47.88778(25) eV[5] ≈ 4620.47 kJ/mol[6] | ||||||||||||||||||||||||||||||||||||||||||||||||
| 4. Ionisierungsenergie | 64.49352(19) eV[5] ≈ 6222.68 kJ/mol[6] | ||||||||||||||||||||||||||||||||||||||||||||||||
| 5. Ionisierungsenergie | 392.090515(25) eV[5] ≈ 37831 kJ/mol[6] | ||||||||||||||||||||||||||||||||||||||||||||||||
| Physikalisch[2] | |||||||||||||||||||||||||||||||||||||||||||||||||
| Aggregatzustand | fest | ||||||||||||||||||||||||||||||||||||||||||||||||
| Modifikationen | 3 (u. a. Graphit (G) und Diamant (D)) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Kristallstruktur | G: hexagonal D: kubisch flächenzentriert | ||||||||||||||||||||||||||||||||||||||||||||||||
| Dichte | G: 2,26 g/cm3 D: 3,51 g/cm3[7] | ||||||||||||||||||||||||||||||||||||||||||||||||
| Mohshärte | G: 0,5 D: 10 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetismus | diamagnetisch (D: χm = −2,2 · 10−5;[8] G: χm bis −4,5 · 10−4[9]) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Sublimationspunkt | 3915[10] K (3642 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Molares Volumen | G: 5,31 · 10−6 m3/mol D: 3,42 · 10−6 m3·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Verdampfungsenthalpie | Sublimation: 715 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||
| Schallgeschwindigkeit | D: 18350 m·s−1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Spezifische Wärmekapazität | G: 709 J/(kg · K)[11] D: 427 J·kg−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Austrittsarbeit | 4,81 eV | ||||||||||||||||||||||||||||||||||||||||||||||||
| Chemisch[2] | |||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidationszustände | −4, −3, −2, −1, 0, 1, 2, 3, 4 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegativität | 2,55 (Pauling-Skala) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Isotope | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| Weitere Isotope siehe Liste der Isotope | |||||||||||||||||||||||||||||||||||||||||||||||||
| NMR-Eigenschaften | |||||||||||||||||||||||||||||||||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||||||||||||||||||||||||||||||||
Kohlenstoff (von urgerm. kul-a-, kul-ō(n)- ,Kohle‘) oder Carbon (von lat. carbō ,Holzkohle‘, latinisiert Carboneum oder Carbonium) ist ein chemisches Element mit dem Elementsymbol C und der Ordnungszahl 6. Im Periodensystem steht es in der vierten Hauptgruppe bzw. der 14. IUPAC-Gruppe oder Kohlenstoffgruppe sowie der zweiten Periode.
Es kommt in der Natur sowohl in gediegener (reiner) Form (Diamant, Graphit, Chaoit) als auch chemisch gebunden (z. B. in Form von Carbiden, Carbonaten, Kohlenstoffdioxid, Erdöl, Erdgas und Kohle) vor. Aufgrund seiner besonderen Elektronenkonfiguration (halbgefüllte L-Schale) besitzt es die Fähigkeit zur Bildung komplexer Moleküle und weist von allen chemischen Elementen die größte Vielfalt an chemischen Verbindungen auf. Diese Eigenschaft macht Kohlenstoff und seine Verbindungen zur Grundlage des Lebens auf der Erde.
Vorkommen

Kohlenstoff ist ein essenzielles Element der Biosphäre; es ist in allen Lebewesen – nach Sauerstoff (Wasser) – dem Gewicht nach das bedeutendste Element. Alles lebende Gewebe ist aus (organischen) Kohlenstoffverbindungen aufgebaut.
Geologisch dagegen zählt Kohlenstoff nicht zu den häufigsten Elementen, denn in der Erdkruste beträgt der Massenanteil von Kohlenstoff nur 0,027 %.[13]
In der unbelebten Natur findet sich Kohlenstoff sowohl elementar (Diamant, Graphit) als auch in Verbindungen. Die Hauptfundorte von Diamant sind Afrika (v. a. Südafrika und die Demokratische Republik Kongo) und Russland. Diamanten findet man häufig in vulkanischen Gesteinen wie Kimberlit. Graphit kommt relativ selten in kohlenstoffreichem metamorphem Gestein vor. Die wichtigsten Vorkommen liegen in Indien und China.
Mehr als die Hälfte des Kohlenstoffs liegt in Form von anorganischem Carbonatgestein vor[13] (ca. 2,8 · 1016 t). Carbonatgesteine sind weit verbreitet und bilden zum Teil Gebirge. Ein bekanntes Beispiel für Carbonat-Gebirge sind die Dolomiten in Italien. Die wichtigsten Carbonat-Mineralien sind Calciumcarbonat (Modifikationen: Kalkstein, Kreide, Marmor) CaCO3, Calcium-Magnesium-Carbonat (Dolomit) CaCO3 · MgCO3, Eisen(II)-carbonat (Eisenspat) FeCO3 und Zinkcarbonat (Zinkspat) ZnCO3.
Bekannte Kohlenstoffvorkommen sind die fossilen Rohstoffe Kohle, Erdöl und Erdgas. Diese sind keine reinen Kohlenstoffverbindungen, sondern Mischungen vieler verschiedener organischer Verbindungen. Sie entstanden durch Umwandlung pflanzlicher und tierischer Überreste unter hohem Druck. Wichtige Kohlevorkommen liegen in den USA, China und Russland, ein bekanntes deutsches im Ruhrgebiet. Die wichtigsten Erdölvorräte liegen auf der arabischen Halbinsel (Irak, Saudi-Arabien). Weitere wichtige Ölvorkommen gibt es im Golf von Mexiko und in der Nordsee. Über festes Methanhydrat in der Tiefsee ist noch wenig bekannt.
Kohlenstoff kommt weiterhin in der Luft als Kohlenstoffdioxid (kurz Kohlendioxid) vor. Kohlenstoffdioxid entsteht beim Verbrennen kohlenstoffhaltiger Verbindungen, bei der Atmung sowie vulkanisch und wird durch Photosynthese der Pflanzen verwertet. Auch in Wasser ist CO2 gelöst (ca. 0,01 % Massenanteil im Meer). Mit Stand 2015 waren ca. 830 Mrd. Tonnen Kohlenstoff in der Atmosphäre vorhanden. Da durch die Verbrennung fossiler Energieträger seit Beginn der Industrialisierung den Stoffflüssen in der Umwelt zuvor langfristig gebundenes CO2 hinzugefügt wird, steigt der Anteil an der Zusammensetzung der Luft sukzessive an. 2015 betrug der Anteil 400 ppm bzw. 0,04 %; ein Anstieg von ca. 120 ppm gegenüber dem vorindustriellen Wert von 280 ppm. Insgesamt wurden seit Beginn der Industrialisierung ca. 530 Mrd. Tonnen Kohlenstoff durch fossile Energieträger freigesetzt, von denen etwa knapp die Hälfte in der Atmosphäre verblieb und jeweils gut ein Viertel von Ozeanen und Landökosystemen aufgenommen wurde.[14]
Mengenmäßig ist der überwiegende Teil des Kohlenstoffs in der Gesteinshülle (Lithosphäre) gespeichert. Alle anderen Vorkommen machen mengenmäßig nur etwa 1/1000 des Gesamt-Kohlenstoffs aus.
Eigenschaften
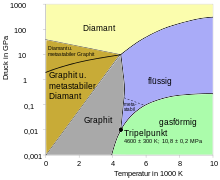
Physikalische Eigenschaften
Kohlenstoff kommt in mehreren allotropen Modifikationen vor. Alle Feststoffe auf Kohlenstoff-Basis lassen sich auf die beiden Grundtypen Diamant und Graphit zurückführen.
Im Diamant ist Kohlenstoff dreidimensional kovalent gebunden. Diamant ist ein Isolator und transparent. Er ist das härteste bekannte natürliche Material und wird als Schleifmittel eingesetzt.
Im Graphit ist die kovalente Bindung innerhalb der Basalebenen stärker als die beim Diamanten, während die Ebenen locker über Van-der-Waals-Kräfte gebunden sind. Die freien π-Elektronen sind verantwortlich für die tiefschwarze Farbe, die leichte Spaltbarkeit und die hohe Leitfähigkeit entlang der Basalebenen. Graphit dient als hochtemperaturbeständiges Dichtungsmaterial und Schmiermittel sowie als Grundstoff für Bleistiftminen.

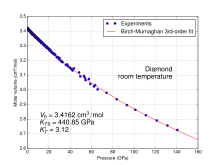
Im Gegensatz zur landläufigen Meinung sind die bekannten Schmiermitteleigenschaften von Graphit jedoch keine Eigenschaft von Graphit an sich, sondern werden nur in Gegenwart von Feuchtigkeitsspuren gefunden. In Vakuen oder sehr trockener Atmosphäre steigt der Reibungskoeffizient von Graphit daher drastisch an.[15]
Bei Normaldruck und Temperaturen unterhalb 4000 K ist Graphit die thermodynamisch stabile Modifikation des Kohlenstoff (siehe Phasendiagramm). Wegen der hohen Aktivierungsenergie ist auch Diamant bei Raumtemperatur stabil und wandelt sich erst oberhalb 500 °C merklich in Graphit um. Umgekehrt erfordert die Transformation von Graphit in Diamant einen Druck von mindestens 20.000 bar (2 GPa). Für eine ausreichend schnelle Reaktion sollte die Temperatur oberhalb von 1500 °C liegen, bei einem Druck von 60.000 bar entsprechend dem Phasendiagramm.
Kohlenstoff hat die höchste Temperaturbeständigkeit aller bekannten Materialien. Er sublimiert bei Normaldruck bei 3915 K (3642 °C),[10] ohne vorher an Festigkeit einzubüßen. Der Tripelpunkt liegt bei (10,8 ± 0,2) MPa und (4600 ± 300) K.[16][17]
Kohlenstoff ist diamagnetisch. Pyrolytisch abgeschiedener Graphit hat eine große Anisotropie in der magnetischen Suszeptibilität (parallel: = −85 · 10−6; senkrecht: = −450 · 10−6),[9] Diamant ist dagegen isotrop ( = −22 · 10−6).
In seinen verschiedenen Modifikationen zeigt Kohlenstoff sehr unterschiedliche Eigenschaften. Kohlenstoff ist das härteste Element: als kristalliner Diamant wird auf der Härteskala nach Knoop der absolute Höchstwert von 90 GPa erreicht. In der Form des Graphits ist Kohlenstoff nach Rubidium und Caesium mit 0,12 GPa das drittweichste Element. Kohlenstoff besitzt auch die höchste Wärmeleitfähigkeit, die bei Raumtemperatur weit über 2000 W/(m·K) liegt.[18]
Chemische Eigenschaften
Molekularer Kohlenstoff weist aufgrund seiner stabilen Konfiguration eine geringe chemische Aktivität auf. Er kann eine Reaktion eingehen, wenn dem Atom zusätzliche Energie zugeführt wird und die Elektronen der Außenhülle abbrechen müssen. In diesem Moment wird die Wertigkeit des Elements 4, und aus diesem Grund hat Kohlenstoff in Verbindungen eine Oxidationsstufe von +2, +4 und −4. Alle Reaktionen von Kohlenstoff mit Metallen und Nichtmetallen finden bei hohen Temperaturen statt. Dieses Element kann sowohl ein Oxidationsmittel als auch ein Reduktionsmittel sein. Die reduzierenden Eigenschaften von Kohlenstoff sind stark, so dass das Element in der Metallindustrie verwendet wird.
Die Fähigkeit von Kohlenstoff, chemische Reaktionen einzugehen, hängt von Faktoren wie der Reaktionstemperatur, der allotropen Modifikation und dem Dispersionsgrad ab. Er reagiert nicht mit Laugen und Säuren und sehr selten mit Halogenen. Eine der Haupteigenschaften von Kohlenstoff ist die Fähigkeit des Elements, lange Ketten zwischen sich zu bilden. Die Ketten schließen sich zyklisch und es bilden sich Verzweigungen. Auf diese Weise entstehen millionenfach organische Verbindungen. Diese Verbindungen können auch andere Elemente enthalten: Sauerstoff, Stickstoff, Schwefel, Phosphor, Halogene oder Metalle.[19]
Atommodell des Kohlenstoffs

Das Modell der Atom- und Molekülorbitale veranschaulicht, wie es zu der unterschiedlichen Ausprägung der Erscheinungsformen des Kohlenstoffs kommt.
Kohlenstoff besitzt sechs Elektronen. Nach dem Schalenmodell besetzen zwei Elektronen die innere 1s-Schale. Das 2s-Niveau der zweiten Schale nimmt ebenfalls zwei Elektronen auf, zwei weitere das 2px- und 2py- Niveau. Nur die vier äußeren Elektronen der zweiten Schale treten chemisch in Erscheinung. Die Aufenthaltswahrscheinlichkeit der Elektronen in einem s-Niveau ist kugelförmig. In einem p-Niveau ist sie anisotrop. Die Elektronen bevölkern einen sanduhrförmigen Raum, jeweils eine Sanduhrhälfte links und rechts vom Zentrum entlang der x-Achse, wenn man sich das Atom im Zentrum eines kartesischen Koordinatensystems platziert vorstellt. Senkrecht dazu stehen das py- und pz-Orbital (gemäß y- und z-Achse).
Diamant-Struktur (sp3)

Das 2s-Niveau kann mit den 3 2p-Niveaus hybridisieren und 4 energetisch gleichwertige sp3-Orbitale bilden. Dies kann man anschaulich so erklären, dass eines der s-Elektronen in das vorher leere p-Orbital gehoben wird und sich dabei die Orbitalenergien aller vier Orbitale der zweiten Stufe angleichen. Die neu entstehenden Orbitale besitzen eine langgestreckte, asymmetrische Tropfenform. Waren die Formen der p-Orbitale punktsymmetrisch zum Mittelpunkt angeordnet, erscheinen sie jetzt keulenartig in eine Richtung vergrößert. Das Bild veranschaulicht die Hauptkeulen, die Nebenkeulen wurden übersichtlichkeitshalber fortgelassen. Die vier sp3-Orbitale sind mit größtmöglichem Abstand zueinander symmetrisch im Raum orientiert, sie zeigen in die Ecken eines imaginären Tetraeders.
Überlappen sich die sp3-Orbitale von Atomen, können sie feste kovalente Bindungen bilden, die dann die tetraedrische Struktur widerspiegeln. Sie bilden das Grundgerüst des Diamantgitters (siehe Kristallstruktur dort.)
Graphit-Struktur (sp2)

Sind nur 2 der 3 p-Orbitale an der Hybridisierung beteiligt, entstehen die so genannten sp2-Orbitale. Die sp2- Orbitale richten sich zweidimensional (als Fläche bzw. Ebene) aus; ober- und unterhalb dieser Fläche formt das übrigbleibende p-Orbital jeweils einen Orbitallappen. Steht beispielsweise das p-Orbital senkrecht auf der xy-Ebene, liegen die sp2- Orbitale trigonal in der xy-Ebene. Sie haben den gleichen Winkel von 120° zueinander. Das Bild links veranschaulicht die Situation. Das unhybridisierte p-Orbital ist der Übersichtlichkeit halber weggelassen.
sp2-Kohlenstoff-Atome können miteinander kovalente Bindungen bilden, die dann in einer Ebene liegen. Ihre Struktur ist trigonal; dies ist die Grundstruktur der Planarebenen des Graphits (siehe Kristallgitterstruktur dort). Die übriggebliebenen p-Orbitale wechselwirken ebenfalls untereinander. Sie formen die pi-Bindungen mit deutlich geringeren Bindungsenergien als die sigma-Bindungen der sp2 beziehungsweise sp3-Orbitale und bilden ober- und unterhalb der sigma-Bindungsebene ein sogenanntes Elektronengas in Form atomrumpfunabhängiger („delokalisierter“) pi-Elektronen.
Chemisch spricht man von einer Doppelbindung. Die Schreibweise C=C vernachlässigt den unterschiedlichen Charakter beider Bindungen. Die Bindungsenergie der diamantartigen tetraedrischen sp3-Einfachbindung 'C–C' liegt bei 350 kJ/mol, die der graphitartigen trigonalen sp2-Doppelbindung C=C nur um 260 kJ/mol höher. In einem hexagonalen Kohlenstoff-Ring mit sechs Kohlenstoff-Atomen stabilisiert sich die pi-Bindung durch Delokalisierung der Elektronen innerhalb des Rings (mehr dazu siehe Benzol).
Dreifachbindung (sp1)
Wenn nur ein p-Orbital mit dem s-Orbital hybridisiert, ergeben sich zwei linear angeordnete pi-Bindungskeulen. Orientieren wir sie entlang der x-Achse, liegen die verbliebenen p-Orbitale auf den y- und z-Achsen. Zwei sp-hybridisierte Atome können eine Kohlenstoff-Dreifachbindung formen. Ein Beispiel ist das Gas Ethin (Acetylen) HC ≡ CH. Während sp3-Bindungen dreidimensionale Strukturen formen und sp2 zweidimensionale, bilden sp1-Bindungen höchstens eindimensionale (lineare) Ketten, wie zum Beispiel H–C≡C–C≡C–H.
Erscheinungsformen des Kohlenstoffs

Elementarer Kohlenstoff existiert in drei Modifikationen, basierend auf den Bindungsstrukturen sp3 und sp2: Diamant, Graphit und Fulleren.
Neben diesen drei Modifikationen gibt es weitere unterschiedliche Formen elementaren Kohlenstoffs.
Modifikationen
Graphit
Die sp2-kovalent hexagonal gebundenen Kohlenstoff-Atome formen hochfeste Ebenen. Die Ebenen untereinander sind nur locker über Van-der-Waals-Kräfte gebunden. Makroskopisch dominiert die Spaltbarkeit entlang der Planarebenen. Da die Ebenen so dünn sind, tritt ihre außerordentliche Festigkeit bei Graphit nicht in Erscheinung.
Wegen dieser Struktur verhält sich Graphit sehr anisotrop: Entlang der Kristallebenen ist Graphit thermisch und elektrisch sehr leitfähig, Wärmeleitung oder Ladungsübertragung von Kristallebene zu Kristallebene funktioniert hingegen relativ schlecht.
Diamant

Die sp3-kovalent tetragonal gebundenen Kohlenstoff-Atome besitzen keine freien Elektronen. Das Material ist ein Isolator mit einer Bandlücke von 5,45 eV, der sichtbares Licht nicht absorbiert. Zugabe von Fremdatomen erzeugt Zustände in der Bandlücke und verändert somit die elektrischen und optischen Eigenschaften. So ist der gelbliche Ton vieler natürlicher Diamanten auf Stickstoff zurückzuführen, während mit Bor dotierte Diamanten bläulich aussehen und halbleitend sind. Der Diamant wandelt sich unter Luftabschluss bei Temperaturen um 1500 °C in Graphit um. Er verbrennt bereits bei ungefähr 700–800 °C zu Kohlendioxid.
Diamant gilt unter Normalbedingungen (1 bar, 25 °C) gemeinhin als die metastabile Form des Kohlenstoffes. Aufgrund neuerer Forschung ist dies aber nicht mehr sicher, weil
- die thermodynamische Stabilität zu niedrigen P-T-Bedingungen lediglich extrapoliert ist,
- bei Gleichgewichtsuntersuchungen der Einfluss der Umgebung – geringe Spuren von Verunreinigungen, die unterhalb der heutigen Detektionsgrenze liegen, können bereits drastische Auswirkungen auf die Gleichgewichtslage einer Reaktion haben – nicht berücksichtigt wurde/wird[20][21] und schließlich
- Experimente chinesischer Wissenschaftler zeigen, dass in einer Reaktion zwischen metallischem Natrium und Magnesiumcarbonat Kohlenstoff und Diamant stabil nebeneinander koexistieren.
Lonsdaleit
Lonsdaleit, auch als hexagonaler Diamant bezeichnet, ist eine sehr seltene Modifikation des Diamanten. Er entsteht, wenn Graphit durch Schockereignisse, das heißt hohen Druck und hohe Temperatur wie beispielsweise durch Impaktereignisse, in Diamant umgewandelt wird. Dabei bleibt der hexagonale Charakter der Kristallstruktur erhalten, jedes Kohlenstoffatom ist jedoch im Gegensatz zu Graphit an vier weitere kovalent gebunden.
Chaoit
Chaoit ist eine sehr seltene Modifikation, die ähnlich wie Graphit im hexagonalen Kristallsystem kristallisiert, jedoch mit anderen Gitterparametern und leicht abweichender Kristallstruktur. Er entsteht ähnlich wie Lonsdaleit durch Schock-Metamorphose in graphitischem Gneis.
Fullerene

Ein reguläres hexagonales Wabenmuster, wie es die C-Atome in den Basalebenen des Graphits ausbilden, ist planar. Ersetzt man einige Sechsecke durch Fünfecke, entstehen gekrümmte Flächen, die sich bei bestimmten relativen Anordnungen der Fünf- und Sechsringe zu geschlossenen Körpern „aufrollen“. In den Fullerenen sind derartige Strukturen realisiert. Die sp2-Bindungen liegen dabei nicht mehr in einer Ebene, sondern bilden ein räumlich geschlossenes Gebilde. Die kleinste mögliche Struktur besteht nur noch aus Fünfecken und erfordert 20 Kohlenstoff-Atome, der dazugehörige Körper ist ein Pentagon-Dodekaeder. Dieses einfachste Fulleren ist bislang aber nur massenspektrometrisch nachgewiesen worden. Eines der stabilsten Fullerene besteht aus 60 Kohlenstoff-Atomen und enthält neben Sechsecken nur Fünfecke, die mit keinem anderen Fünfeck eine gemeinsame Kante besitzen. Das so entstehende Muster (abgestumpftes Ikosaeder, ein archimedischer Körper) gleicht dem Muster auf einem (altmodischen) Fußball. Es wird zu Ehren von Richard Buckminster Fuller als Buckminster-Fulleren bezeichnet. Die Molekül-„Kugeln“ der Fullerene sind untereinander über relativ schwache Van-der-Waals-Wechselwirkungen gebunden, ähnlich wie die Basalebenen im Graphit. Mittlerweile sind etliche Fullerene unterschiedlicher Größe isoliert und teilweise auch kristallisiert worden; sie können daher als echte Modifikation(en) gelten. Fullerene kommen vermutlich in allen Rußen vor, so zum Beispiel auch in dem Ruß über Kerzenflammen.

Cyclocarbone
Cyclo[18]carbon ist eine 2019 entdeckte cyclische Modifikation des Kohlenstoffs mit der Summenformel C18 aus der Gruppe der Cyclocarbone, die bei tiefen Temperaturen nahe dem absoluten Nullpunkt stabil ist.[22]
Weitere Formen des Kohlenstoffs
Amorpher Kohlenstoff
In amorphem Kohlenstoff (a-C) sind die Atome ohne langreichweitige Ordnung vernetzt. Das Material lässt sich mit nahezu beliebigen sp2:sp3-Hybridisierungsverhältnissen herstellen, wobei die Materialeigenschaften fließend von denen des Graphits zu denen des Diamanten übergehen. In der Industrie wird in diesem Fall häufig der Begriff Diamond-like Coating oder Diamond-like Carbon (DLC) verwendet. Bei einem sp3-Hybridisierungsanteil von über 70 % spricht man von tetraedrisch amorphem Kohlenstoff (ta-C). Dieses Material zeichnet sich durch hohen elektrischen Widerstand, extreme Härte und optische Transparenz aus. Die Herstellung kann mittels PVD- oder PECVD-Methoden erfolgen. Das Material wird dabei als Schicht abgeschieden (amorphe Kohlenstoffschicht).
Kohlenstoff-Fasern
Kohlenstoff-Fasern bestehen aus graphitartig sp2-gebundenem Kohlenstoff. Isotrope Fasern verhalten sich ähnlich wie polykristalliner Graphit und besitzen nur geringe Festigkeiten. Fasermatten und -bündel werden für Wärmedichtungen eingesetzt. Durch Strecken bei der Herstellung ist es möglich, die Basalebenen entlang der Faserachse auszurichten. Man erhält hochfeste Fasern mit Eigenschaften, die den theoretischen Werten von Graphit entlang der Basalebenen nahekommen. Anisotrope Kohlenstofffasern sind leicht, außerordentlich steif und fest und werden in Verbundwerkstoffen genutzt.
Glaskohlenstoff

Glaskohlenstoff („Glassy Carbon“) ist ein hochtechnologischer Werkstoff aus reinem Kohlenstoff, der glasartige und keramische Eigenschaften mit denen des Graphits vereint. Im Gegensatz zu Graphit besitzt Glaskohlenstoff eine fullerenartige Mikrostruktur. Dadurch ergibt sich eine große Vielfalt positiver Materialeigenschaften. Die Leitfähigkeit ist zum Beispiel geringer als bei Graphit.
Graphen

Als Graphen bezeichnet man eine Graphit-Basalebene von sp2-hybridisiertem Kohlenstoff. Man erhält die dünnen Schichten durch chemisches Spalten von Graphit. Eingebettet in Kunststoffen eignet es sich als Ausgangsmaterial für neue Verbundwerkstoffe oder für Untersuchungen von zweidimensionalen Kristallen, außerdem wird an Anwendungen in der Elektronik geforscht.
Aktivkohle

Behutsames Graphitieren von organischen Materialien, wie zum Beispiel Kokosnuss-Schalen, führt zu einem porösen Kohlenstoff. Die Hohlräume stehen wie bei einem Schwamm miteinander in Verbindung und bilden eine sehr große innere Oberfläche. Aktivkohle filtert gelöste Stoffe in geringer Konzentration aus Flüssigkeiten und kann Gase adsorbieren.
Ruß
Ruß besteht ebenfalls aus Kohlenstoff auf Graphitbasis. Je reiner der Ruß, desto deutlicher treten die Eigenschaften von Graphit hervor. Lampen- oder Kerzenruß ist stark mit organischen Verbindungen verunreinigt, die die Bildung größerer Graphit-Verbände verhindern.
Kohlenstoffnanoröhren
Eine weitere Form von Kohlenstoff sind zylindrisch angeordnete, sp2-hybridisierte Kohlenstoffatome. Ihre Geometrie entsteht aus einer planaren Schicht Graphit, die zu einem Zylinder aufgerollt wird. Die entstandene Röhre kann zusätzlich noch verdreht sein, wodurch sich die elektrischen Eigenschaften ändern. Es können mehrere einwandige Röhren konzentrisch ineinander liegen, so dass man von multiwalled carbon nanotubes (MWCNT) spricht, im Gegensatz zu single-walled carbon nanotubes (SWCNT).
Carbon nanobuds
Carbon nanobuds kombinieren die Eigenschaften von Kohlenstoffnanoröhren und Fullerenen.
Kohlenstoffnanoschaum
Kohlenstoffnanoschaum, ein Aerogel, ist eine zufällig orientierte, netzartige Anordnung von Kohlenstoff-Graphitebenen. Er ähnelt dem Glaskohlenstoff, nur mit deutlich größeren vernetzten Hohlräumen. Ihr durchschnittlicher Durchmesser liegt bei sechs bis neun Nanometern.
Davon zu unterscheiden ist Kohlenstoff-Aerogel, das aus zusammengewachsenen Nanopartikeln besteht. Seine Dichte liegt bei 200 bis 1000 kg/m3.
Aerographit
Aerographit besteht aus einem Netzwerk poröser Kohlenstoffröhrchen und ist mit einer Dichte von 0,2 Milligramm pro Kubikzentimeter einer der leichtesten Feststoffe der Welt. Aerographit lässt sich um bis zu 95 % komprimieren und wieder in die ursprüngliche Form auseinanderziehen.
Nicht-graphitischer Kohlenstoff
„Nicht-graphitischer Kohlenstoff besteht aus Schichten von hexagonal angeordneten, sp2-hybridisierten Kohlenstoffatomen. Diese Schichten sind ohne jegliche dreidimensionale Fernordnung annähernd parallel gestapelt.“[23] Dieses Material besteht aus gegeneinander verdrehten und verschobenen Stapeln aus Graphenschichten. Diese Anordnung wird auch als turbostratisch bezeichnet. Hierbei kann der Abstand der Schichten untereinander deutlich von dem in Graphit gefundenen Schichtabstand abweichen. Die Mikrostrukturanalyse des Materials ist unter anderem mittels WAXS möglich, aufgrund der durch die signifikante Unordnung bedingten breiten und sich überlappenden Maxima können jedoch Standard-Verfahren wie die Scherrer-Gleichung nicht angewandt werden.
Carbin (Perlenketten)
Innerhalb doppelwandiger Nanoröhrchen ist es im Jahre 2016 gelungen, als Carbin bezeichnete geradlinige Ketten zu synthetisieren, die aus mehr als 6000 Atomen bestehen.[24]
Q-carbon
Q-Carbon ist eine künstlich hergestellte diamantartige allotrope Form des Kohlenstoffs, die als ferromagnetisch und härter als Diamant beschrieben wird.
Dikohlenstoff
Dikohlenstoff C2, ein Molekül aus zwei Kohlenstoffatomen, gehört zu den am häufigsten vorkommenden Molekülen im Universum. Es verfügt über ein reichhaltiges Spektrum mit 19 Ein-Photonen-Bandsystemen im infrarotem, sichtbaren and ultravioletten Bereich. William Hyde Wollaston berichtete 1802 über die Emissionsspektren von blauen Flammen. Damit war das Spektrum eines der ersten, das beschrieben wurde.[25] Es kommt in allen Flammen vor, bei denen kohlenstoffhaltige Substanzen verbrannt werden und ist die Ursache der blauen Farbe im Innern einer Kerzenflamme.[26] Dikohlenstoff wurde in einer Vielzahl von astronomischen Objekten beobachtet, darunter in Sternen, zirkumstellaren Hüllen, Nebeln, Kometen und im interstellaren Medium. Es ist für die grüne Farbe von Kometen verantwortlich, wird aber nicht im Kometenschweif beobachtet.[25][27] Dikohlenstoff besitzt kein permanentes elektrisches Dipolmoment und bildet sich durch Kollision von atomarem Kohlenstoff.[28]
Trikohlenstoff
Trikohlenstoff C3 ist ein Molekül von seltenem Vorkommen. Es wurde im interstellaren Raum hauptsächlich in den Schweifen von Kometen wie Hale-Bopp nachgewiesen.[29] Sein Spektrallinien bei 4050 Å wurden bereits 1881 von William Huggins im Kometen C/1881 K1 entdeckt.[30][31] Aber es dauerte mehr als achtzig Jahre, bis 1951 Alexander Edgar Douglas (1916–1981) diese Linien als C3-Emissionen identifizierte.[32] 1988 wurde die Verbindung auch im Spektrum des Kohlenstoffsterns IRC + 10216 nachgewiesen.[33]
Harter Kohlenstoff
Harter Kohlenstoff (englisch hard carbon) ist eine feste Form von Kohlenstoff mit geringer Dichte und extrem hoher Mikroporosität, die selbst bei Temperaturen bis zu 3000° Celsius nicht in Graphit umgewandelt werden kann.
Verbindungen
Kohlenstoff ist das Element, das nach Wasserstoff die meisten Verbindungen aller Elemente bilden kann (Wasserstoff steht an erster Stelle, weil die meisten Kohlenstoffverbindungen auch Wasserstoff enthalten). Besonderheiten des Kohlenstoffs sind es, Ketten und Ringe mit sich selbst und anderen Elementen sowie Doppel- und Dreifachbindungen unter Beteiligung von π-Orbitalen zu bilden. Aufgrund seiner mittelstarken Elektronegativität hat er ein gutes Bindungsvermögen sowohl zu elektropositiveren als auch zu elektronegativeren Elementen. Alle Oxidationsstufen von −IV bis +IV kommen in der Natur in anorganischen oder organischen Verbindungen vor.
Kohlenstoffverbindungen werden traditionell bis auf wenige Ausnahmen zur organischen Chemie gezählt; diese wird auch manchmal als Chemie des Kohlenstoffs bezeichnet. Die organische Chemie umfasst, aufgrund der Fähigkeit des Kohlenstoffs, lange Ketten und kovalente Bindungen mit anderen Atomen zu bilden, mehr Verbindungen als die gesamte anorganische Chemie. Auch die Biochemie ist ein Teil der organischen Kohlenstoffchemie. Zu den einfachsten organischen Verbindungen zählen die Alkane Methan und Ethan.
Nur relativ wenige Kohlenstoffverbindungen werden traditionell zu den anorganischen Verbindungen gestellt, darunter mengenmäßig am bedeutendsten die Sauerstoff-Verbindungen:
- Carbide, Kohlenstoff-Element-Verbindungen des Typs ExCy, bei denen der Kohlenstoff der elektronegativere Reaktionspartner ist. Viele Metalle können Carbide bilden, die teilweise sehr hart sind und für Schneidwerkzeuge (z. B. Wolframcarbid) verwendet werden.
- Kohlenstoffmonoxid CO ist ein sehr giftiges Gas, das stark reduzierend wirkt und bei der Metallverhüttung (z. B. Eisen) eine wichtige Rolle spielt.
- Kohlenstoffdioxid CO2 ist ein durch viele Verbrennungsvorgänge entstehendes Treibhausgas. Es wird von den meisten Lebewesen ausgeatmet und von Pflanzen in der Photosynthese verwendet. Kohlenstoffdioxid ist inzwischen zu etwa 0,04 % Bestandteil der Atmosphäre, in der vorindustriellen Aera betrug der Anteil 0,028 %.
- Kohlensäure H2CO3 ist ein metastabiles Produkt aus Wasser und im Wasser gelöstem CO2; eine mittelstarke Säure, die aber bezüglich der ständigen Umwandlung zwischen Kohlensäure und gelöstem CO2 meist mit dem CO2 zusammengefasst wird.
- Suboxide wie Trikohlenstoffdioxid (Malonsäureanhydrid, C3O2), Tetrakohlenstoffdioxid (C4O2), Pentakohlenstoffdioxid (C5O2), Oxalsäureanhydrid (C4O6) und Mellitsäureanhydrid (C12O9).
- Hydrogencarbonate oder Bicarbonate E+ HCO3−, deren bekanntester Vertreter Natriumhydrogencarbonat unter anderem als Backtriebmittel verwendet wird.
- Carbonate E2+ CO32− sind die zweiwertigen Salze der Kohlensäure. Die beiden bekanntesten Carbonate sind Natriumcarbonat, Trivialname Soda, ein wichtiger Grundstoff für die Glasherstellung, und Calciumcarbonat, aus dem z. B. Muscheln, Schnecken ihre Schalen aufbauen und das Steinkorallen abscheiden. Das von ihnen und durch andere Prozesse über lange Zeiträume gebildete Calciumcarbonat bildet heute ganze Gebirge (siehe: Kalkstein). Calciumcarbonat ist weiterhin ein wichtiger Baustoff.
- Kohlenstoff-Schwefel-Verbindungen, von denen die bekannteste Verbindung Kohlenstoffdisulfid (Schwefelkohlenstoff, CS2), eine sehr giftige Flüssigkeit, ist.
- Kohlenstoff-Stickstoff-Verbindungen, wie die Cyanide, deren bekanntester Vertreter Kaliumcyanid ein sehr starkes, die Atmung blockierendes Gift ist. Viele andere Cyanide sind ähnlich giftig.
Isotope
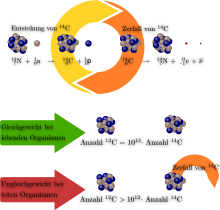
Es sind insgesamt 15 Isotope zwischen 8C und 23C des Kohlenstoffs bekannt. Von diesen sind zwei, die Isotope 12C und 13C stabil und kommen in der Natur vor. Das Isotop mit dem größeren Anteil an der natürlichen Isotopenzusammensetzung ist 12C mit 98,93 %, 13C hat einen Anteil von 1,07 %. Die langlebigsten instabilen Isotope sind 11C, das mit einer Halbwertszeit von 20,364 Minuten unter β+-Strahlung in 11B übergeht und 14C, das mit einer Halbwertszeit von 5730 Jahren unter Betazerfall zu 14N zerfällt. Alle anderen Isotope haben nur kurze Halbwertszeiten von Sekunden oder Millisekunden.[34]
12C ist laut Definition der Bezugspunkt für die Einheit der Atommasse. 13C kann man in NMR-spektroskopischen Untersuchungen detektieren, da es, anders als 12C, über ein magnetisches Moment verfügt. Das Verhältnis dieser beiden Isotope heißt Δ13C und wird in der Geochemie, Paläoklimatologie und Paläozeanographie benutzt. Die grundsätzliche Annahme, dass sich Isotope desselben Elements chemisch exakt identisch verhalten, trifft insbesondere auf biologische Prozesse mit leichten Elementen nicht vollständig zu, und so können verschiedene Daten aus diesem Wert abgeleitet werden, unter anderem ob ein Organismus bevorzugt C3-Pflanzen oder C4-Pflanzen isst.[35]
14C entsteht durch die Reaktion von 14N mit kosmischer Strahlung. Die üblicherweise stattfindende Reaktion ist dabei 14N(n,p)14C. Es trifft also ein Neutron auf Stickstoff-14 (das häufigste Stickstoffisotop) und es wird ein Proton ausgestoßen, wobei Kohlenstoff-14 entsteht. Die Reaktion ist exotherm und hat einen relativ großen Wirkungsquerschnitt sowohl mit schnellen als auch mit thermischen Neutronen. Lebewesen, die am Kohlenstoffzyklus teilnehmen, zeigen den gleichen Anteil an 14C bezüglich der gesamten enthaltenen Kohlenstoffmenge wie die Atmosphäre. Nach dem Ende des Stoffwechsels, also beispielsweise nach der Fällung eines Baums, verringert sich dieser Anteil allmählich durch den radioaktiven Zerfall. Die Bestimmung des Anteils von 14C zum gesamten Kohlenstoffgehalt erlaubt daher eine Altersbestimmung an Gegenständen aus organischem Material, die Radiokarbonmethode, die vor allem in der Archäologie Verwendung findet. Während näherungsweise eine konstante Produktion von 14C in der Hochatmosphäre angenommen werden kann, sind inzwischen historische Abweichungen nach oben bekannt und durch Quervergleich mit dendrochronologisch datierten Objekten gut bestätigt.[36] Durch atmosphärische Kernwaffentests ist der Gehalt der Erdatmosphäre an 14C messbar gestiegen,[37] jedoch wird dieser Effekt durch die „Verdünnung“ mit CO2 aus fossilen Quellen teilweise ausgeglichen, wie im Folgenden erläutert wird.[38]
Aus Erdgas oder Erdöl gewonnenes, und aus dem Erdmantel stammendes CO2 enthält so gut wie kein 14C, das mit einer Halbwertszeit von 5730 Jahren zerfällt, im Vergleich zum CO2 aus der Luft, wo das 14C-Isotop laufend nachgebildet wird. 14C kann daher als eine Art Tracer verwendet werden, um mithilfe von Szintillationsspektrometern den Weg oder den Gehalt von Molekülen, die auf Erdöl basieren oder aus dem Erdmantel stammen, in Pflanzen zu bestimmen. Beispielsweise den CO2-Transport in der Atmungskette.
Das kurzlebige Isotop 11C findet Anwendung als PET-Nuklid. Dazu wird es an einem Zyklotron erzeugt und mittels geeigneter chemischer Verfahren zu Radiopharmaka wie [11C]-Cholin umgesetzt.
Obwohl Kohlenstoff aufgrund seines niedrigen Wirkungsquerschnittes für Neutroneneinfang ein exzellenter Neutronenmoderator ist, so ist nach einigen Jahren oder gar Jahrzehnten Einsatz in einem graphitmoderierten Reaktor durch Neutroneneinfang der Gehalt an 13C, aber auch 14C messbar erhöht. Führte dies in der Vergangenheit zur Notwendigkeit der Entsorgung als „Atommüll“ so ist in jüngerer Zeit unter dem Begriff Diamantbatterie die Nutzbarmachung als Radionuklidbatterie zwar geringer Leistung, aber sehr langer Lebensdauer im Gespräch.[39]
Literatur
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 861–918.
- N.N. Greenwood, A. Earnshaw: Chemie der Elemente. 1. Auflage. VCH Verlagsgesellschaft, Weinheim 1988, ISBN 3-527-26169-9, S. 327–419.
Weblinks
Einzelnachweise
- ↑ Harry H. Binder: Lexikon der chemischen Elemente. S. Hirzel Verlag, Stuttgart 1999, ISBN 3-7776-0736-3.
- ↑ Die Werte für die Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus www.webelements.com (Kohlenstoff) entnommen.
- ↑ Angegeben ist der von der IUPAC empfohlene Standardwert, da die Isotopenzusammensetzung dieses Elements örtlich schwanken kann, ergibt sich für das mittlere Atomgewicht der in Klammern angegebene Massenbereich. Siehe: Michael E. Wieser, Tyler B. Coplen: Atomic weights of the elements 2009 (IUPAC Technical Report). In: Pure and Applied Chemistry, 2010, S. 1 (doi:10.1351/PAC-REP-10-09-14).
- ↑ IUPAC, Standard Atomic Weights Revised 2013.
- ↑ a b c d e Eintrag zu carbon in Kramida, A., Ralchenko, Yu., Reader, J. und NIST ASD Team (2019): NIST Atomic Spectra Database (ver. 5.7.1). Hrsg.: NIST, Gaithersburg, MD. doi:10.18434/T4W30F (physics.nist.gov/asd). Abgerufen am 11. Juni 2020.
- ↑ a b c d e Eintrag zu carbon bei WebElements, www.webelements.com, abgerufen am 11. Juni 2020.
- ↑ A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 864.
- ↑ Robert C. Weast (Hrsg.): CRC Handbook of Chemistry and Physics. CRC (Chemical Rubber Publishing Company), Boca Raton 1990, ISBN 0-8493-0470-9, S. E-129 bis E-145. Werte dort sind auf g/mol bezogen und in cgs-Einheiten angegeben. Der hier angegebene Wert ist der daraus berechnete maßeinheitslose SI-Wert.
- ↑ a b M. D. Simon, A. K. Geim: Diamagnetic levitation: Flying frogs and floating magnets. In: Journal of Applied Physics. 87, 2000, S. 6200–6204 (doi:10.1063/1.372654).
- ↑ a b David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Properties of the Elements and Inorganic Compounds, S. 4-8.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Properties of the Elements and Inorganic Compounds, S. 4-135.
- ↑ a b Eintrag zu Kohlenstoff in der GESTIS-Stoffdatenbank des IFA, abgerufen am 30. April 2017. (JavaScript erforderlich)
- ↑ a b Theodore L. Brown, H. Eugene Le May, Bruce E. Bursten: Chemie Die zentrale Wissenschaft. MZ Pearson Studium Deutschland GmbH, München 2007, ISBN 978-3-8273-7191-1, S. 1123.
- ↑ Markus Reichstein: Universell und Überall. Der terrestrische Kohlenstoffkreislauf im Klimasystem. In: Jochem Marotzke, Martin Stratmann (Hrsg.): Die Zukunft des Klimas. Neue Erkenntnisse, neue Herausforderungen. Ein Report der Max-Planck-Gesellschaft. Beck, München 2015, ISBN 978-3-406-66968-2, S. 125–127.
- ↑ Bing K. Yen, Birgit E. Schwickert: Origin of low-friction behavior in graphite investigated by surface x-ray diffraction. (PDF; 215 kB), Mai 2004.
- ↑ A. Greenville Whittaker: The controversial carbon solid–liquid–vapour triple point. In: Nature. Band 276, 1978, S. 695–696, doi:10.1038/276695a0.
- ↑ J. M. Zazula: On Graphite Transformations at High Temperature and Pressure Induced by Absorption of the LHC Beam. (PDF) CERN, 1997, abgerufen am 6. Juni 2009.
- ↑ GIT Labor-Fachzeitschrift. Heft 9/2013, S. 596, nach Jürgen Quadbeck-Seeger (Hrsg.): Chemie Rekorde. Wiley-VCH.
- ↑ MEL Science: Properties and characteristics of carbon, and its reactions with oxygen (Memento vom 4. August 2019 im Internet Archive)
- ↑ M. A. Carpenter: Thermodynamics of phase transitions in minerals: a macroscopic approach. In: Stability of Minerals. Chapman & Hall, London 1992.
- ↑ E. Salje: Phase transitions in ferroelastic and coelastic Crystals. Cambridge University Press, Cambridge 1990.
- ↑ Katharina Kaiser, Lorel M. Scriven, Fabian Schulz, Przemyslaw Gawel, Leo Gross, Harry L. Anderson: An sp-hybridized molecular carbon allotrope, cyclo[18]carbon. In: Science. 2019, S. eaay1914, doi:10.1126/science.aay1914.
- ↑ Übersetzung aus E. Fitzer, K.-H. Kochling, H. P. Boehm, H. Marsh: Recommended Terminology for the Description of Carbon as a Solid (IUPAC Recommendations 1995). In: Pure and Applied Chemistry, 1995, 67, S. 473–506 (doi:10.1351/pac199567030473): "Non-graphitic carbons consists of layers of hexagonally arranged sp2-carbon atoms that are stacked nearly parallel without any three-dimensional long-range order.”
- ↑ Chemie: Rekordlänge: Kohlenstoff als Perlenkette. auf: orf.at, 4. April 2016, abgerufen am 4. April 2016.
- ↑ a b Timothy W. Schmidt: The Spectroscopy of C2 : A Cosmic Beacon. In: Accounts of Chemical Research. Band 54, Nr. 3, 2021, S. 481–489, doi:10.1021/acs.accounts.0c00703.
- ↑ Paul Scherrer Institut: Ein dunkler Zustand schafft Klarheit, abgerufen am 4. September 2023
- ↑ Jasmin Borsovszky, Klaas Nauta, Jun Jiang, Christopher S. Hansen, Laura K. McKemmish, Robert W. Field, John F. Stanton, Scott H. Kable, Timothy W. Schmidt: Photodissociation of dicarbon: How nature breaks an unusual multiple bond. In: Proceedings of the National Academy of Sciences. Band 118, Nr. 52, 2021, doi:10.1073/pnas.2113315118, PMID 34930845.
- ↑ James F. Babb, R. T. Smyth, B. M. McLaughlin: Dicarbon Formation in Collisions of Two Carbon Atoms. In: The Astrophysical Journal. Band 876, Nr. 1, 2019, S. 38, doi:10.3847/1538-4357/ab1088.
- ↑ Samir F. Matar, Jean Etourneau, Vladimir L. Solozhenko: First-principles investigations of tricarbon: From the isolated C3 molecule to a novel ultra-hard anisotropic solid. In: Carbon Trends. Band 6, 2022, S. 100132, doi:10.1016/j.cartre.2021.100132.
- ↑ Huggins, William: Preliminary note on the photographic spectrum of comet b 1881. In: Proceedings of the Royal Society of London. Band 33, Nr. 216–219, 1882, S. 1–3, doi:10.1098/rspl.1881.0060.
- ↑ Cometary Spectra. In: Nature. Band 182, Nr. 4635, 1958, S. 564–565, doi:10.1038/182564d0.
- ↑ A. E. Douglas: Laboratory Studies of the λ 4050 Group of Cometary Spectra. In: The Astrophysical Journal. Band 114, 1951, S. 466, doi:10.1086/145486 (harvard.edu).
- ↑ Kenneth W. Hinkle, John J. Keady, Peter F. Bernath: Detection of C 3 in the Circumstellar Shell of IRC+10216. In: Science. Band 241, Nr. 4871, 1988, S. 1319–1322, doi:10.1126/science.241.4871.1319.
- ↑ G. Audi, F. G. Kondev, Meng Wang, W.J. Huang, S. Naimi: The NUBASE2016 evaluation of nuclear properties. In: Chinese Physics C. 41, 2017, S. 030001, doi:10.1088/1674-1137/41/3/030001 (Volltext).
- ↑ A Hope Jahren, Christopher Saudek, Edwina H Yeung, WH Linda Kao, Rebecca A Kraft, Benjamin Caballero: An isotopic method for quantifying sweeteners derived from corn and sugar cane1–32. In: The American Journal of Clinical Nutrition. Band 84, Nr. 6, 2006, S. 1380–1384, doi:10.1093/ajcn/84.6.1380.
- ↑ Fusa Miyake, Kentaro Nagaya, Kimiaki Masuda, Toshio Nakamura: A signature of cosmic-ray increase in ad 774–775 from tree rings in Japan. In: Nature. Band 486, Nr. 7402, 2012, S. 240–242, doi:10.1038/nature11123.
- ↑ William A. Marshall, W. Roland Gehrels, Mark H. Garnett, Stewart P. H. T. Freeman, Colin Maden, Sheng Xu: The use of ‘bomb spike’ calibration and high-precision AMS 14C analyses to date salt-marsh sediments deposited during the past three centuries. In: Quaternary Research. Band 68, Nr. 3, 2007, S. 325–337, doi:10.1016/j.yqres.2007.07.005.
- ↑ Manuela Capano, Fabio Marzaioli, Carmina Sirignano, Simona Altieri, Carmine Lubritto, Antonio D’Onofrio, Filippo Terrasi: 14C AMS measurements in tree rings to estimate local fossil CO2 in Bosco Fontana forest (Mantova, Italy). In: Nuclear Instruments and Methods in Physics Research Section B: Beam Interactions with Materials and Atoms. Band 268, Nr. 7, 2010, S. 1113–1116.
- ↑ Diamant-Akku aus nuklearem Abfall soll 28.000 Jahre halten. In: derstandard.de. 31. März 2021, abgerufen am 27. März 2023 (österreichisches Deutsch).
