Catechol-O-Methyltransferase
| Catechol-O-Methyltransferase | ||
|---|---|---|

| ||
| Bändermodell von menschlicher S-COMT im Komplex mit 3,5-Dinitrocatechol (blau) and S-Adenosylmethionin (gelb) | ||
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 271 Aminosäuren, 30.037 Da | |
| Kofaktor | SAM | |
| Isoformen | löslich, membrangebunden | |
| Bezeichner | ||
| Gen-Name | COMT | |
| Externe IDs | ||
| Enzymklassifikation | ||
| EC, Kategorie | 2.1.1.6, Methyltransferase | |
| Reaktionsart | Übertragung einer Methylgruppe | |
| Substrat | S-Adenosylmethionin + Catecholamin | |
| Produkte | S-Adenosyl-L-Homocystein + Guajacol-Derivat | |
| Vorkommen | ||
| Homologie-Familie | COMT | |
| Übergeordnetes Taxon | Lebewesen | |
| Orthologe (Mensch) | ||
| Entrez | 1312 | |
| Ensembl | ENSG00000093010 | |
| UniProt | P21964 | |
| Refseq (mRNA) | NM_000754.3 | |
| Refseq (Protein) | NP_000745.1 | |
| PubMed-Suche | 1312
| |
Die Catechol-O-Methyltransferase (Gen: COMT) ist ein Enzym, das verschiedene Catecholamine, darunter natürliche Botenstoffe und neuroaktive Arzneistoffe, O-methyliert und damit inaktiviert und dem Abbau zuführt. Es ist Teil des Katecholamin-Abbaus und des Fremdstoffmetabolismus. COMT ist in allen Lebewesen zu finden und wird insbesondere im Gehirn, in der Leber und Plazenta, sowie in Lymphozyten und Erythrozyten exprimiert. Beim Menschen gibt es zwei Isoformen der COMT: MB-COMT ist membrangebunden und S-COMT (der die ersten 50 Aminosäuren fehlen) frei beweglich.
COMT wurde vom US-amerikanischen Biochemiker Julius Axelrod entdeckt.
Funktion[Bearbeiten | Quelltext bearbeiten]
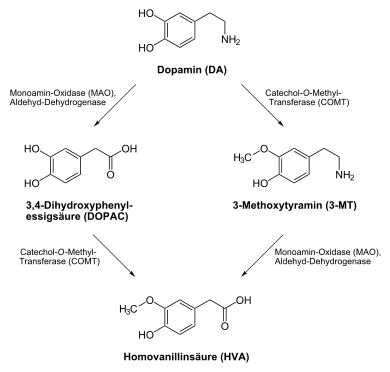
COMT deaktiviert insbesondere in den sympathischen Nervenenden das Noradrenalin, das Adrenalin und das Dopamin. Die Inaktivierung dieser Neurotransmitter erfolgt durch Übertragung einer Methylgruppe vom S-Adenosylmethionin (SAM) auf eine phenolische Hydroxygruppe durch die Catechol-O-Methyltransferase, an die sich die oxidative Desaminierung durch die Monoaminooxidase (MAO) anschließt.
Die COMT metabolisiert – ebenfalls durch Methylierung – auch verschiedene Arzneistoffe, so wie die in der Therapie des Morbus Parkinson verwendeten Verbindungen Levodopa und Dopamin. Um diese Deaktivierung auszuschalten, wurden COMT-Hemmer entwickelt.
Pathologie[Bearbeiten | Quelltext bearbeiten]
COMT-Polymorphismen, also das Auftreten von Genvarianten, werden mit einer Reihe von psychischen Veränderungen wie Angststörungen und Schizophrenie, aber auch speziell Essstörungen und Übergewicht in Verbindung gebracht. Diese Zusammenhänge, sowie auch die Rolle der COMT in der Verarbeitung von Schmerzen, werden derzeit erforscht. Die Ergebnisse zur Schizophrenie sind widersprüchlich.[1][2][3][4]
Umweltgifte, aber auch die Soja-Inhaltsstoffe Daidzein und Genistein, können die COMT blockieren und so zu einer Ansammlung von Abbauprodukten mit folgenden Schäden am Organismus beitragen.
In einer retrospektiven Studie konnte gezeigt werden, dass Patienten mit einer erniedrigten COMT-Aktivität häufiger einen Schock bei Bypassoperationen erleiden und ein höheres Sterblichkeitsrisiko während der Operation haben.[5]
Präeklampsie ist mit COMT-Mangel assoziiert.[6][7][8][9][10]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ Ross JR, Riley J, Taegetmeyer AB, et al: Genetic variation and response to morphine in cancer patients: catechol-O-methyltransferase and multidrug resistance-1 gene polymorphisms are associated with central side effects. In: Cancer. 112. Jahrgang, Nr. 6, März 2008, S. 1390–403, doi:10.1002/cncr.23292, PMID 18257092.
- ↑ Bassett AS, Chow EW: Schizophrenia and 22q11.2 deletion syndrome. In: Curr Psychiatry Rep. 10. Jahrgang, Nr. 2, April 2008, S. 148–57, PMID 18474208.
- ↑ Silberschmidt AL, Sponheim SR: Personality in relation to genetic liability for schizophrenia and bipolar disorder: differential associations with the COMT Val 108/158 Met polymorphism. In: Schizophr. Res. 100. Jahrgang, Nr. 1–3, März 2008, S. 316–24, doi:10.1016/j.schres.2007.12.467, PMID 18201871.
- ↑ Sanders AR, Duan J, Levinson DF, et al: No significant association of 14 candidate genes with schizophrenia in a large European ancestry sample: implications for psychiatric genetics. In: Am J Psychiatry. 165. Jahrgang, Nr. 4, April 2008, S. 497–506, doi:10.1176/appi.ajp.2007.07101573, PMID 18198266.
- ↑ Haase-Fielitz A, Haase M, Bellomo R, et al.: Decreased Catecholamine Degradation Associates with Shock and Kidney Injury after Cardiac Surgery, In: J Am Soc Nephrol. 2009, 20:1393-1403. PMID 19406978
- ↑ UniProt P21964
- ↑ Ho PW, Garner CE, Ho JW, et al: Estrogenic phenol and catechol metabolites of PCBs modulate catechol-O-methyltransferase expression via the estrogen receptor: potential contribution to cancer risk. In: Curr. Drug Metab. 9. Jahrgang, Nr. 4, Mai 2008, S. 304–9, PMID 18473748.
- ↑ Ho PW, Chu AC, Kwok KH, et al: Effects of plasticisers and related compounds on the expression of the soluble form of catechol-O-methyltransferase in MCF-7 cells. In: Curr. Drug Metab. 9. Jahrgang, Nr. 4, Mai 2008, S. 276–9, PMID 18473745.
- ↑ Lehmann L, Jiang L, Wagner J: Soy isoflavones decrease the catechol-O-methyltransferase-mediated inactivation of 4-hydroxyestradiol in cultured MCF-7 cells. In: Carcinogenesis. 29. Jahrgang, Nr. 2, Februar 2008, S. 363–70, doi:10.1093/carcin/bgm235, PMID 18192686.
- ↑ Kanasaki K, Palmsten K, Sugimoto H, et al: Deficiency in catechol-O-methyltransferase and 2-methoxyoestradiol is associated with pre-eclampsia. In: Nature. 453. Jahrgang, Nr. 7198, Juni 2008, S. 1117–21, doi:10.1038/nature06951, PMID 18469803.