Calciumbromat
Zur Navigation springen
Zur Suche springen
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 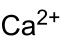
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Calciumbromat | |||||||||||||||
| Andere Namen |
E924b | |||||||||||||||
| Summenformel | Ca(BrO3)2 | |||||||||||||||
| Kurzbeschreibung |
weiße Kristalle[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 295,88 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit |
löslich in Wasser[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Calciumbromat ist das Calciumsalz der Bromsäure.
Darstellung[Bearbeiten | Quelltext bearbeiten]
Calciumbromat kann durch Auflösen von Calciumcarbonat in Bromsäure hergestellt werden.[2]
Auch durch Salzbildungsreaktion von Calciumhydroxid und Bromsäure entsteht Calciumbromat.[2]
Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Calciumbromat kristallisiert als Monohydrat in monoklinen Säulen, die mit Strontiumbromat und Bariumbromat isomorph sind. Zwischen 130 und 150 °C geben sie ihr Kristallwasser ab.[3] Bei 270–300 °C zersetzt sich Calciumbromat zu Calciumbromid.[3]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c d e Datenblatt Calciumbromat bei Alfa Aesar, abgerufen am 30. April 2017 (Seite nicht mehr abrufbar).
- ↑ a b R. Abegg, F. Auerbach: "Handbuch der anorganischen Chemie". Verlag S. Hirzel, Bd. 2, 1908, S. 129; Volltext
- ↑ a b V. A. Stenger, R. M. van Effen, L. C. Walker: "Solubility of Calcium Bromate in Water" in J. Chem. Eng. Data 2002, 47(3), S. 618–619. doi:10.1021/je010264g




