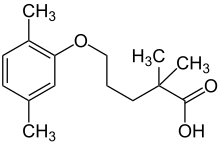
Gemfibrozil
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Gemfibrozil | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | C15H22O3 | |||||||||||||||||||||
| Kurzbeschreibung |
weißes bis fast weißes, wachsartiges, kristallines Pulver[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Wirkstoffklasse |
Fibrate (Lipidsenker) | |||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 250,34 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Siedepunkt | ||||||||||||||||||||||
| pKS-Wert |
4,7[2] | |||||||||||||||||||||
| Löslichkeit |
praktisch unlöslich in Wasser, sehr leicht löslich in Dichlormethan, leicht löslich in Ethanol und in Methanol[1] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Gemfibrozil ist ein oraler Lipidsenker (Mittel zur Senkung erhöhter Blutfette). Es gehört zur Wirkstoffgruppe der Fibrate. Gemfibrozil wurde als Lipidsenker 1969 von Parke-Davis (heute Pfizer) patentiert und ist unter dem Handelsnamen Gevilon sowie als Generikum erhältlich.[2]
Wirkmechanismus[Bearbeiten | Quelltext bearbeiten]
Der Arzneistoff ist ein Ligand des Peroxisom-Proliferator-aktivierten Rezeptors vom Subtyp α (PPARα), eines Rezeptors, der am Stoffwechsel von Kohlenhydraten und Fetten beteiligt ist und ebenso an der Bildung von Fettgewebe. Der Anstieg der Synthese von Lipoproteinlipase steigert gleichzeitig den Abbau von Triglyzeriden.
Therapeutische Wirkung[Bearbeiten | Quelltext bearbeiten]
Gemfibrozil
- reduziert den Spiegel der Triglyceride (um 20–40 %)
- reduziert den Spiegel von VLDL
- reduziert moderat den Spiegel von LDL (um 10–20 %)
- steigert moderat den Spiegel von HDL (um 5–20 %).[4]
Nebenwirkungen und toxische Effekte[Bearbeiten | Quelltext bearbeiten]
Häufige Nebenwirkungen sind Schwindel, Kopfschmerzen, gastrointestinale Beschwerden, Hautekzeme und Müdigkeit.[5] Auch Transaminasenanstieg, Muskelbeschwerden, Gallensteinbildung und Haarausfall können wie bei anderen Fibraten auftreten.[6]
In Tierversuchen fanden sich bei übernormalen Dosen Hinweise auf eine Kanzerogenität.[7]
Indikationen[Bearbeiten | Quelltext bearbeiten]
- Für Hyperlipidämie (Typ III) ist Gemfibrozil das Mittel der Wahl.
- Hypertriglyzeridämie (Typ IV): Gemfibrozil wird besser vertragen, auch wenn es weniger effektiv ist als Niacin.
Kontraindikationen[Bearbeiten | Quelltext bearbeiten]
Gemfibrozil sollte nur mit Vorsicht verwendet werden bei Anstieg der Leberenzyme, bei fortgeschrittener Niereninsuffizienz und bei Gallenwegserkrankungen. In der Schwangerschaft ist es nur bei vitaler Indikation zugelassen. Bei der Einnahme zusammen mit Repaglinid besteht Hypoglykämiegefahr. Bei Einnahme zusammen mit Statinen erhöht sich durch den gemeinsamen Stoffwechselweg über das Cytochrom P450 das Risiko einer Rhabdomyolyse.[8]
Wechselwirkungen[Bearbeiten | Quelltext bearbeiten]
- Antikoagulantien: Gemfibrozil verstärkt die Wirkung von Warfarin.
- Statine: Werden Statine gleichzeitig mit Fibraten (einschließlich Gemfibrozil) verabreicht, steigt das Risiko von Muskelkrämpfen, Myopathie und Rhabdomyolyse.
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c Eintrag GEMFIBROZIL CRS 27.06.2013 beim Europäisches Direktorat für die Qualität von Arzneimitteln (EDQM), abgerufen am 29. August 2017.
- ↑ a b c d Eintrag zu Gemfibrozil. In: Römpp Online. Georg Thieme Verlag, abgerufen am 10. Juli 2019.
- ↑ a b Datenblatt Gemfibrozil bei Sigma-Aldrich, abgerufen am 3. April 2011 (PDF).
- ↑ Thomas Karow, Ruth Lang-Roth: Allgemeine und Spezielle Pharmakologie und Toxikologie. S. 654.
- ↑ Rote Liste online, abgerufen am 1. Februar 2014.
- ↑ Richard Daikeler, Götz Use, Sylke Waibel: Diabetes. Evidenzbasierte Diagnosik und Therapie. 10. Auflage. Kitteltaschenbuch, Sinsheim 2015, ISBN 978-3-00-050903-2, S. 149.
- ↑ rxlist.com: Lopid (Memento vom 12. Juni 2008 im Internet Archive).
- ↑ Rote Liste Online Gemfibrozol, abgerufen am 1. Februar 2014.