Hämagglutinin (Influenzavirus A)
| Hämagglutinin (Influenzavirus A) | ||
|---|---|---|
| ||
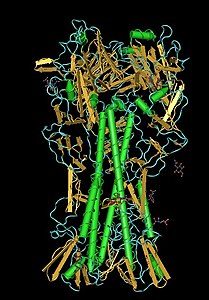
| Hämagglutininmolekül | ||
| Masse/Länge Primärstruktur | 549 = 321 + 228 Aminosäuren | |
| Sekundär- bis Quartärstruktur | 3*(HA1+HA2) Homotrimer | |
| Präkursor | Pre-HA (566 AS) | |
| Bezeichner | ||
| Externe IDs | ||
Hämagglutinin (HA) ist ein Glycoprotein des Influenzavirus A. Es ist eines der drei integralen Membranproteine im Virion und auf der Zelloberfläche infizierter Zellen. Hämagglutinine kommen auch in anderen Viren vor.
Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Der Name des Hämagglutinins rührt von der Entdeckung her, dass das Influenzavirus in der Lage ist, rote Blutzellen zu verklumpen. Dieser Vorgang heißt Hämagglutination. Der damals unbekannte Faktor, der dies bewirkte, wurde Hämagglutinin genannt.
Rezeptoren für Hämagglutinine (Antirezeptor) sind große, sialinsäuretragende Glykoproteine auf der Zelloberfläche. Auf den Viruspartikeln befinden sich ebenfalls die beiden anderen integralen Membranproteine des Influenzavirus A, der protonenleitende Ionenkanal M2 und das Enzym Neuraminidase (NA). Neuraminidasen sind Enzyme, die Sialinsäurereste in der frühen Entwicklung des Viruspartikels von der Wirtszellmembran entfernen. Diese Abspaltung aller Sialinsäurereste spielt eine entscheidende Rolle innerhalb des Vermehrungszykluses eines Influenza-Virus, da das neuentstandene Viruspartikel sonst mittels seines Hämagglutinins an seiner ursprünglichen Wirtszelle anhaften würde, was eine Verbreitung des Virus verhindert. Weiterhin dient das Hämagglutinin als fusogenes Protein für die Penetration des Endosoms beim Zelleintritt.
Aufbau[Bearbeiten | Quelltext bearbeiten]
Das Hämagglutinin ist ein homotrimeres Membranprotein, das eine Anheftung an den Rezeptor Neuraminsäure auf einer Wirtszelle vermittelt und – nach proteolytischer Aktivierung im Endosomen – das Innere des Virions (das Ribonukleoprotein) durch die Endosomenmembran ins Zytosol schleust.[1] Es steht als etwa 10 bis vierzehn Nanometer langes Peplomer aus der Virushülle heraus und wird im Zuge einer Immunreaktion (z. B. bei einer Erkrankung oder Impfung) von neutralisierenden Antikörpern erkannt, weshalb der Serotyp des HA nach fast jeder Epidemie wechselt. Das HA macht etwa 80 Prozent der Proteine in der Virushülle aus.[1]
Das HA ist ein Trimer aus drei identischen Einheiten, die siebenfach glykosyliert, dreifach palmitoyliert und mit Lipid Rafts assoziiert sind. Jede Einheit besteht wiederum nach der proteolytischen Spaltung aus zwei Untereinheiten: dem HA1 und dem HA2. Beide Untereinheiten sind durch eine Disulfidbrücke miteinander verbunden. Die Untereinheiten HA1 und HA2 gehen aus dem Vorgängerprotein HA0 hervor. Dazu muss das HA0 von einer Protease vom Trypsin-Typ (bevorzugt clara) in HA1 und HA2 gespalten werden.

HA1[Bearbeiten | Quelltext bearbeiten]
Das HA1 besteht größtenteils aus einer globulären Domäne, d. h., sie bildet einen großen Kopf, wobei dieser durch Disulfidbrücken stabilisiert wird. Dieser Kopf enthält die Bindungsstelle für die Neuraminsäure. Die wichtigsten Bindungsstellen (Antigene) für die Antikörper des Immunsystems befinden sich ebenfalls auf dem globulären Kopf des HA1. Durch den Selektionsdruck ist das HA1 daher einer schnellen Evolution unterworfen.
Das HA1 ist verantwortlich für die Konformationsänderung des HA, welche die Fusion der Virushülle mit der Wirtsmembran auslösen kann. Dazu müssen sich HA1 und HA2 trennen, wodurch die Fusionsdomäne aktiviert wird. Das geschieht, bevor der abgesenkte pH-Wert im endosomen dem Virus erlaubt, die Endosomenmembran zu penetrieren. Ein Absinken des pH-Werts bewirkt durch Protonierung der HA1 Untereinheiten eine positive Aufladung. Dadurch stoßen sich die HA1-Untereinheiten gegenseitig ab, lösen sich dabei vom HA2 und aktivieren dieses dabei. Das HA2 löst dann die Fusion der Membranen aus. Das HA2 kann aber nur einmal aktiviert werden, danach ist es inaktiv und das Virus verliert seine Infektionsfähigkeit.
HA2[Bearbeiten | Quelltext bearbeiten]
Das HA2 ist größtenteils alphahelikal aufgebaut und enthält eine große Loopregion. Das HA2 enthält außerdem die Transmembrandomäne und das sogenannte Fusionspeptid. Das Fusionspeptid wird durch die Spaltung des HA freigesetzt.
Das HA2 ist für die Fusion der Virushülle mit der Zellmembran der Wirtszelle verantwortlich. Um die Fusion auszulösen, müssen sich die globulären Köpfe des HA1 vom HA2 trennen. Dadurch kann das HA2 seine Konformation ändern, so dass es sich entfaltet und das Fusionspeptid in die Wirtsmembran eintauchen kann. Das Fusionspeptid wirkt wie ein Anker oder Enterhaken. Dadurch ist das Virus direkt mit der Wirtsmembran verbunden.
Das HA2 wird durch die Entfaltung einseitig verlängert. Untere Bereiche werden jedoch gleichzeitig "eingerollt", so dass sich netto keine Vergrößerung des Proteins ergibt. In weiteren Schritten klappt das HA um und zieht so das Virus an die Wirtsmembran heran und löst die Fusion beider Membranen aus.
Für die Konformationsänderung des HA2 spielt der pH-Wert ebenfalls eine Rolle: das ohnehin hydrophobe Fusionspeptid wird bei niedrigem pH durch Änderung der Konformation noch hydrophober. Auch das "Zusammenrollen" des unteren Teiles des HA2 ist ebenfalls vom niedrigen pH abhängig.
Replikation[Bearbeiten | Quelltext bearbeiten]
Das Viruspartikel bindet über den Neuraminsäurerezeptor des HA1 an einen Neuraminsäurerest seiner Wirtszelle. Die Neuraminsäure kommt als Bestandteil der Glykokalyx bei so gut wie allen Zellen des Wirtsorganismus vor. Deswegen kann Influenza A auch alle diese Zellen befallen, sofern diese Zellen das Viruspartikel auch über die Endocytose aufnehmen und die proteolytische Aktivierung des HA0 durchführen. Das Endosom entwickelt sich zum Lysosom und wird dabei angesäuert. Unterschreitet der pH-Wert einen Wert von 6,0 bis 5,0, so wird eine Konformationsumwandlung des HA ausgelöst, die die Fusion von Virus- und Endosommembran zur Folge hat. Dadurch gelangt das Virusgenom in die Wirtszelle. Allerdings genügt dieser Vorgang nicht allein, um die Zelle zu infizieren. Dazu ist ebenfalls das Membranprotein M2 notwendig, welches die Ansäuerung im Inneren des Virions vermittelt.
Obwohl das Viruspartikel von Influenza A wegen des HA sehr viele Zelltypen infizieren kann, so können nicht alle Zelltypen infektiöse Viruspartikel produzieren. Um ein infektiöses Viruspartikel zu erzeugen, muss das HA0 durch eine extrazelluläre Protease der Wirtszelle in das aktive HA umgewandelt werden. Ohne diese Aktivierung kann die Virushülle nicht mit der Membran des Lysosoms des Wirtes fusionieren: das Partikel ist nicht infektiös und wird im Lysosom abgebaut. Durch diesen Mechanismus wird festgelegt, welche Zelltypen (und damit welches Gewebe) für die Vermehrung infektiöser Viren in Frage kommen.
Tropismus[Bearbeiten | Quelltext bearbeiten]
Die Hämagglutinine binden je nach Serotyp eine unterschiedlich verknüpfte Sialinsäure. Dadurch wird der Tropismus des jeweiligen Serotyps bestimmt.
Pathogenität[Bearbeiten | Quelltext bearbeiten]
Die Aktivierung des HA0 durch die extrazelluläre Protease bestimmt, in welchem Gewebe des Körpers des Wirtes aktive Viruspartikel entstehen können und in welchem nicht. Normalerweise beschränkt sich auf diese Weise eine Infektion mit Influenza beim Menschen auf den oberen Respirationstrakt.
Aggressive Stämme können von verschiedenen Proteasen aktiviert werden. Sie besitzen zwei statt einer Schnittstelle und können so auch in anderen Geweben aktive Viruspartikel erzeugen und diese durch die Infektion schädigen. Hochaggressive Stämme (z. B. die HPAI) besitzen sogar drei Schnittstellen und werden dadurch von einigen zellulären Serinprotease aktiviert, z. B. in einer multi-basic cleavage site (MBCS). Deswegen können sie sich im gesamten Körper vermehren. Eine Koinfektion mit Bakterien im Lungenbereich kann diese Proteasen bereitstellen.
Literatur[Bearbeiten | Quelltext bearbeiten]
Milton J. Schlesinger und Sondra Schlesinger: Domains of Virus Glycoproteins. II. Influenza Virus Hemagglutinin. In: Karl Maramorosch, Kenneth M. Smith, Frederick A. Murphy, Max A. Lauffer, Aaron J. Shatkin (Hrsg.): Advances in Virus Research. Band 33. Academic Press, 2007, ISBN 0-12-039833-8, S. 2 ff.
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
Weblinks[Bearbeiten | Quelltext bearbeiten]
- Jennifer McDowall/Interpro: Protein Of The Month: Bird flu - Haemagglutinin. (engl.)
- Hämagglutinin-Hemmer als neue Wirkstoffklasse bei Vogelgrippe