Lactone


Als Lactone bezeichnet man in der organischen Chemie heterocyclische Verbindungen, die innerhalb eines ringförmigen Moleküls oder Molekülteils eine Esterbindung, d. h. eine Sauerstoffbrücke, enthalten und direkt am selben Kohlenstoffatom eine Carbonylgruppe aufweisen. Es handelt sich um intramolekulare, cyclische Ester von Hydroxycarbonsäuren.
Nomenklatur[Bearbeiten | Quelltext bearbeiten]
Griechische Buchstaben geben die Stellung bzw. Position der Hydroxygruppe relativ zur Carboxygruppe in der formal zugrundeliegenden Hydroxycarbonsäure an: Das der Carboxygruppe benachbarte C-Atom wird als α-ständig, das nächste als β-ständig usw. bezeichnet.
Lactone werden auch durch Anhängen der Endung -olid an den Namen des entsprechenden Kohlenwasserstoffes benannt, die Position des am Ringschluss beteiligten C-Atoms wird als Ziffer angegeben: z. B. Propan-3-olid = β-Propiolacton.[1]
Vorkommen[Bearbeiten | Quelltext bearbeiten]

Lactone sind eine bedeutende Gruppe unter den Aromastoffen. In der Natur kommen hauptsächlich γ- und δ-Lactone mit unverzweigten Seitenketten vor, wobei γ-Lactone häufiger in pflanzlichen und δ-Lactone häufiger in tierischen Produkten auftreten. Die meisten natürlich vorkommenden Lactone haben eine gerade Anzahl an Kohlenstoffatomen. Als Aromastoffe sind besonders Lactone mit 8 bis 12 Kohlenstoffatomen relevant.[2] Lactone mit weniger als 10 Kohlenstoffatomen riechen kokosartig, wohingegen solche mit mehr als 10 Kohlenstoffatomen pfirsichartig riechen.[3]
Beispielsweise findet man in Aprikosen, Nektarinen und Pfirsichen eine Vielzahl von γ-Lactonen mit sechs bis zwölf Kohlenstoffatomen (wie etwa γ-Decalacton, vergl. Decalactone) sowie δ-Lactone mit acht bis zwölf Kohlenstoffatomen (wie etwa δ-Decalacton), die entweder kokosartig, fruchtig-pfirsichartig oder fruchtig-fettig riechen.[3]

Eine weitere Gruppe von Lactonen, die als Aromastoffe bedeutend sind, sind die „Whiskylactone“, die in Whisky, Sherry und Brandy vorkommen; sie gehören zu den Quercuslactonen.
Ein Beispiel für das Vorkommen von Lactonen in tierischen Produkten ist das δ-Decalacton, das im Milchfett vorkommt. Es ist ein wichtiger Aromastoff für Milchprodukte wie H-Milch, Käse und insbesondere Butter, der eine süße Note hervorruft.[3]
Weitere natürlich vorkommende Lactone sind etwa die pflanzlichen Cardenolide, die ein ungesättigtes γ-Lacton an einem Steroidgerüst enthalten, die ebenfalls pflanzlichen Furanolactone (z. B. Salvinorine und Limonoide). Laktone mit vielen Ringgliedern heißen Makrolide, zu denen auch wichtige Antibiotika gehören. Ochratoxine sind Schimmelpilzgifte; ihr Lactonring hat sechs Atome.
Herstellung[Bearbeiten | Quelltext bearbeiten]
Während α-Lactone, deren einfachster Vertreter das Acetolacton ist, nur als instabile Zwischenprodukte bekannt und β-Lactone (Vierringe) nur unter speziellen Bedingungen darstellbar sind, sind die γ- und die δ-Lactone (Fünf- bzw. Sechsringe) leicht erhältliche stabile heterocyclische Verbindungen. γ-Lactone entstehen durch Eindampfen verdünnter wässriger Lösungen der entsprechenden γ-Hydroxycarbonsäuren. α-Hydroxycarbonsäuren bilden im Gegensatz dazu beim Eindampfen Oligomere und bei weiterem Erhitzen Lactide. Liegen die Carboxygruppe und die Hydroxygruppe weiter auseinander, werden die Lactone ebenfalls schnell unbeständig. Zu den bekanntesten ε-Lactonen gehört ε-Caprolacton, ein Lacton der Capronsäure. Aus ε-Caprolacton lassen sich Polyester herstellen.[4] Die Copolymerisation von ε-Caprolacton mit Milchsäure führt zu Polyestern, die biologisch abbaubar sind.
Schematisches Beispiel einer Lactonbildung; die Bildung von γ-Butyrolacton aus γ-Hydroxybuttersäure durch Wasserabspaltung:
Eine weitere Methode, Lactone herzustellen, ist die Baeyer-Villiger-Oxidation. Dabei werden cyclische Ketone mit Peroxycarbonsäuren unter Ringerweiterung oxidiert.[5] Die Baeyer-Villiger-Oxidation von Cyclohexanon liefert das industriell in beträchtlichen Mengen hergestellte ε-Caprolacton, ein Ausgangsprodukt für die Herstellung von Polyestern und Polyethern.[6]
Erhitztes oder fermentiertes sowie biotransformiertes Rizinusöl ist die Quelle verschiedener Lactone.[7][8]
Historisches[Bearbeiten | Quelltext bearbeiten]
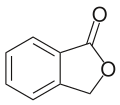
Als Entdecker der Stoffgrupe der Lactone gilt Rudolph Fittig.[9] Er schlug 1880 den Namen „Lactone“ dafür vor.[10] Bei den Beispielen für Lactone nannte er unter anderem das Cumarin und das Phthalid (diese beiden haben auch einen Benzolring und sind daher Aromaten) und das Santonin.[10]
-
Cumarin (o-Cumarsäurelacton)
-
Phthalid (im Selleriearoma)
-
Santonin (wirkt gegen Spulwürmer)
Verwandte Verbindungen[Bearbeiten | Quelltext bearbeiten]
Wie die Lactone, für die die Esterbindung –CO–O– charakteristisch ist, haben die folgenden Verbindungen ebenfalls ringförmige (cyclische) Moleküle oder Molekülteile:
- Lactame, mit einer Amidbindung –CO–NH– im Ring
- Lactime sind Tautomere zu den Lactamen, mit einer Gruppe –COH=N– im Ring
- Thiolactone enthalten die Gruppe –S–CO– im Ring, und damit ein Schwefelatom benachbart zu –CO–
- Lactide sind cyclische Diester, sie haben zwei Esterbindungen –CO–O– in einem Ring
- Lactole sind cyclische Halbacetale, d. h. sie haben die Gruppe –O–C(OH)H–
Lactame und Thiolactone enthalten wie Lactone eine Carbonylgruppe (mit Doppelbindung C=O), Lactime und Lactole enthalten eine organische Hydroxygruppe C–OH.
α-Peroxylactone sind Wirkstoffe in der Biolumineszenz des Leuchtkäfers (Luciferine, entdeckt vom 1937 geborene Chemiker Waldemar Adam[11]).
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ H. Beyer, W. Walter: Lehrbuch der organischen Chemie. 20. Auflage. Hirzel, Stuttgart 1984, S. 264.
- ↑ Wilfried Schwab & Peter Schreier: Enzymic Formation of Flavour Volatiles from Lipids. In: Tsung Min Kuo & Harold Gardner (Hrsg.): Lipid Biotechnology. CRC Press, 2002, ISBN 978-0-203-90819-8, S. 302–307 (google.de).
- ↑ a b c Wolfgang Legrum: Riechstoffe, zwischen Gestank und Duft. Vorkommen, Eigenschaften und Anwendung von Riechstoffen und deren Gemischen. Vieweg + Teubner Verlag, Wiesbaden 2011, ISBN 978-3-8348-1245-2, 5 Aromastoffe in Lebensmitteln, 5.1.3 Lactone, S. 87–88 & 149, doi:10.1007/978-3-8348-8276-9 (eingeschränkte Vorschau in der Google-Buchsuche [abgerufen am 26. August 2016]).
- ↑ Harald Cherdron, Hellmut Ohse, Friedhelm Korte: Die Polymerisation von Lactonen. Teil 1: Homopolymerisation 4-, 6- und 7-gliedriger Lactone mit kationischen Initiatoren, In: Die Makromolekulare Chemie. 56(1), 1962, S. 179–186, doi:10.1002/macp.1962.020560113.
- ↑ Organikum. Wiley-VCH Verlag GmbH, 23. Auflage, 2009, ISBN 978-3-527-32292-3, S. 683–684.
- ↑ Otto-Albrecht Neumüller (Hrsg.): Römpps Chemie-Lexikon. Band 1: A–Cl. 8. neubearbeitete und erweiterte Auflage. Franckh’sche Verlagshandlung, Stuttgart 1979, ISBN 3-440-04511-0, S. 586.
- ↑ Birgit Kamm: Microorganisms in Biorefineries. Springer, 2015, ISBN 978-3-662-45208-0, S. 277.
- ↑ Dolf De Rovira, Sr.: Dictionary of Flavors. Second Edition, Wiley-Blackwell, 2008, ISBN 978-0-8138-2135-1, S. 181.
- ↑ Rudolph Fittig in der Deutschen Biographie
- ↑ a b Rudolph Fittig: II. Untersuchungen über die ungesättigten Säuren. In: Justus Liebigs Annalen der Chemie. Band 200, Nr. 1-2, Januar 1880, ISSN 0075-4617, S. 21–96, doi:10.1002/jlac.18802000103 (wiley.com).
- ↑ Walter Habel (Hrsg.): Wer ist wer? Das deutsche Who’s who. 24. Ausgabe. Schmidt-Römhild, Lübeck 1985, ISBN 3-7950-2005-0, S. 4.