Nazarov-Cyclisierung
| Edukt |
|---|
 Divinylketon R1 = H, Alkyl, Aryl R2 = H, Alkyl, Aryl |
Die Nazarov-Cyclisierung, auch Nazarov-Reaktion genannt, ist eine Namensreaktion der organischen Chemie und wurde in den Vierzigerjahren durch den russischen Chemiker Ivan Nikolaevich Nazarov (1906–1957) entdeckt.[1] Bei der Reaktion handelt es sich um eine Synthesereaktion für Cyclopentenone aus Divinylketonen und deren Präkursoren.[2][3]
Unter dem Begriff der Nazarov-Cyclisierung werden weitere Reaktionen mit anderen Substraten aber ähnlichem Reaktionsmechanismus zusammengefasst.
Übersichtsreaktion[Bearbeiten | Quelltext bearbeiten]
Bei der von Nazarov ursprünglich beschriebenen Cyclisierung werden stöchiometrische Mengen einer Lewis-Säure zur Aktivierung des Divinylketons verwendet.[1][2][3] Die folgende Übersicht zeigt eine Variante mit Wasserstoff als Substituent (R1 = H und R2 = H):
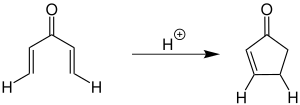
Neben Wasserstoff können eine Vielzahl weiterer Organylgruppen verwendet werden. Sowohl für R1 als auch R2 sind Alkyl- und Arylgruppen möglich.[3][4]
Werden bei der Nazarov-Cyclisierung unsymmetrische Divinylketone (R1 ≠ R2) eingesetzt, so läuft die Reaktion nach folgendem Reaktionsschema ab:

Dabei entsteht ein Gemisch zweier regioisomerer α,β-ungesättigter Ketone.
Mechanismus[Bearbeiten | Quelltext bearbeiten]
Der Mechanismus der Nazarov-Cyclisierung ist sehr gut erforscht. Es handelt sich dabei im Wesentlichen um einen elektrocyclischen Mechanismus mit konrotatorischem Ringschluss.[5][6]

Im ersten Reaktionsschritt wird das Divinylketon 1 unter dem Einfluss einer Säure zum Hydroxypentadienylkation 2 protoniert. Anschließend reagiert Substanz 2 mittels Ringschluss zum Cyclopentenylkation 3. Durch anschließende Deprotonierung des Kations 3 bildet sich zuerst das Enol 4, welches durch Keto-Enol-Tautomerie dann zum α,β-ungesättigten Keton 5 reagiert.
Die Entstehung eines Produktgemisches bei der Umsetzung von unsymmetrischen Divinylketonen ist auf folgende mesomere Grenzformeln des im Mechanismus auftretenden Cyclopentenylkations zurückzuführen:[5]

Beide mesomeren Grenzformeln können, wie im Mechanismus gezeigt, deprotoniert werden. Folglich entstehen zwei Reaktionsprodukte.
Anwendung[Bearbeiten | Quelltext bearbeiten]
Die bei der Reaktion entstehenden Produktgemische stellen einen großen Nachteil bei dem Einsatz in der chemischen Industrie dar. Dieser wird durch den Einsatz folgender Trimethylsilyl-substituierten Carbonylverbindungen verhindert:[5]

Dieses Verfahren wurde erstmals von dem Chemiker Scott Denmark publiziert.[5] Da sich Divinylketone mit verschiedensten Substituenten relativ leicht synthetisieren lassen, findet die Nazarov-Cyclisierung diverse Anwendungsmöglichkeiten. Vor allem die Verwendung silylierter Carbonylverbindungen spielt eine wichtige Rolle bei der Synthese cyclopentanoider Systeme in der Naturstoffchemie.[5][6]
Literatur[Bearbeiten | Quelltext bearbeiten]
- Tülay A Ateşin: Nazarov Cyclization Reaction. Challenges and Opportunities. In: Organic Chemistry. Current Research. Band 03, Nr. 01, 13. Januar 2014, doi:10.4172/2161-0401.1000e130.
- Christiane Santelli-Rouvier, Maurice Santelli: The Nazarov Cyclisation. In: Synthesis. Band 1983, Nr. 06, 1983, S. 429–442, doi:10.1055/s-1983-30367.
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b I. N. Nazarov, I. I. Zaretskaya: Derivatives of acetylene. XXVII. Hydration of divinylacetylene. In: Bull. acad. sci. U.R.S.S., Classe sci. chim. 1942, S. 200–209.
- ↑ a b I. N. Nazarov, I.I. Zaretskaya: Structure of products of hydration of divinylethynyl hydrocarbons. In: Zh. Obshch. Khim. 27, 1957, S. 693–713.
- ↑ a b c I. N. Nazarov, I. I. Zaretskaya, T. I. Sorkina: Cyclopentanolones from the cyclization of divinyl ketones. In: Zh. Obshch. Khim. 30, 1960, S. 746–754.
- ↑ Zerong Wang: Comprehensive Organic Name Reactions and Reagents. John Wiley & Sons, New Jersey 2009, ISBN 978-0-471-70450-8, S. 2011–2015, doi:10.1002/9780470638859.
- ↑ a b c d e Thomas Laue, Andreas Plagens: Namen- und Schlagwort-Reaktionen der Organischen Chemie. Vieweg+Teubner Verlag, Wiesbaden 2006, ISBN 3-8351-0091-2, Nazarov-Cyclisierung, S. 240–242, hier S. 230–232, doi:10.1007/978-3-322-94726-0_73 (Erstausgabe: 1994).
- ↑ a b László Kürti, Barbara Czakó.: Strategic Applications of Named Reactions in Organic Synthesis. Background and Detailed Mechanisms, Elsevier Academic Press, 2005, S. 304–305, ISBN 978-0-12-429785-2.