Nomenklatur der monoklonalen Antikörper
| Präfix | Wirkungsbereich | Ursprungsorganismus des Antikörpers | Wortstamm | |||
|---|---|---|---|---|---|---|
| alt | neu | Bedeutung | Bedeutung | |||
| variabel | -anibi- | — | Angiogenese (inhibitor) | -a- | Ratte | -mab |
| -ba(c)- | -b(a)- | Bakterien | -e- | Hamster | ||
| -ci(r)- | -c(i)- | Blutkreislauf | -i- | Primaten | ||
| -fung- | -f(u)- | Fungi | -o- | Maus | ||
| -ki(n)- | -k(i)- | Interleukin | -u- | human | ||
| -les- | — | Läsion | -xi- | chimär (human/fremd) | ||
| -li(m)- | -l(i)- | Immunsystem | -zu- | humanisiert | ||
| -mul- | – | Stütz- und Bewegungsapparat | -xizu-* | chimärer/humanisierter Hybrid | ||
| -ne(u)(r)- | -n(e)-* | Nervensystem | -axo- | Ratte/Maus-Hybrid | ||
| -os- | -s(o)- | Knochen | ||||
| -toxa- | -tox(a)- | Toxin | ||||
| -co(l)- | -t(u)- | Darmkrebs | ||||
| -go(t)- | Hodenkrebs | |||||
| -go(v)- | Eierstockkrebs | |||||
| -ma(r)- | Brustkrebs | |||||
| -me(l)- | Melanom | |||||
| -pr(o)- | Prostatakarzinom | |||||
| -tu(m)- | verschiedene Tumoren | |||||
| -vi(r)- | -v(i)- | Virus | ||||
| * in Diskussion seit Dezember 2009 | ||||||
Die Nomenklatur für monoklonale Antikörper ist eine Konvention zur Namensgebung monoklonaler Antikörper mittels generischer oder nicht-proprietärer Namen. Ein Antikörper ist ein Protein, welches in B-Zellen produziert und vom menschlichen Immunsystem sowie anderer Wirbeltiere verwendet wird, um spezifische fremde Objekte wie Bakterien oder Viren zu identifizieren. Als monoklonale Antikörper werden diejenigen bezeichnet, die in identischen Zellen – oft auch künstlich – produziert worden sind, und sich so gegen ein einzelnes Epitop ausrichten. Monoklonale Antikörper werden speziell in der Medizin in einem weiten Einsatzgebiet eingesetzt.[5]
Diese Namenskonvention für monoklonale Antikörper wird sowohl in den Internationalen Freinamen (INN) der Weltgesundheitsorganisation[6] als auch in den United States Adopted Names (USAN)[1] für Wirkstoffe angewandt. Generell werden Wortstämme verwendet, um verschiedene Klassen von Arzneistoffen zu unterscheiden. Alle Namen von monoklonalen Antikörpern enden auf die Stammsilbe -mab. Im Gegensatz zu den meisten anderen für Wirkstoffe verwendete Nomenklaturen verwendet die monoklonale Antikörpernomenklatur verschiedene vorangestellte Wortteile (Morpheme) abhängig je nach Struktur bzw. Funktion.
Bestandteile[Bearbeiten | Quelltext bearbeiten]
Wortstamm[Bearbeiten | Quelltext bearbeiten]
Der Wortstamm -mab wird sowohl für monoklonale Antikörper als auch für deren Fragmente verwendet, solange diese mindestens eine variable Domäne (diejenige Domäne, welche das Ziel bindet) beinhalten.[7] Dies trifft beispielsweise auf Antigen-Bindungsfragmente[8] und Einzelkettenfragmente zu.[9] Andere Teile des Antikörpers (wie Fc-Fragmente) verwenden jedoch unterschiedliche Nomenklaturen.
Ursprungorganismus der Antikörper[Bearbeiten | Quelltext bearbeiten]

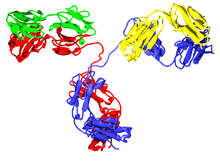
Teile des Antikörpers, die so im Menschen vorkommen, werden in braun gezeigt, Teile nicht-menschlichen Ursprungs in blau. Die variablen Domänen werden an der Spitze jedes Antikörpers dargestellt; die Complementarity determining regions innerhalb dieser Domänen werden als Dreifach-Loops dargestellt
Der Wortstamm, der direkt der Silbe -mab vorausgeht, lässt auf den tierischen Ursprung des monoklonalen Antikörpers schließen.[1] Die ersten monoklonalen Antikörper wurden z. B. in Mäusen produziert (Wortstamm -o-, zusammengesetzt als -omab; gewöhnlich wurde hier die Hausmaus Mus musculus verwendet) oder von anderen nicht-menschlichen Organismen. Weder INN noch USAN wurden jemals zur Benennung von Antikörper konsultiert, die aus Ratten (Silbe -a-), Hamstern (-e-) oder Primaten (-i-) stammen.[7]
Diese nicht-menschlichen monoklonalen Antikörper werden vom menschlichen Immunsystem als fremd erkannt und können daher auch schnell vom menschlichen Körper abgebaut werden, sie können Allergien auslösen, oder aber auch beides kann zutreffen.[10][11] Um diese Reaktionen des menschlichen Immunsystems abzumildern, wurden Teile des Antikörpers mit humanisierten Aminosäurensequenzen ersetzt, oder reine menschliche Antikörper werden technisch hergestellt. Wird die konstante Region durch die humane Form ersetzt, spricht man von chimären monoklonalen Antikörpern, gekennzeichnet durch die Silbe -xi-. Teile der variablen Region können auch ersetzt werden, was als humanisiert bezeichnet wird (-zu-); normalerweise wird die ganze Sequenz mit Ausnahme der Complementarity determining regions (CDRs) ersetzt, die drei Schleifen der Aminosäurensequenz am äußersten Ende einer jeden variablen Domäne, die auch für die Bindung an das Ziel ausschlaggebend sind. Antikörper, die zu Teilen chimär, zu Teilen aber auch humanisiert sind, tragen die Silbe -xizu-. Diese drei Silben kennzeichnen jedoch nicht die Fremdspezies. Der human/Maus chimäre Antikörper Basiliximab endet auf -ximab ebenso wie der human/Makaken Antikörper Gomiliximab. Menschliche Antikörper verwenden -u-.[2]
Ratten-Maus-Hybride können so verändert werden, dass sie die Bindungsstellen für zwei unterschiedliche Antigene erkennen. Diese Antigene, auch bekannt als Tri-funktionelle Antikörper, führen die Silbe -axo-.[12]
Wirkungsbereich[Bearbeiten | Quelltext bearbeiten]
Die Silbe, die dem Ursprungsorganismus vorausgeht, bezeichnet den Wirkungsbereich des monoklonalen Antikörpers. Beispiele für solche Wirkungsbereiche sind Tumoren, Organsysteme wie etwa der Blutkreislauf, oder Pathogene wie Bakterien oder Viren. Der Wirkungsbereich erlaubt jedoch keinerlei Rückschlüsse über die Wirkungsweise des Antikörpers im Körper. Therapeutische, prophylaktische und diagnostisch verwendete Substanzen können mit dieser Nomenklatur nicht unterschieden werden.
In der ursprünglich entwickelten Namenskonvention bestanden die einzelnen Silben großteils aus einem Konsonanten, gefolgt von einem Vokal und wieder einem Konsonanten. Der letzte Buchstabe konnte auch übergangen werden, um die Aussprache zu erleichtern. Beispiele hierfür sind -ci(r)- für den Blutkreislauf, -li(m)- für das Immunsystem und -ne(r)- für das Nervensystem. Der letzte Buchstabe der Silbe wird für gewöhnlich ausgelassen, wenn die nächste Silbe mit einem Konsonanten beginnt (wie z. B. -zu- oder -xi-), jedoch werden nicht alle Wirkungssysteme in deren Kurzform gebraucht. -mul- zum Beispiel wird niemals auf -mu- verkürzt, da bis dato keine chimären oder humanisierten Antikörper einen INN erhielten, die auf den Stütz- und Bewegungsapparat abzielen. Kombinationen von Silben für Wirkungsweise sowie für den Wirtsorganismus enden z. B. auf -limumab (Immunsystem, menschlich) oder -ciximab (Blutkreislauf, chimär, Konsonant r entfällt).[1]
Neue und kürzere Silben für den Wirkungsbereich wurden im Jahre 2009 entwickelt und angepasst. Die meisten bestehen aus einem Konsonanten plus einem Vokal, der aber entfällt, wenn auch die Silbe für den Wirtsorganismus mit einem Vokal beginnt. Humane Antikörper zum Beispiel, die auf das Immunsystem abzielen, erhalten den Namen -lumab anstelle der alten Nomenklatur -limumab. Einige Endungen wie -ciximab bleiben unverändert.[2] Das alte System beinhaltete sieben Silben für Tumorziele – je nach Tumortyp. Weil jedoch viele Antikörper auf mehrere Tumortypen ansprechen, wird in der neuen Nomenklatur nur die Silbe -t(u)- verwendet.[1]
Präfix[Bearbeiten | Quelltext bearbeiten]
Dem Präfix kommt keine besondere Bedeutung zu, es soll jedoch eindeutig für jede Arznei sein sowie insgesamt einen wohlklingenden Namen ergeben.[2] Das bedeutet jedoch auch, dass Antikörper mit dem gleichen Zielbereich sowie aus dem gleichen Wirtsorganismus nur am Präfix unterschieden werden können. Antikörper, die auf das exakt gleiche Ziel ansprechen, tragen daher ein unterschiedliches Präfix (wie z. B. Adalimumab und Golimumab). Beide sind TNF-Blocker, unterscheiden sich jedoch in ihrer chemischen Struktur.[13][14]
Namenszusätze[Bearbeiten | Quelltext bearbeiten]
Ein zweites Wort kann dem Wirkstoffnamen angefügt werden.[2] Dies kann mehrere Gründe haben:
- Ein Antikörper kann pegyliert sein, um den Abbau im Körper zu verlangsamen und um auch die Immunogenität zu senken;[15] Zusatz: pegol wie in alacizumab pegol.[16]
- Ein zytotoxisches Molekül kann mit einem Anti-Tumor Antikörper verlinkt werden. Vedotin zum Beispiel steht für Monomethylauristatin E, welches selbst toxisch wirkt, jedoch vorwiegend Krebszellen angreift, wenn es in Konjugaten wie Glembatumumab vedotin verwendet wird.[17]
- Ein Chelator kann ebenso angefügt werden, um Radioisotope zu binden. Pendetide, ein Derivativ der Diethylentriaminpentaessigsäure, wird z. B. von capromab pendetide verwendet, um Indium-111 zu chelatieren.[18] Enthält die Arznei ein Radioisotop, wird der Name des Isotops dem Namen des Antikörpers vorangestellt.[2] Indium (111In) capromab pendetide ist daher der Name für das obige Beispiel, welches Indium-111 enthält.[18]
Geschichte[Bearbeiten | Quelltext bearbeiten]

Emil von Behring und Kitasato Shibasaburō entdeckten 1890, dass Diphtherie und Tetanus im Blutkreislauf von Tieren durch Substanzen neutralisiert wurden, die sie Anti-Toxine nannten.[19] Behring erhielt 1901 den ersten Nobelpreis für Physiologie oder Medizin für diese grundlegende Entdeckung.[20] Ein Jahr später prägte Paul Ehrlich den Begriff Antikörper für diese Anti-Toxine.[21]
Die Prinzipien zur Herstellung monoklonaler Antikörper, auch bekannt als Hybridom-Technik, wurden 1975 durch Georges J. F. Köhler und César Milstein publiziert,[22] die 1984 den Nobelpreis der Medizin zusammen mit Niels Kaj Jerne erhielten.[23] Muromonab-CD3 war der erste monoklonale Antikörper, der 1986 für den klinischen Gebrauch in Menschen zugelassen worden war.[24]
Die WHO führte 1950 ein System von internationalen Freinamen (englisch International Nonproprietary Name: INN) ein, wobei die erste Liste mit INN-Namen bereits drei Jahre später publiziert wurden. Die Silbe -mab für monoklonale Antikörper wurde um 1990 erstmals vorgeschlagen, wobei das jetzt verwendete System zwischen 1991 und 1993 entwickelt wurde. Als Folge der Zusammenarbeit zwischen WHO und dem United States Adopted Names Council haben die USAN Namen für Antikörper die gleiche Struktur und sind daher auch großteils identisch mit den INN Namen. Bis zum Jahre 2009 erhielten mehr als 170 monoklonale Antikörper Namen, die dieser Nomenklatur folgen.[7] Im Oktober 2008 begann die WHO, die Nomenklatur für monoklonale Antikörper zu überarbeiten. Dies führte 2009 zu Anpassungen der Nomenklatur, speziell in der Benennung des Wirkungsbereiches.[7] Im Jahr 2010 wurden die ersten Antikörper nach der neuen Nomenklatur benannt.[25]
Beispiele[Bearbeiten | Quelltext bearbeiten]
Neue Nomenklatur[Bearbeiten | Quelltext bearbeiten]
- Olaratumab gehört zur Gruppe der Antineoplastika. Der Name setzt sich aus den Komponenten olara-t-u-mab zusammen, was auf einen menschlichen Antikörper mit dem Wirkungsbereich gegen Tumoren schließen lässt.[25]
- Benralizumab wird zur Behandlung von Asthma eingesetzt, wobei sich dieser Name aus den Silben benra-li-zu-mab zusammensetzt. Dies leitet sich davon ab, dass es sich um einen humanisierten Antikörper, der auf das Immunsystem einwirkt, handelt.[26]
Alte Nomenklatur[Bearbeiten | Quelltext bearbeiten]
- Adalimumab ist ein monoklonaler Antikörper, der auf TNF-alpha abzielt. Der Name setzt sich aus den Silben ada-lim-u-mab zusammen. Dies bedeutet, dass dieser humane monoklonale Antikörper auf das Immunsystem abzielt. Nach der neuen Nomenklatur von 2009 würde der Name auf adalumab lauten.[13]
- Abciximab ist eine Medikation, um die Verklumpung von Blutplättchen zu verhindern. Zerlegt in die einzelnen Silben ab-ci-xi-mab, kann abgeleitet werden, dass es sich um einen chimären monoklonalen Antikörper handelt, dessen Wirkungsbereich das kardiovaskuläre System ist. Der Name wäre auch nach der neuen Nomenklatur gleichlautend.[27]
- Trastuzumab, ein monoklonaler Antikörper, der in der Therapie von Brustkrebs eingesetzt wird, setzt sich aus den Silben tras-tu-zu-mab zusammen. Dabei handelt es sich um einen humanisierten monoklonalen Antikörper, dessen Wirkungsbereich sich auf Tumoren erstreckt.[28] Auch für diesen monoklonalen Antikörper wäre der Name nach der neuen Nomenklatur identisch.
Abweichende Nomenklatur[Bearbeiten | Quelltext bearbeiten]
- Der monoklonale Antikörper muromonab-CD3, erstmals 1986 zugelassen für die klinische Verwendung, wurde vor Einführung dieser Nomenklatur für monoklonale Antikörper benannt. Der Name wurde aus den Wortteilen „murine monoclonal antibody (engl. für muriner monoklonaler Antikörper), abzielend auf CD3“, zusammengesetzt.[24]
Siehe auch[Bearbeiten | Quelltext bearbeiten]
- Krebsimmuntherapie
- European Public Assessment Report, eine Zusammenfassung von Zulassungsberichten für Arzneimittel der Europäischen Arzneimittelbehörde
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c d e AMA (USAN) Monoclonal antibodies. In: United States Adopted Names. 7. August 2007, archiviert vom (nicht mehr online verfügbar) am 7. Mai 2010; abgerufen am 15. August 2007.
- ↑ a b c d e f General policies for monoclonal antibodies. (PDF) World Health Organization, 18. Dezember 2009, abgerufen am 8. Juni 2010.
- ↑ The use of stems in the selection of International Nonproprietary Names (INN) for pharmaceutical substances. (PDF) World Health Organization, 2009, S. 107–109, 168–169, abgerufen am 22. Februar 2010.
- ↑ Monoclonal antibodies. American Medical Association, abgerufen am 28. April 2014.
- ↑ Charles Janeway Jr., P. Travers, M. Walport, M. J. Shlomchik: Immunobiology. The immune system in health and disease. 5. Auflage. Garland Publishing, New York 2001, ISBN 0-8153-3642-X (online).
- ↑ Guidelines on the Use of International Nonproprietary Names (INNs) for Pharmaceutical Substances. (PDF) 1997, S. 27–28, abgerufen am 15. August 2007.
- ↑ a b c d International Nonproprietary Names. In: WHO Drug Information. Band 23, Nr. 3. World Health Organization, 2009, S. 195–199 (who.int [PDF; abgerufen am 8. Dezember 2010]).
- ↑ International Nonproprietary Names for Pharmaceutical Substances (INN). In: WHO Drug Information. Band 18, Nr. 1. World Health Organization, 2004, S. 61 (who.int [PDF; abgerufen am 8. Juni 2010]).
- ↑ International Nonproprietary Names for Pharmaceutical Substances (INN). In: WHO Drug Information. Band 15, Nr. 2. World Health Organization, 2001, S. 121 (who.int [PDF; abgerufen am 8. Juni 2010]).
- ↑ M. Stern, R. Herrmann: Overview of monoclonal antibodies in cancer therapy: present and promise. In: Critical Reviews in Oncology Hematology. Band 54, Nr. 1, 2005, S. 11–29, doi:10.1016/j.critrevonc.2004.10.011.
- ↑ M. Tabrizi, C. Tseng, L. Roskos: Elimination mechanisms of therapeutic monoclonal antibodies. In: Drug Discovery Today. Band 11, Nr. 1-2, 2006, S. 81–88, doi:10.1016/S1359-6446(05)03638-X.
- ↑ F. Lordick, K. Ott, J. Weitz, D. Jäger: The evolving role of catumaxomab in gastric cancer. In: Expert Opinion on Biological Therapy. Band 8, Nr. 9, 2008, S. 1407, PMID 18694358.
- ↑ a b N. Miyasaka: Adalimumab for the treatment of rheumatoid arthritis. In: Expert Review of Clinical Immunology. Band 5, Nr. 1, 2009, S. 19–22, doi:10.1586/1744666X.5.1.19.
- ↑ International Nonproprietary Names for Pharmaceutical Substances (INN). In: WHO Drug Information. Band 18, Nr. 2. World Health Organization, 2004, S. 167 (who.int [PDF; abgerufen am 13. Februar 2011]). International Nonproprietary Names for Pharmaceutical Substances (INN) (Memento des vom 11. Februar 2012 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.
- ↑ F. Veronese, G. Pasut: PEGylation, successful approach to drug delivery. In: Drug Discovery Today. Band 10, Nr. 21, 2005, S. 1451–1458, doi:10.1016/S1359-6446(05)03575-0.
- ↑ International Nonproprietary Names for Pharmaceutical Substances (INN). In: WHO Drug Information. Band 22, Nr. 3. World Health Organization, 2008, S. 221 (who.int [PDF; abgerufen am 8. Juni 2010]).
- ↑ Drug Dictionary: Glembatumumab vedotin. National Cancer Institute, abgerufen am 28. Juni 2014.
- ↑ a b ATC/DDD Classification (final). In: WHO Drug Information. Band 15, Nr. 2. World Health Organization, 2001 (who.int [abgerufen am 13. Februar 2011]).
- ↑ AGN: The Late Baron Shibasaburo Kitasato. In: Canadian Medical Association Journal. Band 25, Nr. 2, 1931, S. 206, PMID 20318414, PMC 382621 (freier Volltext).
- ↑ The Nobel Prize in Physiology or Medicine 1901. Nobel Foundation, abgerufen am 19. Februar 2011.
- ↑ J. Lindenmann: Origin of the terms 'antibody' and 'antigen'. In: Scandinavian journal of immunology. Band 19, Nr. 4, 1984, S. 281–285, PMID 6374880.
- ↑ G. Köhler, C. Milstein: Continuous cultures of fused cells secreting antibody of predefined specificity. 1975. In: Journal of Immunology (Baltimore, Md. : 1950). Band 174, Nr. 5, 2005, S. 2453–5, PMID 15728446.
- ↑ The Nobel Prize in Physiology or Medicine 1984. Nobel Foundation, abgerufen am 14. Februar 2011.
- ↑ a b E. Mutschler, G. Geisslinger, H. K. Kroemer, M. Schäfer-Korting: Mutschler Arzneimittelwirkungen. Lehrbuch der Pharmakologie und Toxikologie. Mit einführenden Kapiteln in die Anatomie, Physiologie und Pathophysiologie. Hrsg.: Ernst Mutschler. 8., völlig neu bearb. und erw. Auflage. Wiss. Verlag-Ges., Stuttgart 2001, ISBN 3-8047-1763-2, S. 937.
- ↑ a b Statement on a Nonproprietary name adopted by the USAN Council: Olaratumab. (PDF) American Medical Association, archiviert vom (nicht mehr online verfügbar) am 14. Februar 2016; abgerufen am 28. April 2014. Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis. (Zugriff nur über Login möglich)
- ↑ Statement on a Nonproprietary name adopted by the USAN Council: Benralizumab. (PDF) American Medical Association, ehemals im (nicht mehr online verfügbar); abgerufen am 28. April 2014. (Seite nicht mehr abrufbar. Suche in Webarchiven) (Zugriff nur über Login möglich)
- ↑ Abciximab. In: Drugs.com. Abgerufen am 13. März 2010.
- ↑ Trastuzumab. In: Drugs.com. Abgerufen am 8. Juni 2010.