Diphosgen
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||||||||
| Kristallsystem |
monoklin[1] | ||||||||||||||||||
| Raumgruppe |
P21/n (Nr. 14, Stellung 2)[1] | ||||||||||||||||||
| Gitterparameter |
a=5,5578(5) Å, b=14,2895(12) Å, c=8,6246(7) Å, β=102,443(2)°, Z=4[1] | ||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Diphosgen | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C2Cl4O2 | ||||||||||||||||||
| Kurzbeschreibung |
farblose, stechend riechende Flüssigkeit[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 197,85 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||||||
| Dichte |
1,65 g·cm−3 (14 °C)[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
128 °C[2] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
| ||||||||||||||||||
| Brechungsindex |
1,4584[4] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Diphosgen ist eine chlorhaltige, giftige chemische Verbindung. Sie wurde wie Phosgen im Ersten Weltkrieg als Lungenkampfstoff verwendet. Es wird auch als Perstoff bezeichnet.
Geschichte[Bearbeiten | Quelltext bearbeiten]
Diphosgen wurde zum ersten Mal am 23. Juni 1916 von deutschen Truppen bei Verdun im Raum Fort de Souville und Fort de Tavannes an der Westfront als Grünkreuzkampfstoff in Granatfüllungen eingesetzt.
Gewinnung und Darstellung[Bearbeiten | Quelltext bearbeiten]
Technische Herstellung[Bearbeiten | Quelltext bearbeiten]
Disphosgen wird technisch meist durch Photochlorierung von Ameisensäuremethylester unter UV-Licht hergestellt.[5]
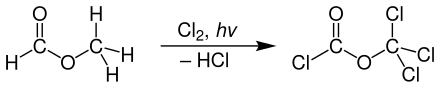
Man nutzt für die Erzeugung von UV-Licht häufig Quecksilber-Hochdrucklampen und führt die Reaktion in Rührkesselreaktoren durch.[5]
Labormaßstab[Bearbeiten | Quelltext bearbeiten]
Wegen der hohen Flüchtigkeit des Methylformiats und dessen hoher, mitunter explosiver Reaktionsfreudigkeit wird zumindest im Labor die radikalische Chlorierung von Chlorameisensäuremethylester vorgezogen. Dieser ist preiswert erhältlich und wird aus Phosgen und Methanol gewonnen:

Chemische Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Diphosgen zersetzt sich beim Erwärmen in zwei Moleküle Phosgen (Thermolyse).

Verwendung[Bearbeiten | Quelltext bearbeiten]
Diphosgen wird als weniger gefährlicher Ersatz für Phosgen z. B. bei der Herstellung von Chlorameisensäureestern, Carbonaten, Isocyanaten und Isocyaniden verwendet. Militärisch wurde es unter dem Namen Grünkreuz als Kampfstoff verwendet.
Außerdem dient es im Labor als Syntheseäquivalent für Phosgen („dimeres Phosgen“); in der Praxis ist das Triphosgen jedoch besser handhabbar.
Biologische Bedeutung[Bearbeiten | Quelltext bearbeiten]
Symptome der Vergiftung mit Phosgen oder Diphosgen sind Stunden nach dem Einatmen quälender Husten, bräunlicher Auswurf durch Blutbeimischung, Blauanlaufen der Haut (Zyanose) und Lungenödeme. Unbehandelt endet die Vergiftung mit Phosgen oder Diphosgen in qualvollem Ersticken.
Sicherheitshinweise[Bearbeiten | Quelltext bearbeiten]
Diphosgen ist hochgiftig. Die Letale Dosis LD100 beträgt 6 mg/l bei einer Einwirkzeit von einer Minute, der LCt50 3200 mg·min·m−3 und der ICt50 1600 mg·min·m−3.
Nachweis[Bearbeiten | Quelltext bearbeiten]
Das entstehende Phosgen kann mit Prüfröhrchen nachgewiesen werden.
Siehe auch[Bearbeiten | Quelltext bearbeiten]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c Valeria B. Arce, Carlos O. Della Védova, Anthony J. Downs, Simon Parsons, Rosana M. Romano: Trichloromethyl Chloroformate (“Diphosgene”), ClC(O)OCCl3: Structure and Conformational Properties in the Gaseous and Condensed Phases. In: Journal of organic chemistry. Band 71, Nr. 9, 2006, S. 3423–3428, doi:10.1021/jo052260a (englisch).
- ↑ a b c d e f g Eintrag zu Trichlormethylchlorformiat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2020. (JavaScript erforderlich)
- ↑ a b c Eintrag zu Diphosgen. In: Römpp Online. Georg Thieme Verlag, abgerufen am 2. September 2014.
- ↑ Chlorameisensäure-trichlormethylester (Diphosgen). In: Kohlensäure-Derivate (= Methoden der organischen Chemie. Erweiterungs- u. Folgebd. zur 4. Aufl., Band E4). Thieme Verlag, 1983, ISBN 3-13-217404-1, II. Dikohlensäure-Derivate mit Orthokohlensäure-Funktionen: a) mit einer Orthokohlensäure-Funktion, S. 1204, doi:10.1055/b-0035-112295 (In der Vorschau einsehbar).
- ↑ a b Alan R. Katritzky, Richard J K Taylor (Hrsg.): Comprehensive Organic Functional Group Transformations II. 2. Auflage. Elsevier Science, 2004, ISBN 978-0-08-044256-3, S. 955 (eingeschränkte Vorschau in der Google-Buchsuche).

