Plumban
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
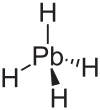
| ||||||||||
| Allgemeines | ||||||||||
| Name | Plumban | |||||||||
| Andere Namen |
Bleiwasserstoff | |||||||||
| Summenformel | PbH4 | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 211,23 g·mol−1 | |||||||||
| Aggregatzustand |
gasförmig | |||||||||
| Siedepunkt | ||||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||
Plumban, auch Bleiwasserstoff, ist ein sehr giftiges Gas. Es hat die Formel PbH4 und besitzt einen Siedepunkt von −13 °C.
Gewinnung und Darstellung[Bearbeiten | Quelltext bearbeiten]
Plumban entsteht durch Einwirkung von kathodisch entwickeltem atomaren Wasserstoff auf zerstäubtes Blei.[3]
Es wird in Analogie zu Bismutan (BiH3) auch gebildet, wenn Dimethylplumban mit der Formel (CH3)2PbH2 oberhalb von −50 °C disproportioniert.[3]
Bei der Herstellung von Tetraethylblei entsteht Plumban in kleinen Mengen als Nebenprodukt.
Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Im Gegensatz zum analog aufgebauten Methan (CH4) ist Plumban chemisch instabil. Wenn man das Gas über eine erhitzte Oberfläche leitet, zerfällt es unter Abscheidung eines Bleispiegels. Der Grund dafür liegt darin, dass Blei als Metall elektropositiver als die gebundenen Wasserstoffatome ist, den Wasserstoff also als Hydrid bindet.
Beständiger als das Plumban sind Derivate mit organischen Substituenten, beispielsweise
- Tetramethylblei Pb(CH3)4 oder
- Tetraethylblei Pb(C2H5)4 (TEL).
Diese Stoffe wurden vor der Entwicklung des bleifreien Benzins als Antiklopfmittel eingesetzt. Da sie hautresorbierbar und giftig sind (MAK-Wert von TEL 0,075 mg/m3), hat man bleihaltiges Benzin seit 1998 in Deutschland, seit 2000 in der gesamten Europäischen Union verboten.
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1011.
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ a b A. F. Holleman, E. Wiberg: Lehrbuch der Anorganischen Chemie. 57.–70. Auflage. Walter de Gruyter, Berlin 1964, S. 362.

