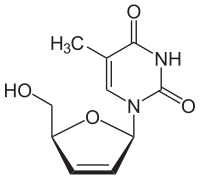
Stavudin
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Freiname | Stavudin | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C10H12N2O4 | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Arzneistoffangaben | |||||||||||||||||||
| ATC-Code | |||||||||||||||||||
| Wirkstoffklasse |
Virostatikum, nukleosidische Reverse-Transkriptase-Inhibitoren | ||||||||||||||||||
| Wirkmechanismus | |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 224,21 g·mol−1 | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit |
löslich in Wasser (6,6 g·l−1 bei 25 °C)[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Stavudin (d4T) (Handelsname: Zerit®; Hersteller: Bristol-Myers Squibb) ist ein Arzneistoff zur Behandlung von mit HIV-1 infizierten Patienten im Rahmen einer antiretroviralen Kombinationstherapie, wird heute in den westlichen Industrieländern jedoch kaum noch eingesetzt.
Er gehört zur Gruppe der nukleosidischen Reverse-Transkriptase-Inhibitoren (NRTI).
Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Stavudin kann in vier verschiedenen Kristallformen auftreten. Die polymorphen Formen I, II und IV unterscheiden sich anhand ihrer Schmelzpunkte mit 168,1 °C, 165,5 °C und 169,5 °C. Form I ist die bei Raumtemperatur thermodynamisch stabile Form. Bei Form III handelt es sich um 1/3-Hydrat mit einem stöchiometrischen Verhältnis von Wirkstoff zu Wasser von 3 : 1 im Kristallgitter.[1]
Pharmakologie[Bearbeiten | Quelltext bearbeiten]
In vitro wurde die antiretrovirale Aktivität von Stavudin nachgewiesen. Die Substanz ist in vitro ca. 5- bis 10-mal schwächer als Zidovudin. In Kombination mit anderen antiviralen Wirkstoffen konnten synergistische Wirkungen nachgewiesen werden. Die Entwicklung Stavudin-resistenter HI-Viren wurde in vitro nachgewiesen.
Pharmakokinetik[Bearbeiten | Quelltext bearbeiten]
Die Bioverfügbarkeit von Stavudin ist gut. Etwa 90 % werden oral resorbiert. Die gleichzeitige Einnahme mit der Nahrung hat nur geringe, klinisch nicht relevante, Auswirkungen. Nach Einnahme von 40 mg werden im Plasma Spitzenkonzentrationen von ca. 0,8–1,0 mg/l erzielt. Liquorkonzentrationen: bis ca. 70 % der Plasmakonzentrationen. Eliminationshalbwertzeit: ca. 1,6 Stunden. Intrazelluläre Halbwertzeit des biologisch aktiven Triphosphates: ca. 3,5 Stunden.
Nebenwirkungen[Bearbeiten | Quelltext bearbeiten]
Stark mitochondrial toxisch, Lipoatrophie, periphere Neuropathien (PNP), vor allem in Kombination mit DDI, selten Diarrhoe, Übelkeit, Kopfschmerzen, Steatosis hepatis, Pankreatitis, sehr selten: Laktatazidose. Kontraindiziert bei PNP. Neurotoxische Medikamente vermeiden (Ethambutol, Cisplatin, INH, Vincristin etc.).
Entwicklung[Bearbeiten | Quelltext bearbeiten]
Die Substanz wurde 1966 von Jerome P. Horwitz synthetisiert.[4]
Weblinks[Bearbeiten | Quelltext bearbeiten]
- AIDSMeds.com
- Informationen für Ärzte und Apotheker zur rationalen Infektionstherapie: Stavudin, ein weiteres Nukleosid-Analogon zur Behandlung der HIV-Infektion
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c d Lu, J.; Rohani, S.: Polymorphic Crystallization and Transformation of the Anti-Viral/HIV Drug Stavudine in Org Process Res Dev. 13 (2009) 1262–1268, doi:10.1021/op900004c.
- ↑ a b Eintrag zu Stavudine in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM) (Seite nicht mehr abrufbar)
- ↑ Datenblatt 2′,3′-Didehydro-3′-deoxythymidine, ≥98% (TLC) bei Sigma-Aldrich, abgerufen am 18. November 2019 (PDF).
- ↑ J. R. Horwitz, J. Chua, M. A. Da Rooge, M. Noel, I. L. Klundt: Nucleosides. IX. The formation of 2',2'-unsaturated pyrimidine nucleosides via a novel beta-elimination reaction. In: The Journal of organic chemistry. Band 31, Nummer 1, Januar 1966, S. 205–211, PMID 5900814.