Zinn(IV)-fluorid
| Kristallstruktur | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
| _ Sn4+ _ F− | ||||||||||||||||
| Kristallsystem |
tetragonal | |||||||||||||||
| Raumgruppe |
I4/mmm (Nr. 139) | |||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Zinn(IV)-fluorid | |||||||||||||||
| Andere Namen |
Zinntetrafluorid | |||||||||||||||
| Verhältnisformel | SnF4 | |||||||||||||||
| Kurzbeschreibung |
farbloser Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 194,70 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||
| Dichte |
4,78 g·cm−3[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Zinn(IV)-fluorid ist eine anorganische chemische Verbindung des Zinns aus der Gruppe der Fluoride.
Gewinnung und Darstellung[Bearbeiten | Quelltext bearbeiten]
Zinn(IV)-fluorid kann durch Reaktion von Zinn(IV)-chlorid mit Fluorwasserstoff gewonnen werden.[2]
Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Zinn(IV)-fluorid ist ein farbloser äußerst hygroskopischer Feststoff, der sich in Wasser unter starkem Zischen löst.[2]
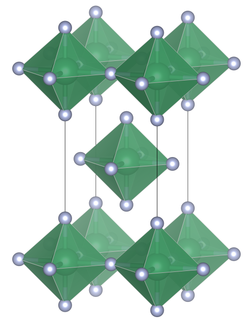
Die Verbindung besteht wie Blei(IV)-fluorid aus SnF6-Oktaedern die über gemeinsame äquatoriale Brücken mit jeweils vier SnF6-Oktaedern zu planaren Schichten verknüpft sind.[3][4]
Zinn(IV)-fluorid hat möglicherweise einen positiven Einfluss auf bleifreie Perowskit-Solarzellen.[5]
Sicherheitshinweise[Bearbeiten | Quelltext bearbeiten]
Zinn(IV)-fluorid ist toxisch bei Verschlucken und sollte daher nicht mit der Haut in Kontakt kommen, inhaliert werden oder oral aufgenommen werden.[1]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c d e Datenblatt Tin(IV) fluoride bei Sigma-Aldrich, abgerufen am 25. Mai 2017 (PDF).
- ↑ a b c d Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band I, Ferdinand Enke, Stuttgart 1975, ISBN 3-432-02328-6, S. 232.
- ↑ A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9, S. 970.
- ↑ Catherine E. Housecroft, Edwin C. Constable: Chemistry: An Introduction to Organic, Inorganic and Physical Chemistry. Pearson Education, 2010, ISBN 0-273-73308-7, S. 769 (eingeschränkte Vorschau in der Google-Buchsuche ).
- ↑ Bleifreie Perowskit-Solarzellen. Abgerufen am 29. Juli 2021.

