Mescalin
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
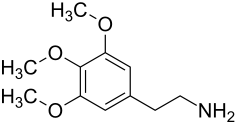
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Mescalin | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel |
| ||||||||||||||||||
| Kurzbeschreibung |
farbloser Feststoff[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | |||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| pKS-Wert |
9,56[5] | ||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Mescalin oder Meskalin ist ein psychedelisch und halluzinogen wirksames Alkaloid aus der Stoffgruppe der Phenethylamine.
Vorkommen[Bearbeiten | Quelltext bearbeiten]


Mescalin findet sich in dem mittelamerikanischen Peyote-Kaktus (Lophophora williamsii), in den Kakteen Echinopsis pachanoi, Echinopsis peruviana, Echinopsis lageniformis, Echinopsis santaensis und Echinopsis schoenii aus der südamerikanischen Kakteengattung Echinopsis sowie in vielen weiteren Kakteenarten in geringen Spuren (unter 0,1 % Gesamtgehalt).[9][10][11]
Geschichte[Bearbeiten | Quelltext bearbeiten]
Entdeckung und Synthese[Bearbeiten | Quelltext bearbeiten]
Louis Lewin beschrieb 1888 den nach ihm benannten Kaktus „Anhalonium Lewinii“ (Lophophora williamsii, Peyote), dessen chemisches Prinzip er extrahierte und untersuchte. Dieses nannte er „Anhalonin“ (eine mescalinhaltige Alkaloidfraktion).[12] Zur selben Zeit stellte auch Arthur Heffter Forschungen über Lophophora williamsii an, wobei er den Reinstoff Mescalin erstmals 1896 isolierte;[13][14] Ernst Späth gelang 1919 die Strukturaufklärung und die erste Totalsynthese.[15]
Verwendung[Bearbeiten | Quelltext bearbeiten]
Als Halluzinogen war Mescalin neben LSD in der Drogenszene der 1960er-Jahre weit verbreitet. Es wurde mit Blick auf den sozialen Kontext der US-amerikanischen Indigenen-Reservate von einigen Medizinern und Ethnologen wiederholt als Alternative zum Alkohol vorgeschlagen. Die Wirkung von Mescalin ist im 20. Jahrhundert außer von Anthropologen (besonders von Richard Evans Schultes, Weston La Barre, J. S. Slotkin) sowie Neurowissenschaftlern (Heinrich Klüver) auch von manchen Schriftstellern und Künstlern erforscht worden, unter anderem von Aldous Huxley, Antonin Artaud, Allen Ginsberg, Ernst Jünger, Carlos Castaneda und Henri Michaux.
Von der ethnobotanischen Nutzung von mescalinhaltigen Kakteen zeugen Funde von Tonwaren, Textilien, Grabfiguren und Felszeichnungen aus der amerikanischen Frühgeschichte.[16][17] Bei der Ankunft der Spanier in Peru war die Nutzung von Trichocereus macrogonus var. pachanoi als zeremonielle Pflanze verbreitet. Die römisch-katholische Kirche verfolgte diese rituellen Nutzungen.[18] Für die 1914 gegründete Native American Church wurde in den USA eine Sonderregel festgelegt, die es den Gläubigen erlaubt, den Peyote-Kaktus oder das darin enthaltene Meskalin zu besitzen und zu konsumieren.[19]
Chemie[Bearbeiten | Quelltext bearbeiten]
Mescalin kann aus Kakteen mittels Extraktion gewonnen werden, es lässt sich aber auch synthetisch herstellen. Strukturverwandt mit Mescalin ist das 3-Methoxy-4,5-methylendioxyamphetamin (MMDA), welches nach Einnahme von Myristicin, einem Inhaltsstoff des Muskatnussöls, möglicherweise als Stoffwechselprodukt entsteht. MMDA ist das Methoxy-Analogon des 3,4-Methylendioxyamphetamins (MDA). Auch sind 3,4,5-Trimethoxyamphetamin (TMA), 2,4,5-Trimethoxyamphetamin (TMA-2) und 2,4,6-Trimethoxyamphetamin (TMA-6) bekannte Amphetamin-Analoga des Mescalins mit ähnlich psychedelischer Wirkung. Der Mescalingrundkörper war Vorlage für die Entwicklung der 2C-Stoffgruppe sowie Vertreter der Dimethoxyamphetamine.[20]
Analytik[Bearbeiten | Quelltext bearbeiten]
Zur qualitativen und quantitativen Bestimmung des Stoffs kommt nach angemessener Probenvorbereitung die Kopplung der HPLC oder Gaschromatographie mit der Massenspektrometrie zur Anwendung.[21][22][23]
Pharmakologie[Bearbeiten | Quelltext bearbeiten]
Die Pharmakodynamik des Mescalins besteht in einer Bindung und Aktivierung des Serotonin-Rezeptors 5-HT2A als Partialagonist mit relativ starker Affinität (Bindungsstärke).[24][25] Auch besteht eine Wirkung am Serotonin-Rezeptor 5-HT2C.[26]
Die oral wirksame Dosis wird mit 200 bis 400 mg (als Mescalin-Sulfat) und 178 bis 356 mg (als Mescalin-Hydrochlorid) angegeben.[27][28] Der Rausch selbst hält dann sechs bis neun Stunden an. Nachwirkungen können bis zu zwölf Stunden wahrgenommen werden. Die Plasmahalbwertszeit von Mescalin wird mit sechs Stunden angegeben.[29]
Bevor die Wirkung einsetzt, kommt es meist zu Übelkeit und oft auch zu Erbrechen. Zunächst setzen Hyperaktivität und innere Unruhe ein, dann leicht veränderte Wahrnehmung und ein intensiviertes Farbensehen. Halluzinatorische Visionen und Traumbilder mit Realitätsverlust und Glücksgefühlen treten auf. Intensiv leuchtende Farben werden wahrgenommen. Die Wahrnehmung mit allen Sinnen ist subjektiv deutlich geschärft. Es kommt häufig zu Synästhesien.
Risiken des Drogenkonsums[Bearbeiten | Quelltext bearbeiten]

Mescalin kann unter Umständen eine substanzinduzierte Psychose oder persistierende Wahrnehmungsstörungen (Hallucinogen persisting perception disorder, HPPD)[32] auslösen. Auch können sogenannte „Horrortrips“ auftreten; es wurde jedoch gezeigt, dass sich je nach Set und Setting diese stark reduzierten.[33]
Bei starker Erregung ist unter anderem medizinische Behandlung indiziert – „Goodman & Gilman’s The Pharmacological Basis of Therapeutics“ schlägt Diazepam peroral vor, allerdings haben sich beruhigende Gespräche als wirksam erwiesen und sind daher als erste Maßnahme angezeigt. Antipsychotika können das Erleben verstärken und sind daher nicht angezeigt.[34]
In einer retrospektiven Querschnittsstudie (2013) von Patientenangaben in Fragebögen aus den Jahren 2001 bis 2004 wurde ein möglicher statistischer Zusammenhang zwischen ärztlicher Behandlung innerhalb des vergangenen Jahres wegen psychischer oder psychiatrischer Probleme und mindestens einmaliger Einnahme von Mescalin/Peyote während des gesamten Lebens untersucht. Die Unterlagen des National Survey of Drug Use and Health (NSDUH), durchgeführt vom Gesundheitsministerium der USA, lieferten die Daten von 130.152 solcher Patienten für diesen Zeitraum. Davon hatten 9.374 angegeben, mindestens einmal im Leben Mescalin/Peyote eingenommen zu haben. Ein statistisch signifikanter Zusammenhang zwischen den untersuchten Variablen wurde nicht gefunden. Die Autoren folgerten daraus, dass eine mindestens einmalige Einnahme von Mescalin/Peyote während des gesamten Lebens kein unabhängiger Risikofaktor für psychische Probleme des vergangenen Jahres sei. Sie wiesen jedoch darauf hin, dass eine Studie dieser Art keine Hinweise auf mögliche ursächliche Zusammenhänge gebe.[35]
Ein besonderes Risiko besteht in der Kombination mit MAO-Hemmern, die in Medikamenten wie Antidepressiva (Moclobemid) und dopaminerg wirkenden Anti-Parkinson-Mitteln (Selegilin) sowie in der halluzinogenen Droge Ayahuasca (Harmalin) enthalten sind. Da MAO-Hemmer die Wirkung von serotonergen Stoffen, zu denen Mescalin zählt, in erheblichem und unvorhersehbarem Maße verstärken,[36][37][38][39][40] besteht hier ein unkalkulierbares Risiko, auch vor dem Hintergrund, dass manche MAO-Hemmer über Tage nachwirken. Typische Folgen der Kombination von Mescalin mit MAO-Hemmern sind Erscheinungen des Serotoninsyndroms, die durch Störung der Steuerung der Atemmuskulatur bis zum Tode führen können.
Rechtslage[Bearbeiten | Quelltext bearbeiten]
In den 1950er und 1960er Jahren war Mescalin noch legal; viele Psychotherapeuten, Philosophen und Forscher experimentierten damit. Mit der Vierten Betäubungsmittel-Gleichstellungsverordnung (4. BtMGlV)[41] vom 21. Februar 1967, in Kraft getreten am 25. Februar 1967, wurde Mescalin in der Bundesrepublik Deutschland den betäubungsmittelrechtlichen Vorschriften des Opiumgesetzes unterstellt. Weltweit illegalisiert wurde es 1971 durch die UN-Konvention über psychotrope Stoffe. In den USA stehen auf Mescalinbesitz bis zu fünf Jahre Haft.
Mescalin ist in Deutschland aufgrund seiner Aufführung in der Anlage I BtMG ein nicht verkehrsfähiges Betäubungsmittel. Der Umgang ohne Erlaubnis ist grundsätzlich strafbar.
In Österreich und Deutschland sind lebende mescalinhaltige Kakteen wie Lophophora williamsii oder Kakteen der Kakteengattung Echinopsis (früher Trichocereus) nicht im Betäubungs- bzw. Suchtmittelgesetz aufgeführt. Der Besitz und Handel sind erlaubt, sofern botanische Zwecke verfolgt werden. Handel und Besitz zubereiteter Pflanzenteile zur Verwendung als Droge sind auf Grund des enthaltenen Mescalins verboten.[42]
Literatur[Bearbeiten | Quelltext bearbeiten]
- Bruce K. Cassels, Patricio Sáez-Briones: Dark Classics in Chemical Neuroscience: Mescaline. In: ACS Chemical Neuroscience. 2018, doi:10.1021/acschemneuro.8b00215 (Review).
- Halpern JH, Sherwood AR, Hudson JI, et al.: Psychological and cognitive effects of long-term peyote use among Native Americans. Biol Psychiatry 2005;58:624–631
- Hermle L, Funfgeld M, Oepen G, et al.: Mescaline-induced psychopathological, neuropsychological, and neurometabolic effects in normal subjects: Experimental psychosis as a tool for psychiatric research. Biol Psychiatry 1992;32:976–991
- Aldous Huxley: Die Pforten der Wahrnehmung & Himmel und Hölle. Serie Piper 6. Piper, München 1970, ISBN 3-492-01853-X; später ISBN 3-492-20006-0.
- Heinrich Klüver: Mescal: The ‘divine’ plant and its psychological effects. K. Paul, Trench, Trubner & Co., 1928
- Mike Jay: Mescaline: A Global History of the First Psychedelic. Yale University Press. 2019.
- Beatriz Caiuby Labate, Clancy Cavnar: Peyote: History, Tradition, Politics, and Conservation. Praeger. 2016.
- Michael Pollan: Kaffee Mohn Kaktus: Eine Kulturgeschichte psychoaktiver Pflanzen. Verlag Antje Kunstmann, München 2022, ISBN 978-3-95614-486-8.
- Wolbach AB Jr, Miner EJ, Isbell H.: Cross-tolerance between mescaline and LSD, with a comparison of mescaline and LSD reactions. Psychopharmacology 1962;3:1–14
Weblinks[Bearbeiten | Quelltext bearbeiten]
- Mescalin. In: Erowid. (englisch)
- isomerdesign.com: Mescaline (englisch)
- Aldous Huxley: The Doors of Perception
- Spektrum.de: Meskalin – Mystik aus Kaktusspitzen
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ T. Passie, U. Benzenhöfer: MDA, MDMA, and other “mescaline-like” substances in the US military’s search for a truth drug (1940s to 1960s). In: Drug testing and analysis. Band 10, Nummer 1, Januar 2018, S. 72–80, doi:10.1002/dta.2292, PMID 28851034 (Review).
- ↑ Eintrag zu Mescalin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 4. April 2019.
- ↑ a b c d The Merck Index. An Encyclopaedia of Chemicals, Drugs and Biologicals. 14. Auflage. 2006, ISBN 0-911910-00-X, S. 1019.
- ↑ a b c SWGDRUG Monographs: PEYOTE & MESCALINE Monograph (PDF; 484 kB), abgerufen am 20. Mai 2013.
- ↑ a b Eintrag zu Mescaline in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM) (Seite nicht mehr abrufbar)
- ↑ Produktinformation Mescaline (hydrochloride) (PDF). Cayman Chemicals; abgerufen am 21. April 2014.
- ↑ a b Datenblatt Mescaline hydrochloride bei Sigma-Aldrich, abgerufen am 25. März 2023 (PDF).
- ↑ Albert Gossauer: Struktur und Reaktivität der Biomoleküle, Verlag Helvetica Chimica Acta, Zürich 2006, ISBN 3-906390-29-2, S. 247.
- ↑ O. Ogunbodede, D. McCombs, K. Trout, P. Daley, M. Terry: New mescaline concentrations from 14 taxa/cultivars of Echinopsis spp. (Cactaceae) (“San Pedro”) and their relevance to shamanic practice. In: Journal of ethnopharmacology, Band 131, Nummer 2, September 2010, S. 356–362, doi:10.1016/j.jep.2010.07.021. PMID 20637277.
- ↑ Yohei Hashimoto, Kazuko Kawanishi, Masataka Moriyasu: Forensic Chemistry of Alkaloids by Chromatographic Analysis. In: The Alkaloids: Chemistry and Pharmacology, Band 32, 1988, S. 40 (doi:10.1016/S0099-9598(08)60215-1).
- ↑ Keeper Trout: Cactus Chemistry by Species, 2014. doi:10.13140/RG.2.1.4715.8886.
- ↑ L. Lewin: Ueber Anhalonium Lewinii. In: Archiv für Experimentelle Pathologie und Pharmakologie, 24, 1888, S. 401–411, doi:10.1007/bf01923627.
- ↑ Arthur Heffter: Ueber Pellote. In: Archiv für experimentelle Pathologie und Pharmakologie, 34, 1894, S. 65, doi:10.1007/bf01864855.
- ↑ A. Heffter: Ueber Pellote. In: Archiv für experimentelle Pathologie und Pharmakologie. 40, 1898, S. 385, doi:10.1007/BF01825267.
- ↑ Ernst Späth: Über die Anhalonium-Alkaloide: I. Anhalin und Mezcalin. In: Monatsh. Chem., 40, Nr. 2, 1919, S. 129–154, doi:10.1007/BF01524590.
- ↑ Bonnie Glass-Coffin: Shamanism and San Pedro through Time: Some Notes on the Archaeology, History, and Continued Use of an Entheogen in Northern Peru. In: Anthropology of Consciousness. Band 21, Nr. 1, März 2010, S. 58–82, doi:10.1111/j.1556-3537.2010.01021.x.
- ↑ Hesham R. El-Seedi, Peter A. G. M. De Smet, Olof Beck, Göran Possnert, Jan G. Bruhn: Prehistoric peyote use: Alkaloid analysis and radiocarbon dating of archaeological specimens of Lophophora from Texas. In: Journal of Ethnopharmacology. Band 101, Nr. 1, 3. Oktober 2005, S. 238–242, doi:10.1016/j.jep.2005.04.022.
- ↑ Laura Larco: Archivo Arquidiocesano de Trujillo Sección Idolatrías. (Años 1768–1771). In: Más allá de los encantos: Documentos históricos y etnografía contemporánea sobre extirpación de idolatrías en Trujillo (siglos XVIII-XX) (= Travaux de l’IFEA). Institut français d’études andines, Lima 2015, ISBN 978-2-8218-4453-7, S. 67–87 (openedition.org [abgerufen am 15. April 2022]).
- ↑ U.S. v. Boyll, 774 F.Supp. 133 – September 3, 1991. Abgerufen am 15. April 2022.
- ↑ A. T. Shulgin, M. F. Carter: Centrally active phenethylamines. In: Psychopharmacology communications, Band 1, Nummer 1, 1975, S. 93–98, PMID 1223994.
- ↑ Gambelunghe C, Marsili R, Aroni K, Bacci M, Rossi R: GC-MS and GC-MS/MS in PCI mode determination of mescaline in peyote tea and in biological matrices., J Forensic Sci. 2013 Jan;58(1):270-8, . PMID 22900815.
- ↑ Nisbet LA, Wylie FM, Logan BK, Scott KS: Gas Chromatography-Mass Spectrometry Method for the Quantitative Identification of 23 New Psychoactive Substances in Blood and Urine., J Anal Toxicol. 2019 Jun 1;43(5):346–352, PMID 30698723.
- ↑ Yang S, Shi Y, Chen Z, Chen M, Liu X, Liu W, Su M, Di B: Detection of mescaline in human hair samples by UPLC-MS/MS: Application to 19 authentic forensic cases., J Chromatogr B Analyt Technol Biomed Life Sci. 2022 Apr 15;1195:123202, PMID 35248899.
- ↑ A. Rickli, O. D. Moning, M. C. Hoener, M. E. Liechti: Receptor interaction profiles of novel psychoactive tryptamines compared with classic hallucinogens. In: European neuropsychopharmacology: the journal of the European College of Neuropsychopharmacology, Band 26, Nummer 8, August 2016, S. 1327–1337, doi:10.1016/j.euroneuro.2016.05.001, PMID 27216487.
- ↑ D. E. Nichols: Psychedelics. In: Pharmacological reviews. Band 68, Nummer 2, April 2016, S. 264–355, doi:10.1124/pr.115.011478, PMID 26841800, PMC 4813425 (freier Volltext) (Review).
- ↑ Neuropharmacology of Hallucinogens. In: Erowid.org. Februar 2004, abgerufen am 21. Februar 2012 (englisch).
- ↑ PiHKAL #96 Meskalin
- ↑ Erowid: Mescaline Dosage
- ↑ K. D. Charalampous, K. E. Walker, John Kinross-Wright: Metabolic fate of mescaline in man. In: Psychopharmacologia, 9, 1966, S. 48–63; doi:10.1007/BF00427703.
- ↑ Robert Gable: Drug Toxicity. Abgerufen am 17. Februar 2011 (englisch).
- ↑ R. S. Gable: Acute toxicity of drugs versus regulatory status. In: J. M. Fish (Ed.): Drugs and Society: U.S. Public Policy. Rowman & Littlefield Publishers, Lanham MD 2006, S. 149–162.
- ↑ J. H. Halpern, H. G. Pope: Hallucinogen persisting perception disorder: what do we know after 50 years? In: Drug and alcohol dependence, Band 69, Nummer 2, März 2003, S. 109–119, PMID 12609692 (Review).
- ↑ Richard Bunce: Social and political sources of drug effects: The case of bad trips on psychedelics. (Memento vom 20. Oktober 2002 im Internet Archive) In: E. Zinberg, W. M. Harding: Control Over Intoxicant Use: Pharmacological, Psychological, and Social Considerations. In: Human Sciences Press, 1982, S. 105–125.
- ↑ “Severe agitation may respond to diazepam (20 mg orally). ‘Talking down’ by reassurance also is effective and is the management of first choice. Antipsychotic medications may intensify the experience and thus are not indicated.” Laurence Brunton, Bruce A. Chabner, Bjorn Knollman: Goodman and Gilman’s Manual of Pharmacology and Therapeutics. Twelfth edition. McGraw-Hill 2011, ISBN 978-0-07-176939-6, S. 1537.
- ↑ Teri S. Krebs, Pål-Ørjan Johansen, Lin Lu: Psychedelics and Mental Health: A Population Study. In: PLoS ONE. 8, 2013, S. e63972, doi:10.1371/journal.pone.0063972.
- ↑ F. Sjöqvist: Psychotropic drugs (2): Interaction between monoamine oxidase (MAO) inhibitors and other substances. In: Proceedings of the Royal Society of Medicine. Band 58, Nummer 11 Part 2, November 1965, S. 967–978, PMID 4952963, PMC 1898666 (freier Volltext) (Review).
- ↑ M. G. Livingston, H. M. Livingston: Monoamine oxidase inhibitors: An update on drug interactions. In: Drug safety, Band 14, Nummer 4, April 1996, S. 219–227, PMID 8713690 (Review).
- ↑ J. P. Finberg: Update on the pharmacology of selective inhibitors of MAO-A and MAO-B: focus on modulation of CNS monoamine neurotransmitter release. In: Pharmacology & therapeutics. Band 143, Nummer 2, August 2014, S. 133–152, doi:10.1016/j.pharmthera.2014.02.010, PMID 24607445 (Review).
- ↑ D. I. Brierley, C. Davidson: Developments in harmine pharmacology: implications for ayahuasca use and drug-dependence treatment. In: Progress in neuro-psychopharmacology & biological psychiatry. Band 39, Nummer 2, Dezember 2012, S. 263–272, doi:10.1016/j.pnpbp.2012.06.001, PMID 22691716 (Review).
- ↑ R. S. Gable: Risk assessment of ritual use of oral dimethyltryptamine (DMT) and harmala alkaloids. In: Addiction. Band 102, Nummer 1, Januar 2007, S. 24–34, doi:10.1111/j.1360-0443.2006.01652.x, PMID 17207120 (Review).
- ↑ 4. BtMGlV vom 21. Februar 1967.
- ↑ Gesetz über den Verkehr mit Betäubungsmitteln