Iodtrichlorid
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Iodtrichlorid | |||||||||||||||
| Andere Namen | ||||||||||||||||
| Summenformel |
| |||||||||||||||
| Kurzbeschreibung |
rotbraune Kristalle mit stechendem Geruch[2] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 233,26 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte |
3,12 g·cm−3 [2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
77 °C (Zersetzung)[3] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Iodtrichlorid ist eine ätzende Interhalogenverbindung, die aus Iod und Chlor besteht. Diese wurde zuerst 1814 von Humphry Davy dargestellt.[4]
Geschichte
[Bearbeiten | Quelltext bearbeiten]Emil von Behring experimentierte mit zahlreichen Chemikalien, um ein Mittel gegen die Diphtherie zu finden. Bei einigen seiner Versuchstiere gelang ihm eine Heilung der Diphtherie mit Iodtrichlorid – wenn auch unter gravierenden Nebenwirkungen. Im Blut dieser geheilten Tiere fand von Behring anschließend das Antitoxin gegen das Diphtherietoxin, mit dem zum ersten Mal eine Behandlung des echten Krupps mit einem akzeptablen Nebenwirkungsspektrum möglich wurde. Er legte hiermit den Grundstein für die passive Immunisierung.[5][6]
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Iodtrichlorid entsteht, wenn man Chlor auf Iodchlorid einwirken lässt.[3]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]-
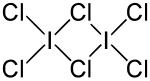
Bindungslängen und -winkel
-
Käufliches ICl3
Iodtrichlorid bildet im Unterschied zu anderen Interhalogenen ein Dimer, (ICl3)2. Dabei sind die Bindungswinkel sowie die Bindungslängen nicht identisch (vgl. obere Abbildung).[4] Iodtrichlorid riecht stechend und bildet gelbe Nadeln, die an der Luft zerfließen. Es löst sich gut in Alkohol, Ether und Benzol.[3]
Mit Wasser reagiert Iodtrichlorid zu Iodchlorid, Salzsäure und Iodsäure.[4]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Iodtrichlorid kann man in der präparativen organischen Chemie sowohl zur Iodierung als auch zur Chlorierung, beispielsweise für Aromaten, einsetzen.[3]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Eintrag zu IODINE TRICHLORIDE in der CosIng-Datenbank der EU-Kommission, abgerufen am 18. September 2021.
- ↑ a b c d e Datenblatt Iodtrichlorid bei Merck, abgerufen am 5. April 2011.
- ↑ a b c d Bernd Dill, Fred Robert Heiker, Andreas Kirschning (Hrsg.): Römpp Chemie Lexikon. 9. Auflage, Band 3, Georg Thieme Verlag, 1992, ISBN 978-3-13-734809-2, S. 2019.
- ↑ a b c A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 459.
- ↑ J. Simon: Emil Behring's Medical Culture: From Disinfection to Serotherapy. In: Med Hist. 51. Jahrgang, Nr. 2, 2007, S. 201–218, PMC 1871706 (freier Volltext).
- ↑ Behring, Emil: Untersuchungen über das Zustandekommen der Diphtherie-Immunität bei Thieren, in: Deutsche Medicinische Wochenschrift 50, 1890, S. 11.





