Eisen(II)-sulfid
| Kristallstruktur | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
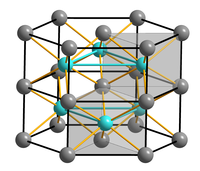
| |||||||||||||||||||
| _ Fe2+ _ S2− | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Eisen(II)-sulfid | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Verhältnisformel | FeS | ||||||||||||||||||
| Kurzbeschreibung |
dunkelgraue oder schwarze, metallartige Stücke, Platten oder Stäbchen[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 87,91 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
4,84 g·cm−3[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit |
praktisch unlöslich in Wasser[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Eisen(II)-sulfid (alte Bezeichnung Schwefeleisen) ist das Sulfid des zweiwertigen Eisens mit der Formel FeS.
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]
Eisen(II)-sulfid ist unlöslich in Wasser. Mit Säuren reagiert es unter Bildung von Schwefelwasserstoff:
Beim Erhitzen auf höhere Temperaturen erfolgt bei 138 °C und 325 °C jeweils eine kristallographische Umwandlung im festen Zustand.[3] Reines Eisen(II)-sulfid bildet hellbraune Kristalle des Nickelarsenid-Typs. Die technische Ware ist meist durch Resteisen dunkel bis schwarz gefärbt.
Herstellung
[Bearbeiten | Quelltext bearbeiten]Sowohl im Labor als auch technisch lässt sich Eisen(II)-sulfid durch kurzes Erhitzen eines Gemisches aus Eisenpulver und Schwefelpulver in einer exothermen Reaktion herstellen:
Vorkommen
[Bearbeiten | Quelltext bearbeiten]In der Natur findet sich Eisen(II)-sulfid als Pyrrhotin, Troilit und Mackinawit.[4]
Die bakterielle anaerobe Korrosion kann man durch die Schwarzfärbung durch Eisen(II)-sulfid erkennen, welches als Endprodukt entsteht. Dieser archaische Stoffwechsel der Bakterien spielt in der Eisen-Schwefel-Welt, einem Szenario für die frühe Evolution des Lebens, eine wichtige Rolle.
Die Grünfärbung von Eigelb stammt von bei langem Kochen (länger als 10 Minuten) gebildetem – unschädlichem – Eisensulfid.
Verwendung
[Bearbeiten | Quelltext bearbeiten]Eisen(II)-sulfid wurde früher für die Synthese der Schwefelsäure verwendet. Dabei wurde das Eisen(II)-sulfid unter Zufuhr von Luft geröstet, wobei das für die weitere Synthese benötigte Schwefeldioxid entstand. Im Labor kann Eisen(II)-sulfid zur Herstellung von Schwefelwasserstoff dienen. Dies kann z. B. im Kippschen Apparat durchgeführt werden.
Siehe auch
[Bearbeiten | Quelltext bearbeiten]- Eisen(II)-disulfid (FeS2)
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b Eintrag zu Eisensulfide. In: Römpp Online. Georg Thieme Verlag, abgerufen am 15. Juli 2014.
- ↑ a b c d Eintrag zu Eisen(II)-sulfid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 23. Juli 2016. (JavaScript erforderlich)
- ↑ D’Ans-Lax: Taschenbuch für Chemiker und Physiker, Band 3 (1998), S. 458; ISBN 3-540-60035-3.
- ↑ A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1657.


