2-Aminobenzimidazol
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | 2-Aminobenzimidazol | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C7H7N3 | ||||||||||||||||||
| Kurzbeschreibung | |||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 133,15 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Löslichkeit |
wenig löslich in Wasser (< 1 g·cm−3 bei 20 °C)[2], löslich in Ethanol und Aceton, wenig löslich in Diethylether, Benzol und DMSO[4] | ||||||||||||||||||
| Brechungsindex |
1,5341 (25 °C, 589 nm)[3] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
2-Aminobenzimidazol ist eine chemische Verbindung, die aus einem Benzolring und einem anellierten Imidazolring besteht und in 2-Stellung (d. h. zwischen den beiden Stickstoffatomen des Imidazols) eine Aminogruppe trägt. Dieser funktionelle bicyclische Heteroaromat ist Ausgangsstoff einer Vielzahl von physiologisch aktiven Substanzen[5], von pilz- und wurmabtötenden Mitteln bis zu auch gegen Problemkeime, wie z. B. Pseudomonas aeruginosa, wirksamen Wirkstoffen.[6]
Vorkommen und Darstellung[Bearbeiten | Quelltext bearbeiten]
Die Herstellung von 2-Aminobenzimidazol wurde erstmals 1908 aus dem außerordentlich giftigen Bromcyan und 1,2-Phenylendiamin berichtet.[7]

Wesentlich besser eignet sich die Synthese mit Cyanamid (statt Bromcyan) in wässriger Lösung, aus der 2-Aminobenzimidazol in 92%iger Ausbeute in hellbraunen Blättchen ausfällt.[8]
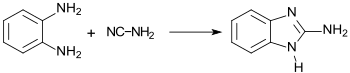
Weitere Synthesevarianten sind beschrieben, aber eher für am Benzolring substituierte Derivate im Labormaßstab geeignet.[5]
Eigenschaften[Bearbeiten | Quelltext bearbeiten]
2-Aminobenzimidazol ist ein schlecht wasserlöslicher Feststoff, der in Reinsubstanz in weißen Blättchen kristallisiert.[4] In polaren Lösungsmitteln, wie z. B. in Aceton und Ethanol, oder in Alkali löst er sich leicht.
Das Tautomerie-Gleichgewicht liegt entgegen der in der Erstpublikation von 1908 geäußerten Vermutung nicht auf Seiten des franz. orthophénylèneguanidine genannten Imids, sondern weit auf Seiten des Amins 2-Aminobenzimidazol.[9]

1H-Benzimidazol-2-amin erscheint auch als bakterielles Abbauprodukt der (in der EU obsoleten) Fungizide Carbendazim und Benomyl im Boden.[10]
Anwendungen[Bearbeiten | Quelltext bearbeiten]
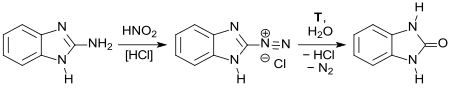
Wie bereits in der Erstpublikation 1908 berichtet, entsteht aus 1H-Benzimidazol-2-amin durch Diazotierung mit Salpetriger Säure HNO2 und anschließende Verkochung Benzimidazolon (Hydroxybenzimidazol, hier als „orthophénylèneurée“ bezeichnet).[11]
Die Reaktion von 2-Aminobenzimidazol mit Hydroxylamin-O-sulfonsäure HOSA liefert 1,2-Diaminobenzimidazol (75 % Ausbeute),
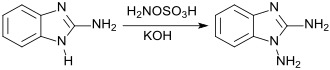
das antikorrosive Eigenschaften aufweist und dessen Derivate auf ihre Eignung als antibakteriell und antimykotisch wirksame Arzneistoffe untersucht wurden.[12]
Mit dem aus Phthalsäureanhydrid und Harnstoff zugänglichen 1,3-Diiminoisoindolin und 2-Aminobenzimidazol erhält man einen gelben Farbstoff, z. B. für Polyesterfasern.[13]

Mit Dicarbonylverbindungen bildet 2-Aminobenzimidazol leicht kondensierte Heterocyclen. So entsteht z. B. mit Acetylendicarbonsäuredimethylester ein Dihydropyrimido[1,2-a]benzimidazol.

2-Aminobenzimidazol ist Strukturelement einer größeren Zahl von Funktionschemikalien im Bereich von Fungiziden, wie z. B. Carbendazim, Benomyl, von Anthelmintika, wie z. B. Mebendazol, Fenbendazol, Oxfendazol, Albendazol und Flubendazol, sowie von Antibiotika gegen multiresistente MRSA-Keime.[14]
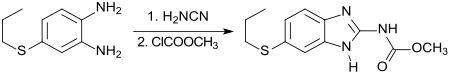
Eine gängige Route zum Aufbau dieser Verbindungen ist die Synthese eines (meist in 5-Stellung) abgewandelten 1,2-Phenylendiamins, dessen Ringschluss mit Cyanamid zum entsprechenden 2-Aminobenzimidazol und anschließende Derivatisierung an der Aminogruppe zum Endprodukt, wie z. B. bei dem Wurmmittel Albendazol.[15]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c Eintrag zu 2-Aminobenzimidazole bei TCI Europe, abgerufen am 30. Mai 2020.
- ↑ a b c d e f Datenblatt 2-Aminobenzimidazol zur Synthese bei Merck, abgerufen am 30. Mai 2020.
- ↑ a b Carl L. Yaws: Thermophysical Properties of Chemicals and Hydrocarbons, 2nd Edition. Elsevier Inc., Oxford, UK 2015, ISBN 978-0-323-28659-6, S. 149.
- ↑ a b William M. Haynes: CRC Handbook of Chemistry and Physics, 96th Edition. CRC Press, Boca Raton, FL, U.S.A. 2015, ISBN 978-1-4822-6097-7, S. 3–38.
- ↑ a b R. Rastogi, S. Sharma: 2-Aminobenzimidazole in Organic Syntheses. In: Synthesis. Band 11, 1983, S. 861–882, doi:10.1055/s-1983-30546.
- ↑ R. Frei, A.S. Breitbach, H.E. Blackwell: 2-Aminobenzimidazole derivatives strongly inhibit and disperse Pseudomonas aeruginosa biofilms. In: Angew. Chem. Int. Ed. Band 51, Nr. 21, 2012, S. 5226–5229, doi:10.1002/anie.201109258.
- ↑ P. Pierron: Sur les cyanamides aromatiques monoatomiques. In: Ann. Chim. Phys. Band 15, Nr. 8, 1908, S. 189–193 (bnf.fr).
- ↑ S. Weiss, H. Michaud, H. Prietzel, H. Krommer: Neue, einfache Synthese von 2-Aminobenzimidazol. In: Angew. Chem. Band 85, Nr. 19, 1973, S. 866–867, doi:10.1002/ange.19730851910.
- ↑ J. Backes, B. Heinz, W.G. Ried: Houben-Weyl: Methoden der Organischen Chemie, 4. Auflage. E 8c. Thieme, Stuttgart 1994, ISBN 978-3-13-797804-6, S. 219.
- ↑ Gerhard Eisenbrand, Alfred Hagen Meyer, Peter Schreier: RÖMPP Lexikon Lebensmittelchemie, 2. Aufl. Thieme Verlag, Stuttgart 2006, ISBN 978-3-13-736602-7, S. 405.
- ↑ P. Pierron: Sur les cyanamides aromatiques monoatomiques. In: Ann. Chim. Phys. Band 15, Nr. 8, 1908, S. 195 (bnf.fr).
- ↑ D. Vlaović, J. Čanadanović-Brunet, J. Balaž, I. Juranić, D. Djoković, K. Mackenzie: Synthesis, AntiBacteriol, and Antifungal Activities of Some New Benzimidazoles. In: Biosci. Biotech. Bioch. Band 56, Nr. 2, 1992, S. 199–206, doi:10.1271/bbb.56.199.
- ↑ Patent US3499908: Production of 1,3-bis(heterocycloimino)-isoindolines from 3-iminoisoindolenines and heterocyclic amines. Angemeldet am 14. November 1966, veröffentlicht am 10. März 1970, Anmelder: Farbenfabriken Bayer AG, Erfinder: H. Vollmann, H. Leister.
- ↑ R.W. Huisgens III, S. Reyes, C.S. Reed, C. Bunders, S.A. Rogers, A.T. Steinhauer, C. Melander: The chemical synthesis and antibiotic activity of a diverse library of 2-aminobenzimidazole small molecules against MRSA and multidrug-resistant A. baumannii. In: Bioorg. Med. Chem. Band 18, Nr. 2, 2010, S. 663–674, doi:10.1016/j.bmc.2009.12.003.
- ↑ Ruben Vardanyan, Victor Hruby: Synthesis of Essential Drugs. Elsevier Science, 2006, ISBN 978-0-444-52166-8, S. 585.
