Laurylamindipropylendiamin
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Laurylamindipropylendiamin | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | C18H41N3 | ||||||||||||||||||
| Kurzbeschreibung | |||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 299,54 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
182–184 °C (1 Torr)[4] | ||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Laurylamindipropylendiamin ist ein Derivat des Dodecylamins, das durch Cyanethylierung mit Acrylnitril und anschließende katalytische Hydrierung gebildet wird. Das langkettige Triamin besitzt Tensid- und Biozideigenschaften und wird in Schmierölen und Kühlschmierstoffen als Korrosionsschutzmittel, sowie in Desinfektionsreinigern verwendet.
Vorkommen und Darstellung
Die industrielle Herstellung des N,N-Bis(3-aminopropyl)dodecylamins geht aus von der gesättigten linearen C12-Fettsäure Laurinsäure [C11H23-COOH], die mit Ammoniak (NH3) zum Laurinsäureamid [C11H23-CONH2] umgesetzt und anschließend zum Laurinsäurenitril (Dodecannitril, C11H23-CN) dehydratisiert wird.
Neuerdings werden auch laurinsäurereiche Pflanzenöle, wie z. B. Kokosöl (ein Triglyceridgemisch mit ca. 50 % Laurinsäureanteil), in der Dampfphase mit Ammoniak an Übergangsmetallkatalysatoren wie z. B. Vanadium(V)-oxid V2O5 oder Zeolithen, wie z. B. HZSM-5 (Kat. 1) direkt bei 400 °C in ein laurinnitrilreiches Fettsäurenitrilgemisch (und Glycerin) überführt, aus dem das Dodecannitril herausdestilliert werden kann.[6]
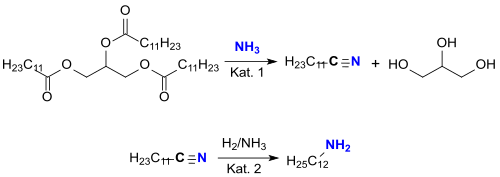
Das Laurinnitril wird an einem Raney-Nickel-Katalysator (Kat. 2) in Gegenwart von Ammoniak zur Unterdrückung der Bildung sekundärer Amine zu Laurylamin hydriert.
Dodecylamin addiert bei 110 °C an im Überschuss eingesetztes Acrylnitril im Sinne einer Michael-Addition. Dabei entsteht N,N-Di(cyanethyl)dodecylamin, das im nächsten Schritt mit Raney-Kobalt bei 140 °C in Gegenwart von Ammoniak in 88 %iger Ausbeute zu N-(3-Aminopropyl)-N-dodecylpropan-1,3-diamin hydriert wird.[7]
Mit Raney-Nickel als Katalysator wird bereits bei geringem Wasserstoffdruck von ca. 3,5 bar Laurylamindipropylendiamin praktisch quantitativ erhalten.[5]

Eigenschaften
Laurylamindipropylendiamin ist eine klare farblose bis schwach gelbe und niedrig viskose (38 mPa·s[8]) Flüssigkeit von aminartigem Geruch, deren wässrige Lösungen stark alkalisch reagieren (pH 11,2 in 1%iger Lösung bei 20 °C[3]). DPTA zeigt als Tensid starke Schaumbildung und ist mit nichtionischen, kationischen und einigen anionischen Tensiden kompatibel. Die Verbindung ist bioabbaubar (96 % in 12 Tagen).[3]
Anwendungen
Laurylamindipropylendiamin ist ein pH-stabiles Tensid mit bioziden Eigenschaften gegen Bakterien, einschließlich Mykobakterien und Problemkeimen, wie z. B. Pseudomonaden, sowie gegen behüllte Viren, wie z. B. den Grippeerreger Influenza-A-Virus H1N1 und den Hepatitis-B-Virus (HBV), auch in Gegenwart von Blut und Proteinen. Die Verbindung wird daher als Desinfektionsmittel für Instrumente in Medizin und Zahnmedizin und für Keimreduzierung auf festen Oberflächen, z. B. in der Lebensmittelindustrie verwendet.[9]
Wegen seiner keimhemmenden Wirkung wird DPTA auch in geschlossenen Wasserkreisläufen, wie in der Papierindustrie und in Kühltürmen und zur Konservierung von Kühlschmiermitteln, wie Bohr- und Schneidölen, eingesetzt, wo seine Dispergiermittel-, Schmierstoff- und Korrosionsschutzeigenschaften zusätzlich von Nutzen sind.
Laurylamindipropylendiamin wird von Lonza AG unter dem Markennamen Lonzabac® 12[8] und von Nouryon, früher AkzoNobel, unter dem Markennamen Triameen® Y12D[10] hergestellt und vermarktet.
Einzelnachweise
- ↑ Eintrag zu LAURYLAMINE DIPROPYLENEDIAMINE in der CosIng-Datenbank der EU-Kommission, abgerufen am 13. März 2020.
- ↑ a b c d e Eintrag zu N-(3-Aminopropyl)-N-dodecylpropan-1,3-diamin in der GESTIS-Stoffdatenbank des IFA, abgerufen am 19. Februar 2020. (JavaScript erforderlich)
- ↑ a b c d e Worksafe Australia (Hrsg.): Full Public Report: Lonzabac 12.100, File No: NA/64. Sydney 16. Dezember 1992 (gov.au).
- ↑ Frost, Albert E., Jr.; Martell, Arthur E.: Preparation of trimethylenediamines. In: Journal of Organic Chemistry. Band 15, 1950, S. 51–53, doi:10.1021/jo01147a009.
- ↑ a b T. T. Denton, A. S. Joyce, D. E. Kiely: Preparation of N-alkylbis(3-aminopropyl)amines by the catalytic hydrogenation of N-alkylbis(cyanoethyl)amines. In: J. Org. Chem. Band 72, Nr. 13, 2007, S. 4997–5000, doi:10.1021/jo070245v.
- ↑ Z. Shirazi, H. Tafazolian, S. Viamajala, S. Varanasi, Z. Song, M.J. Heben: High-yield production of fatty nitriles by one-step vapor-phase thermocatalysis of triglycerides. In: ACS Omega. Band 2, Nr. 12, 2017, S. 9013–9020, doi:10.1021/acsomega.zb01502.
- ↑ H. Oskarsson, M. Frankenberg, A. Annerling, K. Holmberg: Adsorption of novel alkylaminoamide sugar surfactants at tailor-made surfaces. In: J. Surfact. Chem. Band 10, 2007, S. 41–52, doi:10.1007/s11743-006-1007-1.
- ↑ a b Lonza, Hygiene Product Catalogue. (PDF; 410 KB) In: www.lonza.com/hygiene. Lonza AG, archiviert vom (nicht mehr online verfügbar) am 15. August 2018; abgerufen am 10. März 2020 (englisch). Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.
- ↑ Patent US6610248B1: Disinfectants. Angemeldet am 23. Juni 2000, veröffentlicht am 26. August 2003, Anmelder: Lonza AG, Erfinder: F. Lichtenberg, M. Lützeler, V. Ranft.
- ↑ Triameen Y12D. (PDF; 210 KB) In: www.surfacechemistry.nouryon.com. Nouryon, abgerufen am 10. März 2020 (englisch).



