Ammoniumchromat
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
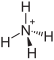 
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Ammoniumchromat | |||||||||||||||
| Andere Namen |
Ammoniummonochromat | |||||||||||||||
| Summenformel | (NH4)2CrO4 | |||||||||||||||
| Kurzbeschreibung |
gelbeorange, geruchlose Kristalle[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 152,07 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte |
1,8 g·cm−3[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit |
gut in Wasser (340 g·l−1 bei 20 °C)[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| MAK |
Schweiz: 5 μg·m−3 (berechnet als Chrom)[4] | |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Ammoniumchromat ist das Ammoniumsalz der Chromsäure mit der Summenformel (NH4)2CrO4.
Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Ammoniumchromat liegt in Form gelber, gut wasserlöslicher Kristalle vor, welche sich bei 185 °C explosionsartig zu Ammoniak, Stickstoff, Chrom(III)-oxid und Wasser zersetzen.[1] Des Weiteren kann Ammoniumchromat, aufgrund seiner oxidierenden Eigenschaften, auf gefährliche Weise mit Reduktionsmitteln oder brennbaren Stoffen reagieren. Wässrige Lösungen reagieren neutral.
Herstellung[Bearbeiten | Quelltext bearbeiten]
Auflösung von Chrom(VI)-oxid in einer Ammoniaklösung:
Verwendung[Bearbeiten | Quelltext bearbeiten]
Ammoniumchromat findet Verwendung bei der Herstellung von Eisen-Chromoxid-Katalysatoren.[5] Außerdem kann Ammoniumchromat zur Darstellung von Bleichromat dienen.
Sicherheitshinweise[Bearbeiten | Quelltext bearbeiten]
Ammoniumchromat ist als krebserzeugend insbesondere bei Aufnahme über die Atemwege eingestuft.[1] Hautkontakt kann zu Sensibilisierung führen. Bei der Handhabung ist daher entsprechende Schutzkleidung zu tragen.
Gesetzliche Hinweise[Bearbeiten | Quelltext bearbeiten]
Ammoniumchromat unterliegt der Chemikalienverbotsverordnung und dem Wasserhaushaltsgesetz. In industriellen Mengen unterliegt es außerdem der Störfallverordnung.
Ökotoxikologisch ist Ammoniumchromat als WGK 3 (stark wassergefährdend) eingestuft.[1]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c d e f g h Eintrag zu Ammoniumchromat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2021. (JavaScript erforderlich)
- ↑ Nicht explizit in Verordnung (EG) Nr. 1272/2008 (CLP) gelistet, fällt aber mit der angegebenen Kennzeichnung unter den Gruppeneintrag Chromium (VI) compounds, with the exception of barium chromate and of compounds specified elsewhere in this Annex im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 14. August 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Datenblatt Ammoniumchromat 98% bei Sigma-Aldrich, abgerufen am 13. November 2021 (PDF).
- ↑ Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach Chrom(VI)-Verbindungen), abgerufen am 9. November 2015.
- ↑ Patentanmeldung DE3819437A1: Verfahren zur Herstellung von Eisen-Chromoxidhaltigen Katalysatoren für die Hochtemperaturkonvertierung. Angemeldet am 8. Juni 1988, veröffentlicht am 14. Dezember 1989, Anmelder: BASF AG, Erfinder: Eberhard Ambach et al.

![{\displaystyle \mathrm {\ \!\ {\Biggr ]}_{2}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/574adab1409cb81da6c38bb738ad111e61bbb2d9)
![{\displaystyle \mathrm {\ \!\ {\Biggr ]}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/c9fd9553a0b623f5f669641be907d9186e35b739)




