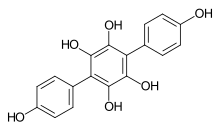
Atromentin
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||
| Allgemeines | |||||||||||||
| Name | Atromentin | ||||||||||||
| Andere Namen |
| ||||||||||||
| Summenformel | C18H12O6 | ||||||||||||
| Kurzbeschreibung |
bronzefarbene Tafeln[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 324,3 g·mol−1 | ||||||||||||
| Aggregatzustand |
fest | ||||||||||||
| Schmelzpunkt |
>300 °C[1] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Atromentin ist ein Pilzinhaltsstoff und ein Vertreter aus der Stoffklasse der Terphenylchinone. Die Verbindung wurde erstmals von Wilhelm Thörner 1878 beschrieben.[3]
Vorkommen[Bearbeiten | Quelltext bearbeiten]
Atromentin kommt in der braunen Außenhaut des Samtfußkremplings (Paxillus atrotomentosus, Basidiomycetes) vor. Im Pilzfleisch sind die farblosen Leucomentine vorhanden. Bei diesen sind eine, zwei oder drei Hydroxygruppen der zentralen Phenyl-Einheit mit (2Z,4S,5S)-4,5-Epoxy-2-hexensäure verestert.[1][4]
 |
 |
| Leucoatromentin | (2Z,4S,5S)-4,5-Epoxy-2-hexensäure |
Die Leucomentine können leicht alkalisch gespalten und zum Atromentin oxidiert werden. Mit verschiedenen Säuren veresterte Atromentinderivate kommen ebenfalls in Pilzen vor (Beispiel: Aurantiacin).
Biosynthese[Bearbeiten | Quelltext bearbeiten]
Atromentin entsteht bei der Biosynthese durch Dimerisierung von 4-Hydroxyphenylbrenztraubensäure.[1]
Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Atromentin wirkt unter anderem als Inhibitor für Enzyme der HIV-Replikation. Diese Verbindung ist daher ein vielversprechender Metabolit für die biomedizinische Forschung und für die Entwicklung neuer Medikamente.[5]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c d Eintrag zu Atromentin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 3. September 2019.
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ W. Thörner: Ueber einen in einer Agaricus-Art vorkommenden chinonartigen Körper. In: Berichte der deutschen chemischen Gesellschaft. Band 11, Nr. 1, Januar 1878, S. 533–535, doi:10.1002/cber.187801101143.
- ↑ Eintrag zu Leucomentine. In: Römpp Online. Georg Thieme Verlag, abgerufen am 4. September 2019.
- ↑ Hartmut Foerster: Atromentin biosynthesis. MetaCyc, 2014, abgerufen am 4. September 2019 (englisch).