Benutzer:Codc/Alkenmetathese
| Dieser Text ist eine vorübergehende Arbeitskopie des Artikels Alkenmetathese und ist nicht Bestandteil des enzyklopädischen Bereichs der Wikipedia.
Der Text wurde am 14. April 2018 kopiert. Die Autoren des unter der Creative-Commons-Lizenz Namensnennung – Weitergabe unter gleichen Bedingungen 4.0 stehenden Originaltextes sind in der Versionsgeschichte einsehbar. |
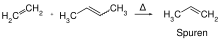
Die Alkenmetathese (auch Olefinmetathese; (gr. μετάθεσις metáthesis „Umstellung“) ist eine chemische Reaktion, bei der formal die Alkylidengruppen zwischen Alkenen ausgetauscht werden, wobei statistisch verteilte Produktgemische entstehen. Eine Alkenmetathese ist eine Gleichgewichtsreaktion deren Gleichgewicht jedoch nach den Regeln des Massenwirkungsgesetzes verschoben werden kann.
Die Alkenmetathese ist seit längerem eine wichtige Reaktion in der Polymer- und der Petrochemie. Mit der Entwicklung von leistungsfähigen Metathesekatalysatoren seit Mitte der 1990er Jahre hat sich die Metathesereaktion auch zu einer etablierten Reaktion in der organischen Synthese entwickelt. Ein allgemeines Schema der Reaktion ist:

Für ihre Verdienste auf dem Gebiet der Alkenmetathese, der mechanistischen Erklärung und Entwicklung der modernen Katalysatoren erhielten Yves Chauvin, Richard R. Schrock und Robert H. Grubbs im Jahr 2005 den Nobelpreis für Chemie.
Geschichte[Bearbeiten | Quelltext bearbeiten]
Erste Beobachtungen[Bearbeiten | Quelltext bearbeiten]
Bereits in den 1931 wurde eine Olefinmetathese-Reaktion zwischen Ethylen und 2-Buten mit Bildung einer kleinen Menge Propen durch Schneider und Fröhlich beobachtet. Die Reaktion fand jedoch ohne Katalysator und bei sehr hohen Temperaturen (852 °C) statt.[1]

Im Jahr 1956 machte Herbert Eleutrio von DuPont die Beobachtung, dass bei der Polymerisation von Cyclopenten mit einem Katalysator auf Wolfram- oder Molybdänbasis entgegen der Erwartung, nicht zur Spaltung der Doppelbindung unter Bildung eines gesättigten Polymers sondern zur Öffnung des Rings und zu einem ungesättigten Polymer führte.[2] Dies ist das erste beobachtete Beispiel einer Ring-öffnende-Polymerisatationsmetathese.

Robert L. Banks und Grant C. Bailey von der Phillips Petroleum Company entdeckten 1964, dass Propen an heterogenen Wolfram- und Molybdän-Kontakten zu Ethen und Buten umgesetzt wird und nannten die Reaktion Olefin-Disproportionierung.[3] Drei Jahre später wurde dann ein homogenes Katalysatorsystem bestehend aus Wolframhexachlorid und Ethyl-Dimethyl-aluminium in Ethanol/Benzol von der Goodyear Tire & Rubber Company entwickelt und das Verfahren als Olefinmetathese bezeichnet.[4] Seit Anfang der 1970er Jahre hielt die Alkenmetathese als Forschungsgebiet über industrielle Prozesse hinaus Einzug in die akademische organisch-chemische Forschung.[5] Es wurden neue Katalysatorsysteme entwickelt.[6][7][8] Jedoch wurden nur von wenigen erfolgreichen Olefinmetathesen an funktionalisierten Substraten bis in die 1980er Jahre berichtet.[9][10] Da die Katalysatoren immer noch auf der Kombination von stark Lewis-sauren Übergangsmetallhalogeniden und metallorganischen Verbindungen beruhten, war die Toleranz gegenüber funktioneller Gruppen umgekehrt sehr gering.
Die zunächst am häufigsten benutzten Katalysatorsysteme sind im Folgenden aufgeführt.
| Homogene Systeme | Heterogene Systeme |
|---|---|
| WCl6–C2H5AlCl2/C2H5OH[11] | MoO3–CoO–Al2O3[12] |
| WCl6–SnR4[5]/ROR[13] | Re2O7–Al2O3[14] |
| MoCl2(NO)2[P(C6H5)3]2–(CH3)3Al2Cl3[15] |
Tebbe-Reagenz[Bearbeiten | Quelltext bearbeiten]

Mechanistische Studien haben angedeutet, dass während der Metathesereaktion ein Metall-Alkyliden und eine Metallacyclus als aktive Spezies auftreten sollte. Die Synthese von definierten Metathese-aktiven Verbindungen sollten diese These bestätigen. Erste Studien mit Fischer-Carben-Komplexen zeigten, dass sie eine Metatheseaktivität besitzen aber es konnte keine definierte Struktur dazu ermittelt werden.[16]
Im Jahr 1978 stellte Frederick Nye Tebbe von DuPont die Eigenschaften eines Reagenz – bereits vorher von Kimm und Kiminsky synthetisiert – vor. Dieses, auch in der Tebbe-Methylenierung eingesetzte Reagenz weist auch Olefinmetathese-Eigenschaften auf. [17]

Durch die Umsetzung von Deuterium-markiertes Methylencyclohexan mit dem Tebbe-Reagenz wurde als Metatheseprodukt ein D2-markiertes Metathatese-Reagenz erhalten was auch charakterisiert werden konnte. In weiteren Experimenten konnte für die Reaktion des Tebbe-Komplexes mit einem Olefin in Anwesenheit von DMAP ein Metallocyclobutan charakterisiert werden.[18]

Auch konnte an diesem Beispiel gezeigt werden, dass bei der Verwendung von Deuterium-markierten Verbindung eine Metathesereaktion stattfindet. Trotzdem erwies sich das Titan-Reagenz als recht wenig aktiver Metathesekatalysator ist aber genau aus diesem Grund ein ideales Modell für frühe Metathesestudien.[17]
Entwicklung moderner Katalysatoren auf Wolfram- und Molybdänbasis[Bearbeiten | Quelltext bearbeiten]
Richard R. Schrock gilt als Entdecker und ist Namensgeber der Schrock-Carbenkomplexe. Diese sind neben den Fischer-Carbenkomplexen (Namensgeber und Entdecker Ernst Otto Fischer; dafür mit dem Nobelpreis für Chemie 1973 ausgezeichnet) die beide Verbindungstypen die eine Metall-Kohlenstoff-Doppelbindung als Strukturmerkmal enthalten.[Anmerkung 1] Obwohl beide Carbenkomplex-Typen ein identisches Strukturmerkmal besitzen verhalten sie sich, bedingt durch ihre elektronische Struktur chemisch völlig unterschiedlich.[Anmerkung 2]
Im Jahre 1990 publizierte Schrock einen definierten und in der Alkenmetathese hochreaktiven Katalysator auf der Basis von Molybdän (VI) und Wolfram (VI). Dieser ist sehr empfindlich gegenüber Sauerstoff und Wasser und toleriert nur wenige ungeschützte funktionelle Gruppen, was seine Anwendung als Synthesereagenz deutlich einschränkt.[19][20][21][22]

Das Zentralatom trägt hier eine hohe Oxidationsstufe (+VI; d0-Konfiguration) was die elektronenarme Verbindungen empfindlich gegenüber Wasser, Sauerstoff und vielen funktionellen Gruppen macht. Die vier Liganden, die sich in einer pseudotetraedrischen Geometrie befinden schützen das Zentralatom durch seine hohen sterischen Ansprüche vor einer intermolekularen Zersetzung. Der Imidoligand und die Alkoxyliganden stabilisieren die hohe Oxidationsstufe.[23] Da kein Wasserstoffatom in der β-Position des Carbenliganden vorhanden ist kann der Komplex nicht in einer β-Hydrideliminierung zerfallen. Der aktivste Katalysator, der zwei (F3C)2CH3CO-Liganden trägt, ist seit 1990 kommerziell erhältlich.
Erste Katalysatoren auf Rutheniumbasis[Bearbeiten | Quelltext bearbeiten]

Zwei Jahre später publizierte Robert Grubbs ebenfalls einen definierten Katalysator auf der Basis von Ruthenium. Dieser Katalysator und seine späteren Weiterentwicklungen erwiesen sich ebenfalls als hochreaktiv in der Metathesereaktion, sind allerdings gegenüber Sauerstoff, Wasser und funktionellen Gruppen sehr viel toleranter. Diese Katalysatoren werden auch als Grubbs Katalysatoren der 0. Generation bezeichnet.[24]
Neben den Erfolgen in der Forschung suchte die Industrie nach weiteren Anwendungen für die Olefinmetathese. Ende der 1980 wurden Erfolge erzielt mit der Synthese neuer Polymere mit Hilfe der ADMET (Acyclic Dien Metathesis).[25]
Rutheniumkatalysatoren der nächsten Generation[Bearbeiten | Quelltext bearbeiten]

Grubbs erkannte, dass die am Metallzentrum koordinierten Liganden die Reaktivität des Katalysators stark beeinflussten; je basischer und sterisch anspruchsvoller desto höher ist seine Reaktivität. Diese Erkenntnis führte dann zu einer Weiterentwicklung des ursprünglichen Katalysator indem der die Triphenylphoshin-Liganden durch Tricyclohexylphosphin-Liganden ersetzt wurden da dieser über stärkere σ-Donoreigenschaften verfügt. Der so erhaltene Katalysator vereinigt die hohe Toleranz gegenüber funktionellen Gruppen und der Metatheseaktivität des ursprünglichen Katalysator mit einer breiteren Anwendbarkeit.[26] Da die Katalysatoren von Grubbs gegenüber den Molybdän- und Wolfram-Katalysatoren von Schrock bezüglich der Toleranz gegen Luftsauerstoff und Feuchtigkeit weit überlegen sind erfolgte eine stetige Weiterentwicklung dieser Katalysatoren. Die hohe Toleranz wurde jedoch zunächst mit einer geringeren Aktivität erkauft. Der weiter entwickelte Katalysator mit vereinfachten organischen Rest wurde als Grubbs Katalysator der 1. Generation bezeichnet.[27]
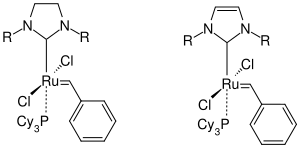
In den Jahren darauf wurde der Katalysator weiter entwickelt. Dabei erfolgte ein Austausch einer der beiden labilen Triphenylcyclohexyl-Liganden durch ein sterisch anspruchsvollen N-heterocyclischen Carbenliganden (NHC).[28] Durch kinetische Studien wurde festgestellt, dass die Aktivität und Stabilität der reaktiven Zwischenstufe (14-Elektronenspezies) stark von der elektronischen und sterischen Umgebung eines Liganden am metallischen Zentralatom abhängt.[29] Für den Phosphin-Ligand wurde festgestellt, dass er umso aktiver ist je größer und basischer er ist (PPh3 << PiPR3 < PCy3). Das Gegenteil gilt für den Halogenliganden. Je elektronegativer und kleiner das Halogen ist, desto reaktiver (I < Br < Cl). Für den NHC-Liganden gilt, dass er durch seinen erhöhten σ-Donorcharakter eine deutlich stärkere Bindung zum Metallzentrum eingehen kann als der Phosphin-Ligand.[30] Die erhöhte Elektronendichte am Metallzentrum führt dazu, dass der schwächer koordinierte Phosphinligand leichter dissozieren kann und sich dadurch leichter eine 14-Elektronenspezies ausbilden kann.[31] Durch den NHC-Liganden wird die Bindung des Olefins an das Metallatom erhöht und die Rekoordination der Phosphin-Ligand zurück gedrängt.[32][33]
Alle vorgestellte Katalysatoren auf Rutheniumbasis sind streng genommen nur Präkatalysatoren da vor einer Metathesereaktion ein Ligand zur Initiierung der Olefinmetathese dissoziieren muss. Dadurch wird eine aktive Spezies mit 14 Valenzelektronen erhalten. Das Olefin belegt in dem initalen Schritt dann die Koordinationstelle des abdissozierten Liganden. Die Molybdän- und Wolframkatalysatoren von Schrock benötigen hingegen keine Ligandendissoziation.[34]
Hoveyda-Grubbs-Komplex[Bearbeiten | Quelltext bearbeiten]
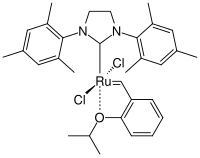
Bei der Synthese von Chromen durch eine Ringschlußmetathese (RCM) entdeckte Amir H. Hoveyda zufällig einen, durch einen Isopropylphenylether stabilisierten Komplex. Dabei ist ein Tricyclohexylphosphin-Ligand durch einen ortho-Isopropoxy-Liganden ersetzt. Dieser Komplex erwies sich als außerordentlich beständig gegen Luft und Feuchtigkeit und lies sich sogar über eine Säulenchromatographie reinigen. Darüber hinaus war der Komplex als Metathese-Katalysator aktiv.[35][36] Aufgrund dieses Ergebnisses arbeiteten Hoveyda[37] und Blechert[38] an neuen Katalysatoren und ersetzten den verbleibenden Phosphin-Liganden durch einen sterisch anspruchsvollen NHC-Liganden. So wurde ein phosphinfreier Komplex erhalten der als Hoveyda-Grubbs-Komplex bezeichnet wird und die 2. Generation der Katalysatoren darstellt.[39][40][41][42]
Der Hoveyda-Grubbskomplex mit seinem Prächelatliganden 2-Isopropoxystyrol ist deutlich stabiler als die Katalysatoren von Grubbs der zweiten Generation haben aber eine etwas geringere Metatheseaktivität. Durch weitere Überlegungen wurde erkannt, dass zur Verbesserung des Komplexes die Ruthenium-Sauerstoff-Bindung geschwächt werden muss. Dies wurde durch Arbeiten von Blechert und Grela auf unterschiedliche Art (sowohl sterisch als auch elektronisch) erricht. Blechert führte in die ortho-Position eine Phenylgruppe zur sterischen Destabilisierung ein[43] und Grela ein die para-Position eine Nitrogruppe[44] zur elektronischen Destabilisierung ein.

Viele der literaturbekannte Metathesekatalysatoren sind heute im Feinchemikalienhandel kommerziell erhältlich.[45]
Reaktionsmechanismus[Bearbeiten | Quelltext bearbeiten]
In den 1970er Jahren gab es verschiedene Vorschläge zum Mechanismus der Alkenmetathese.[46] Da die damaligen Katalysatoren denen der Ziegler-Natta-Polymerisation glichen ging man zunächst von einer Variation dieser Reaktion aus. Aus den Ergebnissen der Reaktion mit cyclischen Olefinen wurde jedoch diese These verworfen und man erkannte, dass es sich hierbei um einen anderen Reaktionstyp handelt. Nennenswerte Vorschläge für den Reaktionsmechanismus aus dieser Zeit stammen von P. Casey,[47] Y. Chauvin, [48] B.A. Dolgoplosk, [49] R.H. Grubbs, [50] und T. Katz[51].

Die meisten Vorschläge für den Reaktionsmechanismus ging bei dem Umalkylierungsschritt zunächst von einer paarweisen Anordnung der Olefine aus. Es wurde die Bildung einer Bisolefin-Metall-Spezies diskutiert und der Übergangszustand durch Bildung von Quasicyclobutan, Metallocyclopentan oder als Tetramethylen-Metall-Komplex beschrieben.[46]

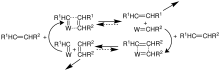
Chauvin hatte als Grundlage für die Entwicklung des Mechanismus der Olefinmetathese drei Erkenntnisse. Zum Einen war es die Entdeckung des Wolfram-Carbenkomplexes [W(CO)5{C(CH3)(OCH3)}] durch Ernst Otto Fischer[53], die Erkenntnis von Giulio Natta über die Polymerisation von Cyclopenten durch Ringöffnung durch die Katalyse mit einer Mischung aus Wolframhexachlorid und Triethylaluminium[54] und die von Banks und Bailey über die Bildung von Ethylen und 2-Buten aus Propen durch Katalyse mit Wolframhexacarbonyl auf Aluminium.[3] Aus diesen Erkenntnissen leitete Chauvin und sein Mitarbeiter Hérisson einen Carben/Metallacyclobutan-Mechanismus ab der alle experimentellen Ergebnisse korrekt wiedergibt.[48] Allerdings waren zu dieser Zeit noch keine Carbenkomplexe bekannt, die effizient mit gewöhnlichen Olefinen reagieren vermögen. Dieser Mechanismus wird sein den 1980er Jahren als weitgehend korrekt akzeptiert.[46]
Chauvin ging von einem Fischer-Carben-Komplex als aktive Katalysatorspezies aus. Dieser reagiert in einer Gleichgewichsreaktion mit einem Olefin zu einem Metallacyclobutan-Komplex. Durch Zerfall dieses Komplexes unter Abspaltung eines neuen Olefins und eines Fischer-Carben-Komplex (Regenerierung des Katalysators) – ebenfalls in einer Gleichgewichtsreaktion – wird die Reaktion komplettiert.[46] Die Reaktion und die Zusammensetzung des entstehenden Produktgemisches kann durch die Wahl der Reaktionsbedingungen, etwa der Zugabe von Ethylen im Überschuss oder durch Entfernen einer Reaktionskomponente aus dem Produktgemisch, in eine bestimmte Richtung gelenkt werden.

Physiko-chemische Grundlage der Alkenmetathese[Bearbeiten | Quelltext bearbeiten]
Die Olefinmetathese-Reaktion ist eine Gleichgewichtsreaktion für die gilt:
und damit gilt nach dem Massenwirkungsgesetz:
- .
Die Gleichgewichtskonstante hat einen endlichen Wert und bestimmt die Lage des Gleichgewichts. Ein Metathesekatalysator hat keinen Einfluss auf die Lage des Gleichgewichts sondern beeinflusst nur die Aktivierungsenergie und die Kinetik der Reaktion d.h. er ermöglicht erst die Reaktion indem er die Aktivierungsenergie senkt. Für die Gleichgewichtslage der Reaktion sind die thermodynamischen Daten der Edukt- und der Produktseite verantwortlich.
Bei vielen Olefinmetathese-Reaktionen entsteht neben dem gewünschten Syntheseprodukt ein leicht flüchtige Produkt. Da dieses leicht aus der Reaktionsmischung entfernt wird verschiebt sicht dann das Gleichgewicht auf die Seite des Metatheseproduktes.
Anwendung[Bearbeiten | Quelltext bearbeiten]
Die Olefinmetathese hatte zunächst nur Bedeutung in der Polymer- und Petrochemie da die Katalysatoren zunächst sehr empfindlich auf die Funktionellen Gruppen in den Substraten reagierten. Erst mit der Entwicklung der modernen Katalysatoren durch R. Schrock und R. Grubbs nahm die Bedeutung der Metathese in der organischen Chemie rapide zu. Die für die organische Chemie wichtigste Anwendung der Olefinmetathese ist die Knüpfung von Kohlenstoff-Kohlenstoff-Doppelbindungen durch die Ringschlussmetathese. Hierbei sind retrosynthetische Schnitte möglich die vorher undenkbar waren. Dies führte schnell zu einer hohen Bedeutung in der Synthese von Naturstoffen und deren Analoga.[55]
Man unterscheidet je nach Ausgangsverbindung und Reaktionsprodukt fünf verschiedene Varianten an Olefinmetathese-Reaktionen. Im Allgemeinen werden diese auch durch Abkürzungen der englischsprachigen Bezeichnungen benannt.[56]
| Formelschema | Bezeichnung | Englische Bezeichnung | Abkürzung |
|---|---|---|---|
| Ringschluss-Metathese | Ring Closure Metathesis | RCM | |
| Ringöffnende Metathese | Ring Opening Metathesis | ROM | |
| Ringöffnende Metathese Polymeristation | Ring Opening Metathesis Polymerisation | ROMP | |
| Acyclische Dienmetathese-Polymerisation | Acyclische Dien Metathesis Polymerisation | ADMET | |
| Kreuzmetathese | Cross Metathesis | CM |
Ringschlußmetathese-Reaktion (RCM)[Bearbeiten | Quelltext bearbeiten]
Bei der Ringschlußmetathese reagieret ein Diolefin mit meist endständigen Doppelbindung unter Ringschluß zu einem ungesättigten Cyclus. Bei dieser Reaktion wird ein Molekül eines, in der Regel kurzkettigen Olefin (meist Ethylen) frei. Die Reaktion ist entropisch begünstigt, da sich aus einem Eduktmolekül zwei Produktmoleküle bilden.[57] Sie wird aufgrund der Flüchtigkeit des entstehenden kurzkettigen Olefins auf die Produktseite verschoben.[58] Aufgrund der geringen Ringspannung ist die RCM bei fünf- bis siebengliedrige Ringe am besten geeignet.[59]
Ringöffnungsmetathese-Reaktion (ROM)[Bearbeiten | Quelltext bearbeiten]
Die Ringöffnungsmetathese ist die formale Umkehrung der Ringschlußmetathese. Da die RCM entropisch bevorzugt ist wird es schwierig große Ausbeuten des gewünschten Kreuzproduktes zu erhalten.[57] Ihre Triebkraft gewinnt die ROM normalerweise aus dem Verlust einer Ringspannung (Reaktionsenthalphie).[56]
Ringöffnungsmetathese-Polymerisation (ROMP)[Bearbeiten | Quelltext bearbeiten]
Die Ringöffnungsmetathese-Polymerisation ist verwandt mit der Ringöffnungsmetathese-Reaktion mit dem Unterschied, dass hier ein Polymer erhalten wird und keine diskreten Einzelverbindungen. Die Triebkraft ist auch hier, wie bei der ROM, der Verlust von Ringspannung. Diese thermodynamische Barriere macht die ROMP zu einem irrevesiblen Prozess.[57] Daher kann z.B. das stabile Cyclohexen nicht erfolgreich einer ROMP unterworfen werden. Im Idealfall handelt es sich hierbei um eine Lebende Polymerisation die keine Abbruchreaktion kennt und sich das reaktive Metallzentrum immer am wachsenden Ende der Kette befindet. Die Produktverteilung wäre dann rein kinetisch kontrolliert.
Kreuzmetathese (CM)[Bearbeiten | Quelltext bearbeiten]
Die Kreuzmetathese ist idealerweise die Metathese zweier verschiedener Olefine zu zwei entsprechenden Metatheseprodukten. In der Praxis erhält man jedoch oft ein statistisches Gemisch aus allen möglichen Produkten (gewünschtes Produkt aber auch die Homodimeren in den jeweiligen E/Z-Verhältnissen). Sind die Edukte elektronisch und sterisch sehr verschieden so erhält man, aufgrund des reversiblen Charakters der Metathese-Reaktion oft eine thermodynamische Produktverteilung.[60][61]
Acyclische Dien Metathese (ADMET)[Bearbeiten | Quelltext bearbeiten]
Bei der Acyclischen Dien Metathese handelt es sich um eine Kreuzmetathese von α-ω-Dienen die zu einem lineare Polymere mit einem ungesättigten Polymerrückgrad führt.[62] Der Begriff wurde von Wagner eingeführt dem es als erstes gelang 1,9-Decadien mit Hilfe eines Schrock-Katalysators zu polymerisieren.[25] Es handelt sich hierbei um eine Stufenwachstumspolymerisation und da es sich wie bei allen Metathese-Reaktionen um eine Gleichgewichtsreaktion handelt muss hier das entstehende leichtflüchtige Olefin aus dem Reaktionsgemisch entfernt werden um einen hohen Polymersationsgrad zu erhalten. Um die intramolekulare Metathese, die zu Cyclen führt zu verringern und um das Polymerisationsgleichgewicht weiter auf die Produktseite zu verschieben muss die Eduktkonzentration hoch gehalten werden. Da der Katalysator nach dem initialen Bildung des Metalla-Cyclobutan (vergl. Mechanismus der Olefinmetathese) im Wachstumsende der Polymerkette befindet, so kann man auch über die Katalysatorkonzentration die Kettenlänge bestimmen.[63][64]
Asymetrische Metathese[Bearbeiten | Quelltext bearbeiten]
Der erste asymetrische Mo-basiserender Metathese-Katalysator wurde bereits 1993 von Schrock vorgestellt.[65] Seitdem gab es viele Ansätze für chirale Metathese-Katalysatoren die sowohl auf Molybdän als auch Ruthenium basieren. Aufgrund der höheren Metatheseaktivität war jedoch Molybdän der erfolgsversprechendere Ansatz. Die Katalysatoren wurden erfolgreich in verschiedenen asymmetrischen Metathesereaktion eingesetzt. Ein Beispiel aus der Naturstoffsynthese ist die des (+)-Quebrachamins.[66] Da die Molyndän-basierenden Katalysatoren wenig tolerant gegenüber funktionellen Gruppen, gegenüber Luftfeuchtigkeit und Luftsauerstoff sind war das Interesse groß tolerante Katalysatoren auf Ruthenium-Basis zu entwickeln. Grubbs hat im Jahr 2001 einen solchen Katalysatorkomplex vorgestellt der einen C2-symetrischen NHC-Liganden trägt.[67] Dieser Komplex wurde weiterentwickelt[68] aber auch der als nächstes vorgestellte Katalysator hatte mäßige Ausbeuten und moderate Selektivitäten.[69]
Anwendung in der Synthese[Bearbeiten | Quelltext bearbeiten]
Seit der Etablierung der Olefinmetathese in der organischen Synthese um die 2000er Jahre wurden sehr viele Syntheserouten publiziert die eine Olefinmetathese als zentralen Synthesebestandteil enthalten, so dass es schwierig ist hier eine Auswahl zu treffen. Die größte Bedeutung ist hier der Ringschlussmetathese (RCM) beizumessen da die Olefinmetathese hier neuartige retrosynthetische Schritte zulässt. Retrosynthetisch ist sie in Konkurrenz zur McMurry-Reaktion und Wittig-Reaktion getreten. Aber auch andere Methoden zur Synthese von C–C-Bindungen wie intramolekulare Nucleophile Substitution oder Aldolreaktionen können so ersetzt werden. Durch die Verwendung von Diolefinen als Substrat der RCM hat vermeidet man die Verwendung eines hochreaktiven Substrates wie beispielweise einer Dicarbonylverbindung (McMurry-Reaktion, Aldolreaktion).
Andere Varianten der Olefinmetathese wurden jedoch ebenfalls erfolgreich in Syntheseplanungen verwendet. So lassen sich besonders durch die Enin-Metathese Stukturmerkmale im Syntheseprodukt erhalten für die es sonst keinen direkten Zugang gibt.
Eine frühe Anwendung in der Wirkstoffentwicklung fand die RCM bei der Festphasensynthese von einer Substanzbibliothek um Strukturvarianten des Wirkstoffs Epothilon für die Struktur-Wirkungs-Beziehung durch Kyriacos Costa Nicolaou herzustellen.[70]

Industrielle Anwendungen[Bearbeiten | Quelltext bearbeiten]
In der Industrie findet die Alkenmetathese hauptsächlich Verwendung in der Petro- und Polymerchemie. Im Folgenden werden die wichtigsten benannten Verfahren aufgeführt.
Shell FEAST-Prozess[Bearbeiten | Quelltext bearbeiten]
Beim Shell FEAST-Prozess (further exploitation of advanced Shell technology) werden α,ω-Olefine durch eine Kreuzmetathese mit Ethylen erhalten. Mit hohen Ausbeuten werden Cycloocten, 1,5-Cyclooctadien und Cyclododecen zu den, als Vernetzern bei der Olefinpolymerisation bedeutenden, α,ω-Olefine 1,9-Decadien, 1,5-Hexadien und 1,13-Tetradecadien umgesetzt.[71]
Neohexen-Prozess[Bearbeiten | Quelltext bearbeiten]
Im Neohexen-Prozess wird technisches Di-iso-buten mit Ethylen in einer Kreuzmetathese zu Neohexen und iso-Buten umgesetzt welches eine Bedeutung bei der Herstellung von Duftstoffen hat.[72]
Metton-Prozess[Bearbeiten | Quelltext bearbeiten]
Unter dem Metton-Prozess versteht man die Ringöffnungspolymeristation von Dicyclopentadien. Durch die Reaktion von mehreren Molekülen Dicyclopentadien untereinander entsteht ein stark quervernetztes Polymer welche für versteifungsfeste Formkörper und Gehäuseteilen Verwendung findet.[73]
Norsorex-Prozess[Bearbeiten | Quelltext bearbeiten]
Als Norsorex-Prozess wird die Ringöffnungspolymerisationsmetathese von Norbornen bezeichnet. Dabei entsteht ein gummiartiges Polymer, welches für Schwinungs- und Geräuschdämpfungsmassen und zum Aufsaugen von ausgelaufenen Öl verwendet wird.[73]
Phillips-Triolefin-Prozess[Bearbeiten | Quelltext bearbeiten]
Der Phillips-Triolefin-Prozess war die technische Anwendung der Olefinmetathese. Ursprünglich wurden Propen einer Kreuzmetathese unterworfen und dabei Ethylen und 2-Buten erhalten. Ursprünglich diente das Verfahren um die Raffinierieflexibilität und en Ethylenanteil im Naphta-Crackgemisch zu auf Kosten von Propen zu erhöhen. Zwischen 1966 und 1972 wurde eine Anlage mit einer Kapazität von 30.000 Jahrestonnen betrieben die jedoch aufgrund von veränderten Rohstoffsituation still gelegt wurde. In den USA wird in neuerer Zeit ein umgekehrter Prozess zur Herstellung von Propen aus Ethylen betrieben. Die Anlage der Firma Arco verfügt über eine Kapazität von 136.000 Jahrestonnen.[74]
Shell-Higher-Olefin-Prozess[Bearbeiten | Quelltext bearbeiten]
Der Shell Higher Olefin Process (auch fälschlicherweise SHOP-Prozess) ist ein chemischer Prozess zur Produktion von linearen α-Olefinen durch Ethen-Oligomerisierung, Isomerisierung und Ethenolyse, der von der Royal Dutch Shell erfunden und eingeführt wurde. Es handelt sich um das erste Beispiel einer industriell genutzten Heterogenisierung eines homogenen Katalysators. Ziel dieses Prozesses ist es die Verhältnisse der Olefin bezüglich der Kettenlänge durch Kreuzmetathese zu modifizieren. Bei den im SHOP-Prozess entstehenden α-Olefinen handelt es sich um Gemische, die destillativ aufgetrennt werden. Die höhermolekulare Fraktion wird isomerisiert und die entstehenden internen Olefine werden mit Ethylen durch Metathese wieder in α-Olefine überführt.[75]
Vestenamer-Verfahren[Bearbeiten | Quelltext bearbeiten]
Beim Vestenamer-Verfahren wird Cycloocten mittels Metathese polymerisiert. Das Verfahren wird als Ring-öffnende-Metathese-Polymerisation (ROMP) bezeichnet. Das entstehende Polyoctenamer ist ein teilkristalliner Kautschuk, der als Verarbeitungshilfe und Weichmacher für andere Kautschuke eingesetzt wird.[73]
Weblinks[Bearbeiten | Quelltext bearbeiten]
Literatur[Bearbeiten | Quelltext bearbeiten]
- Verena Börsch, Siegfried Blechert: Nobelpreis fur Chemie: Die Metathese – Partnertausch in Molekülen. In: Chemie in unserer Zeit. Band 39, 2005, S. 379–380, doi:10.1002/ciuz.200590082.
- Karol Grela: Olefin Metathesis: Theory and Practice. 1. Auflage. John Wiley & Sons, Inc., Hoboken, New Jersey, ISBN 978-1-118-20794-9.
- Yves Chauvin: Olefinmetathese: die frühen Tage (Nobel‐Vortrag). In: Angewandte Chemie. Band 118, 2006, S. 3824–3831, doi:10.1002/ange.200601234.
- Richard R. Schrock: Metall‐Kohlenstoff‐Mehrfachbindungen in katalytischen Metathesereaktionen (Nobel‐Vortrag). In: Angewandte Chemie. Band 118, 2006, S. 3832–3844, doi:10.1002/ange.200600085.
- Robert H. Grubbs: Olefin‐Metathesis Catalysts for the Preparation of Molecules and Materials (Nobel Lecture 2005). In: Angewandte Chemie. Band 119, 2007, S. 34–40, doi:10.1002/adsc.200600523.
- Alois Fürstner: Olefin Metathesis and Beyond. In: Angewandte Chemie Internationale Edition. Band 39, 2000, S. 3012–3043, doi:10.1002/1521-3773(20000901)39:17<3012::AID-ANIE3012>3.0.CO;2-G.
- Robert H. Grubbs, Sukbok Chang: Recent advances in olefin metathesis and its application in organic synthesis. In: Tetrahedron. Band 54, 1998, S. 4413–4450, doi:10.1016/S0040-4020(97)10427-6.
- Alois Fürstner: Topics in Organometallic Chemistry. 1. Auflage. Springer-Verlag, Berlin Heidelberg 1998, ISBN 978-3-540-64254-1.
- Matthias Schuster, Siegfried Blechert: Olefin Metathesis in Organic Chemistry. In: Angewandte Chemie Internationale Edition. Band 36, 1997, S. 2036–2056, doi:10.1002/anie.199720361.
- Georgios C. Vougioukalakis, Robert H. Grubbs: Ruthenium-Based Heterocyclic Carbene-Coordinated Olefin Metathesis Catalysts. In: Chemical Reviews. Band 110, 2010, S. 1746–1787, doi:10.1021/cr9002424.
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ V. Schneider, Per K. Fröhlich: Mechanism of Formation of Aromatics from Lower Paraffins. In: Industrial & Engineering Chemistry. Band 23, Nr. 12, 1931, S. 1405–1410, doi:10.1021/ie50264a023.
- ↑ Jacques C. Vedrine: Metal Oxides in Heterogeneous Catalysis. Elsevier, 2018, ISBN 978-0-12-811631-9 (eingeschränkte Vorschau in der Google-Buchsuche ).
- ↑ a b Robert L. Banks, Grant C. Bailey: Olefin Disproportionation. A New Catalytic Process. In: Industrial & Engineering Chemistry Product Research and Development. Band 3, Nr. 3, 1964, S. 170–173, doi:10.1021/i360011a002.
- ↑ Nissim Calderon, Hung Yu Chen, Kenneth W.Scott: Olefin metathesis – A novel reaction for skeletal transformations of unsaturated hydrocarbons. In: Tetrahedron Letters. Band 8, Nr. 34, 1967, S. 3327–3329, doi:10.1016/S0040-4039(01)89881-6.
- ↑ a b P. B. van Dam, M. C. Mittelmeijer and C. Boelhouwer: Metathesis of unsaturated fatty acid esters by a homogeneous tungsten hexachloride–tetramethyltin catalyst. In: Journal of the Chemical Society, Chemical Communications. Band 22, 1972, S. 1221–1222, doi:10.1039/C39720001220.
- ↑ E. Verkuijen, C. Boelhouver: Formation of cyclohexa-1,4-diene by metathesis of linoleic and linolenic esters. In: Chem. Commun. 1974, S. 793–794, doi:10.1039/C39740000793.
- ↑ R. Nakamura, S. Fukahara, S. Matsumoto, K. Komatsu: Disproportionation of the unsaturated esters. In: Chem. Let. 1976, S. 253–256, doi:10.1246/cl.1976.253.
- ↑ H. G. Alt, F. P. D. Sanzo, M. D. Rausch, P. C. Uden: Automated thermal degradation studies on solid σ-organotransition metal complexes: Dimethyl-titanocene, -zirconocene and -hafnocene. In: Organomet. Chem. 107, 1976, S. 257.
- ↑ D. Villemin: Synthese de macrolides par methathese. In: Tetrahedron Letters. 21, 1980, S. 1715–1718, doi:10.1016/S0040-4039(00)77818-X.
- ↑ J. Tsuji, S. Hashiguchi: Application of olefin metathesis to organic synthesis. Syntheses of civetone and macrolides. In: Tetrahedron Letters. 21, 1980, S. 2955–2958, doi:10.1016/0040-4039(80)88007-5.
- ↑ Nissim Calderon, Eilert A. Ofstead, John P. Ward, W. Allen Judy, Kenneth W. Scott: Olefin metathesis. I. Acyclic vinylenic hydrocarbons. In: Journal of the American Chemical Society. Band 90, Nr. 15, 1968, S. 4133–4140, doi:10.1021/ja01017a039.
- ↑ R. L. Banks, G. C. Bailey: Olefin Disproportionation. A New Catalytic Process. In: Industrial & Engineering Chemistry Product Research and Development. Band 3, Nr. 3, 1964, S. 170–173, doi:10.1021/i360011a002.
- ↑ Gottfried Pampus, Guenther Lehnert: cis‐trans‐Umlagerung bei Polypentenamer. In: Macromolekular Chemistry and Physics. Band 175, 1974, S. 2605–2616, doi:10.1002/macp.1974.021750908.
- ↑ Patent GB1106015: Improvements in or relating to catalysts suitable for the disproportionation of olefins. Veröffentlicht am 13. März 1968, Erfinder: Eric James Howman, Leonard Turner, Keith Vaughan Williams.
- ↑ Ernest A. Zuech, William B. Hughes, D. H. Kubicek, E. T. Kittleman: Homogeneous catalysts for olefin disproportionations from nitrosyl molybdenum and tungsten compounds. In: Journal of the American Chemical Society. Band 92, Nr. 3, 1. Februar 1970, S. 528–531, doi:10.1021/ja00706a018.
- ↑ Robert H. Grubbs: Handbook of Metathesis, Volume 2 – Applications in Organic Synthesis. Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim 2003, ISBN 3-527-30616-1, S. 4–7.
- ↑ a b Frederick Nye Tebbe, G.W. Parshall, D.W. Ovenall: Titanium-catalysed Olefin Metathesis. In: Journal of the American Chemical Socitety. Band 101, 1979, S. 5074–5075, doi:10.1021/ja00511a053.
- ↑ T.R. Howard, J.B. Lee, Robert H. Grubbs: Titanium metallacarbene-metallacyclobutane reactions: stepwise metath. In: Journal of the American Chemical Socitety. Band 102, Nr. 22, 1980, S. 6876–6878, doi:10.1021/ja00542a050.
- ↑ Richard R. Schrock: Living ring-opening metathesis polymerization catalyzed by well-characterized transition-metal alkylidene complexes. In: Accounts of Chemical Research. Band 23, 1990, S. 158–165, doi:10.1021/ar00173a007.
- ↑ Richard R. Schrock, J. S. Murdzek, G. C. Bazan, J. Robbins, M. Di Mare, M. O´Regan: Synthesis of molybdenum imido alkylidene complexes and some reactions involving acyclic olefins. In: Journal of the American Chemical Society. Band 112, 1990, S. 3875–3886, doi:10.1021/ja00166a023.
- ↑ Richard R. Schrock, G. C. Bazan, E. Khosravi, W. J. Feast: Living ring-opening metathesis polymerization of 2,3-difunctionalized norbornadienes by Mo(:CHBu-tert)(:NC6H3Pr-iso2-2,6)(OBu-tert)2. In: Journal of the American Chemical Society. Band 112, 1990, S. 8378–8387, doi:10.1021/ja00179a023.
- ↑ Richard R. Schrock, G. C. Bazan, J. H. Oskam: Living ring-opening metathesis polymerization of 2,3-difunctionalized 7-oxanorbornenes and 7-oxanorbornadienes by Mo(CHCMe2R)(NC6H3-iso-Pr2-2,6)(O-tert-Bu)2 and Mo(CHCMe2R)(NC6H3-iso-Pr2-2,6)(OCMe2CF3)2. In: Journal of the American Chemical Society. Band 113, 1991, S. 6899–6907, doi:10.1021/ja00018a028.
- ↑ Richard R. Schrock: Recent Advances in High Oxidation State Mo and W Imido Alkylidene Chemistry. In: Chemical Reviews. Band 109, 2009, S. 3213, doi:10.1021/cr800502p.
- ↑ SonBinh T. Nguyen, Lynda K. Johnson, Robert H. Grubbs, Joseph W. Ziller: Ring-opening metathesis polymerization (ROMP) of norbornene by a Group VIII carbene complex in protic media. In: Journal of the American Chemical Society. Band 114, 1992, S. 3974–3975, doi:10.1021/ja00036a053.
- ↑ a b Monica Lindmark-Hamberg, K. B. Wagener: Acyclic metathesis polymerization: the olefin metathesis reaction of 1,5-hexadiene and 1,9-decadiene. In: Macromolecules. Band 20, 1987, S. 2949–2951, doi:10.1021/ma00177a053.
- ↑ SonBinh T. Nguyen, Robert H. Grubbs, Joseph W. Ziller: Syntheses and activities of new single-component, ruthenium-based olefin metathesis catalysts. In: Journal of the American Chemical Society. Band 115, 1993, S. 9858–9859, doi:10.1021/ja00074a086.
- ↑ Peter Schwab, Robert H. Grubbs, and Joseph W. Ziller: Synthesis and Applications of RuCl2(CHR‘)(PR3)2: The Influence of the Alkylidene Moiety on Metathesis Activity. In: Journal of the American Chemical Society. Band 118, 1996, S. 100–110, doi:10.1021/ja952676d.
- ↑ Matthias Scholl, Tina M. Trnka, John P. Morgan, Robert H. Grubbs: Increased ring closing metathesis activity of ruthenium-based olefin metathesis catalysts coordinated with imidazolin-2-ylidene ligands. In: Tetrahedron Letters. Band 40, Nr. 12, 1999, S. 2247–2250, doi:10.1016/S0040-4039(99)00217-8.
- ↑ Melanie S. Sanford, Jennifer A. Love, Robert H. Grubbs: Mechanism and Activity of Ruthenium Olefin Metathesis Catalysts. In: Journal of the American Chemical Society. Band 123, 2001, S. 6543–6554, doi:10.1021/ja010624k.
- ↑ Wolfgang A. Herrmann: N‐Heterocyclische Carbene: ein neues Konzept in der metallorganischen Katalyse. In: Angewandte Chemie. Band 114, 2002, S. 1342–1363, doi:10.1002/1521-3757(20020415)114:8<1342::AID-ANGE1342>3.0.CO;2-A.
- ↑ Jinkun Huang, Hans-Jörg Schanz, Edwin D. Stevens, Steven P. Nolan: Influence of Sterically Demanding Carbene Ligation on Catalytic Behavior and Thermal Stability of Ruthenium Olefin Metathesis Catalysts. In: Organometallics. Band 18, 1999, S. 5375–5380, doi:10.1021/om990788y.
- ↑ Matthias Scholl, Sheng Ding, Choon Woo Lee, and Robert H. Grubbs: Synthesis and Activity of a New Generation of Ruthenium-Based Olefin Metathesis Catalysts Coordinated with 1,3-Dimesityl-4,5-dihydroimidazol-2-ylidene Ligands. In: Organic Letters. Band 1, 1999, S. 953–956, doi:10.1021/ol990909q.
- ↑ Thomas Weskamp, Florian J. Kohl, Wolfgang Hieringer, Dieter Gleich, Wolfgang A. Herrmann: Hochaktive Rutheniumkatalysatoren für die Olefinmetathese: die Synergie N‐heterocyclischer Carbene und koordinativ labiler Liganden. In: Angewandte Chemie. Band 111, 1999, S. 2573–2576, doi:10.1002/(SICI)1521-3757(19990816)111:16<2573::AID-ANGE2573>3.0.CO;2-A.
- ↑ Dirk Steinborn: Grundlagen der metallorganischen Komplexkatalyse. 2. Auflage. Viewag+Teubner, Wiesbaden 2010, ISBN 978-3-8348-0581-2, S. 114.
- ↑ Joseph P. A. Harrity†, Daniel S. La, Dustin R. Cefalo, Michael S. Visser, Amir H. Hoveyda: Chromenes through Metal-Catalyzed Reactions of Styrenyl Ethers. Mechanism and Utility in Synthesis. In: Journal of the American Chemical Society. Band 120, 1998, S. 2343–2351, doi:10.1021/ja9739796.
- ↑ Jason S. Kingsbury, Joseph P. A. Harrity, Peter J. Bonitatebus, Amir H. Hoveyda: A Recyclable Ru-Based Metathesis Catalyst. In: Journal of the American Chemical Society. Band 121, 1999, S. 791–799, doi:10.1021/ja983222u.
- ↑ Steven B. Garber, Jason S. Kingsbury, Brian L. Gray, Amir H. Hoveyda: Efficient and Recyclable Monomeric and Dendritic Ru-Based Metathesis Catalysts. In: Journal of the American Chemical Society. Band 122, 2000, S. 8168–8179, doi:10.1021/ja001179g.
- ↑ Simon Gessler,Stefan Randl, SiegfriedBlechert: Synthesis and metathesis reactions of a phosphine-free dihydroimidazole carbene ruthenium complex. In: Tetrahedron Letters. Band 41, 2000, S. 9973–9976, doi:10.1016/S0040-4039(00)01808-6.
- ↑ Hideaki Wakamatsu, Siegfried Blechert: A Highly Active and Air‐Stable Ruthenium Complex for Olefin Metathesis. In: Angewandte Chemie International Edition. Band 41, 2002, S. 794–796, doi:10.1002/1521-3773(20020301)41:5<794::AID-ANIE794>3.0.CO;2-B.
- ↑ Karol Grela, Syuzanna Harutyunyan, Anna Michrowska: A Highly Efficient Ruthenium Catalyst for Metathesis Reactions. In: Angewandte Chemie International Edition. Band 41, 2002, S. 4038–4040, doi:10.1002/1521-3773(20021104)41:21<4038::AID-ANIE4038>3.0.CO;2-0.
- ↑ Anna Michrowska, Robert Bujok, Syuzanna Harutyunyan, Volodymyr Sashuk, Grigory Dolgonos, Karol Grela: Nitro-Substituted Hoveyda−Grubbs Ruthenium Carbenes: Enhancement of Catalyst Activity through Electronic Activation. In: Journal of the American Chemical Society. Band 126, 2004, S. 9318–9325, doi:10.1021/ja048794v.
- ↑ Michał Bieniek, Robert Bujok, Maciej Cabaj, Noël Lugan, Guy Lavigne, Dieter Arlt, Karol Grela: Advanced Fine-Tuning of Grubbs/Hoveyda Olefin Metathesis Catalysts: A Further Step toward an Optimum Balance between Antinomic Properties. In: Journal of the American Chemical Society. Band 128, 2006, S. 13652–13653, doi:10.1021/ja063186w.
- ↑ Hideaki Wakamatsu, Siegfried Blechert: A New Highly Efficient Ruthenium Metathesis Catalyst. In: Angewandte Chemie International Edition. Band 41, 2002, S. 2403–2405, doi:10.1002/1521-3773(20020703)41:13<2403::AID-ANIE2403>3.0.CO;2-F.
- ↑ Karol Grela, Syuzanna Harutyunyan, Anna Michrowska: A Highly Efficient Ruthenium Catalyst for Metathesis Reactions. In: Angewandte Chemie International Edition. Band 41, 2002, S. 4038–4040, doi:10.1002/1521-3773(20021104)41:21<4038::AID-ANIE4038>3.0.CO;2-0.
- ↑ Zum Beispiel: Ruthenium Metathesis Catalysts Kit I 687944. Abgerufen am 21. September 2018.
- ↑ a b c d Emma Thorn‐Csányi: Mechanismus der Olefin–Metathese. In: Nachrichten aus der Chemie. Band 29, Nr. 10, Oktober 1981, S. 700–705, doi:10.1002/nadc.19810291007.
- ↑ Emma Charles, P. Casey, Terry J. Burkhardt: Reactions of (diphenylcarbene)pentacarbonyltungsten(0) with alkenes. Role of metal-carbene complexes in cyclopropanation and olefin metathesis reactions. In: Journal of American Chemical Society. Band 96, Nr. 25, Dezember 1974, S. 7808–7809, doi:10.1021/ja00832a032.
- ↑ a b c Par Jean‐Louis Hérisson, Yves Chauvin: Catalyse de transformation des oléfines par les complexes du tungstène. II. Télomérisation des oléfines cycliques en présence d'oléfines acycliques. In: Macromolecular Chemistry and Physics. Band 141, Februar 1971, S. 161–176, doi:10.1002/macp.1971.021410112.
- ↑ B.A. Dolgoplosk, K.L.Makovetsky, T.G.Golenko, Yu.V.Korshak, E.I.Tinyakova: On the mechanism of ring-opening polymerization of cyclo-olefins. In: European Polymer Journal. Band 10, Nr. 10, Oktober 1974, S. 901–904, doi:10.1016/0014-3057(74)90025-1.
- ↑ Robert H. Grubbs, D. D. Carr, C. Hoppin, and P. L. Burk: Consideration of the mechanism of the metal catalyzed olefin metathesis reaction. In: Journal of American Chemical Society. Band 98, Nr. 12, Juni 1976, S. 3478–3483, doi:10.1021/ja00428a015.
- ↑ Thomas J.Katz: The Olefin Metathesis Reaction. In: Advances in Organometallic Chemistry. Band 16, 1977, S. 283–317, doi:10.1016/S0065-3055(08)60564-X.
- ↑ Karol Grela: Olefin Metathesis: Theory and Practice. 1. Auflage. John Wiley & Sons, Inc., Hoboken, New Jersey, ISBN 978-1-118-20794-9, S. 7.
- ↑ Ernst Otto Fischer, A. Maasböl: On the Existence of a Tungsten Carbonyl Carbene Complex. In: Angewandte Chemie Internationale Edition. Band 3, 1964, S. 580–581, doi:10.1002/anie.196405801.
- ↑ Giulio Natta, G. Dall'Asta, G. Mazzanti: Stereospecific Homopolymerization of Cyclopentene. In: Angewandte Chemie Internationale Edition. Band 3, 1964, S. 723–729, doi:10.1002/anie.196407231.
- ↑ Überblick über die Anwendungen der Olefinmetathese in der Naturstoffsynthese: Janine Cossy, Stellios Arseniyadis, Christophe Meyer: Metathesis in Natural Product Synthesis: Strategies, Substrates and Catalysts. Wiley-VCH Verlag, Weinheim 2010, ISBN 978-3-527-32440-8.
- ↑ a b Matthias Schuster, Siegfried Blechert: Die Olefinmetathese in der organischen Synthese. In: Angewandte Chemie. Band 109, 1997, S. 2124–2144, doi:10.1002/ange.19971091904.
- ↑ a b c Georgios C. Vougioukalakis, Robert H. Grubbs: Ruthenium-Based Heterocyclic Carbene-Coordinated Olefin Metathesis Catalysts. In: Chemical Reviews. Band 110, 2010, S. 1747, doi:10.1021/cr9002424.
- ↑ Martin E. Maier: Synthese von mittleren Ringen durch Ringschluss‐Metathese‐Reaktion. In: Angewandte Chemie. Band 112, Nr. 12, 2000, S. 2153–2157, doi:10.1002/1521-3757(20000616)112:12<2153::AID-ANGE2153>3.0.CO;2-X.
- ↑ Georgios C. Vougioukalakis, Robert H. Grubbs: Ruthenium-Based Heterocyclic Carbene-Coordinated Olefin Metathesis Catalysts. In: Chemical Reviews. Band 110, 2010, S. 1756, doi:10.1021/cr9002424.
- ↑ Stephen J. Connon, Siegfried Blechert: Jüngste Entwicklungen bei der gekreuzten Olefinmetathese. In: Angewandte Chemie. Band 115, 2013, S. 1944–1868, doi:10.1002/ange.200200556.
- ↑ Arnab K. Chatterjee, Tae-Lim Choi, Daniel P. Sanders, Robert H. Grubbs: A General Model for Selectivity in Olefin Cross Metathesis. In: Journal of the American Chemical Society. Band 125, 2003, S. 11360–11370, doi:10.1021/ja0214882.
- ↑ Michael R. Buchmeiser: Homogeneous Metathesis Polymerization by Well-Defined Group VI and Group VIII Transition-Metal Alkylidenes: Fundamentals and Applications in the Preparation of Advanced Materials. In: Chemical Reviews. Band 100, 2000, S. 1565–1604, doi:10.1021/cr990248a.
- ↑ Zhe Wu, Alto D. Benedicto, Robert H. Grubbs: Living ring-opening metathesis polymerization of bicyclo[3.2.0]heptene catalyzed by a ruthenium alkylidene complex. In: Macromolecules. Band 26, 1993, S. 4975–4977, doi:10.1021/ma00070a039.
- ↑ Christopher W. Bielawski, Robert H. Grubbs: Highly Efficient Ring‐Opening Metathesis Polymerization (ROMP) Using New Ruthenium Catalysts Containing N‐Heterocyclic Carbene Ligands. In: Angewandte Chemie. Band 112, 2000, S. 3025–3028, doi:10.1002/1521-3757(20000818)112:16<3025::AID-ANGE3025>3.0.CO;2-F.
- ↑ Osamu Fujimura, Robert H. Grubbs: Asymmetric Ring-Closing Metathesis: Kinetic Resolution Catalyzed by a Chiral Molybdenum Alkylidene Complex. In: Journal of the American Chemical Society. Band 118, 1996, S. 2499–2500, doi:10.1021/ja9531384.
- ↑ Steven J. Malcolmson, Simon J. Meek, Elizabeth S. Sattely, Richard R. Schrock, Amir H. Hoveyda: Highly efficient molybdenum-based catalysts for enantioselective alkene metathesis. In: Nature. Band 456, 2008, S. 933–937.
- ↑ T. Jon Seiders, D. William Ward, and Robert H. Grubbs*: Enantioselective Ruthenium-Catalyzed Ring-Closing Metathesis. In: Organic Letters. Band 3, 2008, S. 3225–3228, doi:10.1021/ol0165692.
- ↑ T. Jon Seiders, D. William Ward, Robert H. Grubbs: Enantioselective Ruthenium-Catalyzed Ring-Closing Metathesis. In: Organic Letters. Band 3, 2008, S. 3225–3228, doi:10.1021/ol0165692.
- ↑ Jacob M. Berlin, Steven D. Goldberg, Robert H. Grubbs: Highly Active Chiral Ruthenium Catalysts for Asymmetric Cross‐ and Ring‐Opening Cross‐Metathesis. In: Angewandte Chemie. Band 118, 2006, S. 7753–7757, doi:10.1002/ange.200602469.
- ↑ Kyriacos Costa Nicolaou et al.: Designed Epothilones: Combinatorial Synthesis, Tubulin Assembly Properties, abd Cytotoxic Action against Taxol‐Resistant Tumor Cells. In: Angewandte Chemie Internationale Edition. Band 36, 1997, S. 2097–2103, doi:10.1002/anie.199720971.
- ↑ Christoph Janiak, Hans-Jürgen Meyer, Dietrich Gudat, Ralf Alsfasser: Riedel Moderne Anorganische Chemie. 4. Auflage. Walter de Guyter., Berlin/Boston, ISBN 978-3-11-024900-2, S. 823.
- ↑ Christoph Janiak, Hans-Jürgen Meyer, Dietrich Gudat, Ralf Alsfasser: Riedel Moderne Anorganische Chemie. 4. Auflage. Walter de Guyter., Berlin/Boston, ISBN 978-3-11-024900-2, S. 822.
- ↑ a b c Christoph Janiak, Hans-Jürgen Meyer, Dietrich Gudat, Ralf Alsfasser: Riedel Moderne Anorganische Chemie. 4. Auflage. Walter de Guyter., Berlin/Boston, ISBN 978-3-11-024900-2, S. 824.
- ↑ Christoph Janiak, Hans-Jürgen Meyer, Dietrich Gudat, Ralf Alsfasser: Riedel Moderne Anorganische Chemie. 4. Auflage. Walter de Guyter., Berlin/Boston, ISBN 978-3-11-024900-2, S. 822.
- ↑ Wilhelm Keim: Oligomerisierung von Ethen zu α-Olefinen: Erfindung und Entwicklung des Shell-Higher-Olefin-Prozesses (SHOP). In: Angewandte Chemie. Band 125, 2013, S. 12722–12726, doi:10.1002/ange.201305308.
Anmerkungen[Bearbeiten | Quelltext bearbeiten]
- ↑ Das oben bereits erwähnte metathese-aktive Tebbe-Reagenz ist ein Schrock-Carben-Komplex
- ↑ Bei Fischer-Carbenkomplexe liegt das Metall in einer niedrigen Oxidationsstufe vor und bei Schrock-Carbenkomplexen in einer hohen Oxidationsstufe. Fischer-Carbenkomplexe enthalten späte Übergangsmetalle und Schrock-Carbenkomplexe eher frühe bis mittlere Übergangsmetalle. Wenn man die Erkenntnisse der MO-Theorie auf die beiden Typen anwendet so handelt es sich bei einem Fischer-Carbenenkomplex beim freien Carben um ein Singulett-Carben (beide Elektronen sind in einem Orbital. Bei Schrock-Carbenen handelt es sich beim freien Carben um ein Triplettcarben. Bedingt durch diese elektronischen Verhältnisse ist der Carben-Kohlenstoff beim Fischer-Carbenkomplex elektrophil und beim Schrock-Typ nucleophil – bei den Metallen ist das Metall des Fischer-Carbenkomplexes ein nucleophil und die der Schrock-Komplexe sind elektrophil.








