Bergamottin
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Bergamottin | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C21H22O4 | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 338,40 g·mol−1 | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Bergamottin ist eine chemische Verbindung aus der Gruppe der Furocumarine mit Geraniol-Seitenkette. Bergamottin kommt natürlich in der Bergamotte und der Grapefruit vor, in geringeren Mengen auch in anderen Zitrusfrüchten.
Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Bergamottin ist, wie auch 6′,7′-Dihydroxybergamottin, ein Inhibitor von CYP3A4 und mitverantwortlich für den verlangsamten Abbau mancher Arzneimittel nach dem Konsum von Grapefruits.[2][3][4] Durch Bergamottin steigt die orale Bioverfügbarkeit und die Plasmakonzentration dieser Arzneimittel.[5] Die IC50 von Bergamottin bei CYP3A4 liegt unter 10 μM.[6] Die IC50 für Bergamottin bei CYP1B1 liegt bei 13,86 μM.[6]
Bergamottin kann durch Extraktion mit Ethylacetat aus dem Saft der Grapefruit und anschließender Kieselgel-Chromatographie und HPLC isoliert werden.[6] Der Nachweis von Bergamottin erfolgt über HPLC mit UV-Detektor oder durch Massenspektrometrie.[7]
Biosynthese[Bearbeiten | Quelltext bearbeiten]
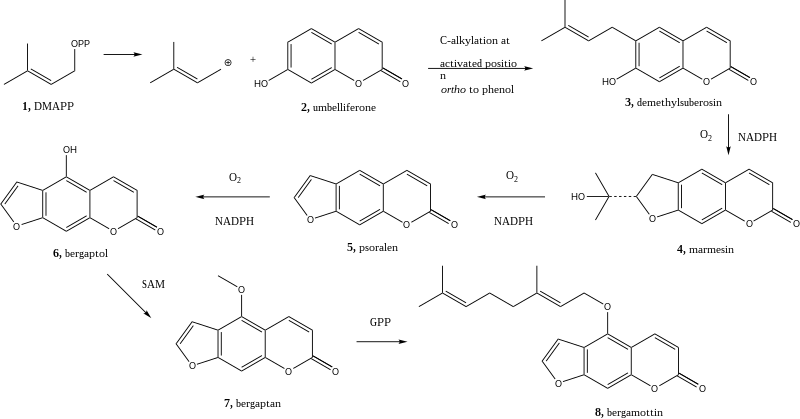
Bergamottin wird über den Shikimat-Weg gebildet.[8] Das Demethylsuberosin (3) wird durch Alkylierung aus Umbelliferon (2) gebildet.[9] Die Alkylierung beginnt mit Dimethylallylpyrophosphat. Ein Ringschluss erzeugt Marmesin (4) unter Verbrauch von NADPH und Sauerstoff durch eine Cytochrom-P450-Monooxygenase.[10] Anschließend wird diese Reaktion zweimal wiederholt, einerseits zur Entfernung der Hydroxyisopropylgruppe von Marmesin (4), wodurch Psoralen (5) gebildet wird, andererseits zur Anfügung einer Hydroxygruppe, wodurch Bergaptol (6) entsteht.[11] Bergaptol wird anschließend mit S-Adenosylmethionin (SAM) methyliert, wodurch Bergapten (7) entsteht. Durch Reaktion mit Geranylpyrophosphat entsteht Bergamottin (8).
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b Datenblatt Bergamottin, analytical standard bei Sigma-Aldrich, abgerufen am 10. Juni 2018 (PDF).
- ↑ D. G. Bailey, J. Malcolm, O. Arnold, J. D. Spence: Grapefruit juice-drug interactions. In: British journal of clinical pharmacology. Band 46, Nummer 2, August 1998, S. 101–110, PMID 9723817, PMC 1873672 (freier Volltext).
- ↑ S. Zhou, S. Yung Chan, B. Cher Goh, E. Chan, W. Duan, M. Huang, H. L. McLeod: Mechanism-based inhibition of cytochrome P450 3A4 by therapeutic drugs. In: Clinical Pharmacokinetics. Band 44, Nummer 3, 2005, S. 279–304, PMID 15762770.
- ↑ M. F. Paine, W. W. Widmer, H. L. Hart, S. N. Pusek, K. L. Beavers, A. B. Criss, S. S. Brown, B. F. Thomas, P. B. Watkins: A furanocoumarin-free grapefruit juice establishes furanocoumarins as the mediators of the grapefruit juice-felodipine interaction. In: The American journal of clinical nutrition. Band 83, Nummer 5, Mai 2006, S. 1097–1105, doi:10.1093/ajcn/83.5.1097, PMID 16685052.
- ↑ Y. Yamaguchi: Synthesis of Furanocoumarin, Benzofuran and Coumarin Derivatives Possessing an Inhibitory Effect on Human CYP, and Elucidation of the Inhibitory Mechanism. In: Yakugaku Zasshi. Band 137, Nummer 10, 2017, S. 1209–1214, doi:10.1248/yakushi.17-00135, PMID 28966261.
- ↑ W. L. Hung, J. H. Suh, Y. Wang: Chemistry and health effects of furanocoumarins in grapefruit. In: Journal of food and drug analysis, Band 25, Nummer 1, Januar 2017, S. 71–83, doi:10.1016/j.jfda.2016.11.008, PMID 28911545.
- ↑ P. Dewick: Medicinal Natural Products:A Biosynthetic Approach, 2. Ausgabe, Wiley&Sons, West Sussex, England, 2001. ISBN 978-0-470-74167-2. S. 145.
- ↑ Emile Bisagni: Synthesis of psoralens and analogues. In: Journal of Photochemistry and Photobiology B: Biology. 14, 1992, S. 23–46, doi:10.1016/1011-1344(92)85081-5.
- ↑ A. I. Voznesensky, J. B. Schenkman: The cytochrome P450 2B4-NADPH cytochrome P450 reductase electron transfer complex is not formed by charge-pairing. In: Journal of Biological Chemistry. Band 267, Nummer 21, Juli 1992, S. 14669–14676, PMID 1321814.
- ↑ U. M. Kent, H. L. Lin, K. R. Noon, D. L. Harris, P. F. Hollenberg: Metabolism of bergamottin by cytochromes P450 2B6 and 3A5. In: The Journal of pharmacology and experimental therapeutics. Band 318, Nummer 3, September 2006, S. 992–1005, doi:10.1124/jpet.105.099887, PMID 16785317.