Cuban
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||
| Allgemeines | |||||||||||||
| Name | Cuban | ||||||||||||
| Andere Namen |
Pentacyclo[4.2.0.02,5.03,8.04,7]octan | ||||||||||||
| Summenformel | C8H8 | ||||||||||||
| Kurzbeschreibung |
schimmernde, farblose Rhomben[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 104,15 g·mol−1 | ||||||||||||
| Aggregatzustand |
fest | ||||||||||||
| Dichte |
1,29 g·cm−3[2] | ||||||||||||
| Schmelzpunkt | |||||||||||||
| Siedepunkt |
200 °C (Zersetzung)[1] | ||||||||||||
| Dampfdruck |
146,7 Pa (25 °C)[4] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Cuban ist eine chemische Verbindung aus der Gruppe der gesättigten polycyclischen Kohlenwasserstoffe. Neben Cunean und Octabisvalen ist Cuban ein Vertreter der drei möglichen gesättigten C8H8-Kohlenwasserstoffe und ein Valenzisomer von Cyclooctatetraen. Die acht Kohlenstoffatome des Cubanmoleküls sind in Form eines Würfels angeordnet.[6]
Das Kohlenstoffgerüst umschließt einen Hohlraum, daher gehört Cuban zur Klasse der Käfigverbindungen, genauer zu den platonischen Kohlenwasserstoffen. Es galt bis zu seiner Erstsynthese im Jahre 1964 zunächst nur als in der Theorie existent und wegen der ungewöhnlich spitzen 90-Grad-Bindungswinkel der Kohlenstoffatome als instabil. Durch diese 90-Grad-Winkel speichert Cuban viel Energie in diesen Bindungen, daher kann es als Grundkörper hochenergetischer Treibstoffe oder Sprengstoffe dienen (siehe auch Tetranitrocuban, Octanitrocuban).[6]
Geschichte[Bearbeiten | Quelltext bearbeiten]
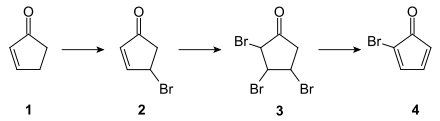
Die Darstellung von Cuban in einer dreizehnstufigen Synthese durch Philip Eaton wurde erstmals 1964 publiziert.[7][8] Die Originalsynthese geht von 2-Cyclopenten-1-on (1) aus, das zunächst in einer Wohl-Ziegler-Reaktion mit N-Bromsuccinimid zu (2) monobromiert wird. Die Tribromverbindung (3) wird durch Weiterbromierung mit elementarem Brom erhalten, aus der die eigentliche Ausgangsverbindung der Cuban-Synthese 2-Bromcyclopentadienon (4) durch Dehydrohalogenierung gewonnen wird:
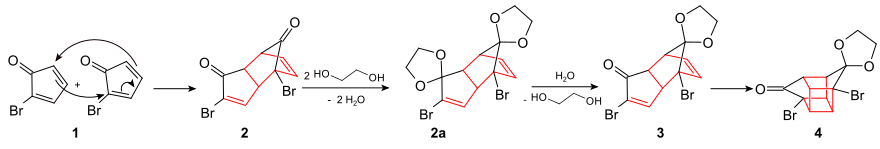
Diese Ausgangsverbindung (2-Bromcyclopentadienon) wird in einem ersten Schritt über eine Diels-Alder-Reaktion zu (2) dimerisiert. Beide Carbonylgruppen in (2) werden mit Ethylenglycol geschützt (2a). Anschließend wird die endo-ständige Acetal-Gruppe selektiv unter Bildung der Verbindung (3) hydrolysiert. Es schließt sich eine intramolekulare photochemische [2+2]-Cycloaddition zum Bromketon (4) an:
Das so gewonnene Bromketon wird über eine Faworski-Umlagerung durch Ring-Kontraktion zur Carbonsäure (5) umgelagert. Die freie Carbonsäure (5) wird in einen Peroxycarbonsäureester (6) überführt und danach thermisch zu (7) decarboxyliert:
Zuletzt wird die verbliebene Acetal-Gruppe ebenfalls hydrolysiert, das Bromketon (8) in einer zweiten Faworski-Reaktion umgelagert und die dabei entstehende Carbonsäure (9) in den entsprechenden Peroxycarbonsäureester (10) überführt. Das Zielmolekül Cuban (11) wird nach einer thermischen Decarboxylierung von (10) erhalten:
Synthese[Bearbeiten | Quelltext bearbeiten]
Der Aufbau der Cubanstruktur kann in einer einfacheren sechsstufigen Synthese zunächst zur Cuban-1,4-dicarbonsäure erfolgen.[9][6] Die Startverbindung der Synthese ist hier Cyclopentanon, welches aus Adipinsäure und Bariumhydroxid, oder Bariumcarbonat als Katalysator, in Gegenwart von Temperaturen von etwa 300 °C synthetisiert wird. Dieses wird im ersten Schritt mittels Ethylenglykol zum Cyclopentanonethylenketal umgewandelt. Dafür benötigt es einen Säurekatalysator, oftmals p-Toluolsulfonsäure, sowie einen Dean-Stark Wasserabscheider, um das Wasser, welches bei der Reaktion als Nebenprodukt entsteht, aus dem Reaktionsgemisch zu entfernen. Dies sorgt für eine Verschiebung des Gleichgewichts auf die Produktseite. Nach mehreren Stunden rückkochen und anschließender, mehrfacher fraktionierter Destillation erhält man das Produkt. Durch Bromierung entsteht das dreifach bromiertes Cyclopentanonketal mit dem Namen 2,2,5-Tribromcyclopentanonethylenketal, welches nach Dehydrohalogenierung und Diels-Alder-Reaktion in ein polycyclisches Diels-Alder-Zwischenprodukt, genauer das Diels-Alder Diketal, überführt wird. Dieses wird in Schwefelsäure einer Entschützung unterzogen und mit Wasser ausgefällt. Das Diels-Alder Diketon ist das Produkt. Eine intramolekulare photochemische [2+2]-Cycloaddition führt zu einer teilweisen Cubanstruktur, genauer einem Decahedron. Eine neue Vorschrift zeigt dafür eine Bestrahlung des Diels-Alder-Diketons mit UV-Licht der Wellenlänge 390 nm in Acetonitril als Lösungsmittel, welchem Benzophenon als Photosensibilisator zugegeben wurde.[10] Durch eine Favorskii-Reaktion unter Rückfluss in Gegenwart von Natronlauge wird die teilweise Cubanstruktur vervollständigt. Das Gesamtprodukt dieser Synthese ist die Cuban-1,4-Dicarbonsäure. Die Gesamtausbeute beträgt über alle Reaktionsstufen etwa 25 %.[6] Die Synthese wurde bereits bis in den Kilogrammmaßstab durchgeführt.[6][11]
Cuban-1,4-dicarbonsäure ist eine Basisverbindung für die Synthese weiterer substituierter Cubanverbindungen.[6] Die Decarboxylierung zum Cuban erfolgt in zwei Schritten über den tert-Butylperester.[7] Eine nahezu quantitative Synthese gelingt durch den photochemischen Abbau eines Thiohydroxamsäureesters.[12][6]
Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Physikalische Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Cuban ist bei Raumtemperatur eine feste, kristalline Substanz, die in zwei polymorphen Kristallformen auftritt.[13] Bei Raumtemperatur liegt die Kristallform II vor, die sich bei 121,9 °C in einem Phasenübergang erster Ordnung in die Kristallform I umwandelt.[13] Diese Kristallform liegt in plastisch kristalliner Form vor.[13] Das bedeutet, die Verbindung befindet sich zwischen den beiden Phasenübergängen in einem mesomorphen Zustand. Bei 131,8 °C wird die flüssige Phase erreicht.[13] Die Dampfdruckfunktion ergibt sich nach August entsprechend log10(P) = −A/T+B (P in Torr, T in K) mit A = 2200 und B = 8.[13] Die Verbindung ist mit einer Standardbildungsenthalpie von ΔfHsolid = 542 kJ·mol−1 beziehungsweise ΔfHgas = 622 kJ·mol−1 stark endotherm.[14] Die Standardverbrennungsenthalpie ΔcHsolid beträgt −4833,27 kJ·mol−1.[14]
Bei Raumtemperatur kristallisiert Cuban in trigonaler Kristallstruktur mit der Raumgruppe R3 mit einem Molekül pro Elementarzelle.[15] Aus Methanol kristallisiert das Molekül in Form von farblosen Rhomben aus.[16] Cuban löst sich in den meisten Lösungsmitteln schwach, bei steigender Temperatur besser; in Wasser ist es unlöslich.[6]
Die mittels Elektronenbeugung bestimmten Bindungslängen betragen für die C–C-Bindung 157,27±0,19 pm, für die C–H-Bindung 111,8±0,8 pm und unterscheiden sich nur wenig von denen im Cyclobutan mit 155,1 pm für die C–C-Bindung und 109 pm für die C–H-Bindung.[4][17][18]
Aufgrund seiner hohen Dichte von 1,29 g·cm−3 wurde Cuban bereits als Treibstoffzusatz für Raketen oder Rennzwecke vorgeschlagen. Es gehört zu den Kohlenwasserstoffen mit der höchsten Dichte.[6]
Chemische Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Trotz der hochgespannten Bindungen ist die Verbindung stabil. Eine messbare, langsame Zersetzung wird erst bei Temperaturen oberhalb von 200 °C beobachtet.[6] Die Aktivierungsenergie für die Thermolyse ist mit einem Wert von 180,5 kJ·mol−1 relativ hoch.[19] Es ist gegen Luftsauerstoff, Licht und Wasser stabil, jedoch sehr flüchtig, so dass es innerhalb von kurzer Zeit aus einem Gefäß diffundieren kann, wenn dieses nicht ordnungsgemäß versiegelt ist.[6][16] Cuban kann intramolekulare metallkatalysierte Bindungsumlagerungen eingehen. Die Reaktion führt in Gegenwart von Silber- oder Palladiumkatalysatoren zum Cunean.[20]
Mit Rhodiumkatalysatoren wird zunächst syn-Tricyclooctadien gebildet, welches thermisch bei 50–60 °C zum Cyclooctatetraen umgewandelt werden kann.[21]
Substitutionen[Bearbeiten | Quelltext bearbeiten]
Das Molekül Cuban kann vielen verschiedenen Substitutionen unterzogen werden, um neue Moleküle mit unterschiedlichen Eigenschaften zu erhalten.[6]
Octanitrocuban[Bearbeiten | Quelltext bearbeiten]
Für die Synthese dieses Moleküls wird in Dichlormethan gelöstem Heptanitrocuban, Nitrosylchlorid zugegeben, um dieses bei Temperaturen von −78 °C und anschließender Einleitung von Ozon in das Molekül Octanitrocuban umzuwandeln. Octanitrocuban gilt als sehr starker Sprengstoff, welcher erstmals 1999 an der Universität von Chicago von den Chemikern Philip E. Eaton und Mao-Xi Zhang synthetisiert wurde. Die immense Detonation lässt sich gemäß folgender Reaktionsgleichung beschreiben.[6]
Iodierte Cubane[Bearbeiten | Quelltext bearbeiten]
Die lichtinduzierte Iodierung von Cuban mit tert-Butylhypoiodit liefert Mono-, Di-, Triiodcubane und höheriodierte Moleküle. Da diese Synthesen jedoch nicht die einfachsten zu sein scheinen, müssen die Synthesen äußerst genau durchgeführt werden.[6]
Die Transmetallierung[Bearbeiten | Quelltext bearbeiten]
Wenn die Lithiierung eines Cubanamids in Gegenwart von Quecksilbersalzen durchgeführt wird, so wird die Lithiumverbindung schnell mercuriert. Dabei wird die stark polare C-Li-Bindung durch eine kovalente, als auch inerte C-Hg-Bindung ersetzt. Dies bedeutet, dass Cubanamide verhältnismäßig schnell in vollständig metallierte Cubane umgewandelt werden können. Die Amidgruppe ist für diese Reaktion wichtig, da sie das lithiierte Intermediat stabilisiert. Ist das Lithium nach der ersten Lithiierung also einmal durch Quecksilber ersetzt, ist die Amidgruppe des Cubanamids für die Aktivierung eines Ortho-Wasserstoffatoms verfügbar. Auf Basis dessen lässt sich die Umwandlung weiterführen.[6]
Das Cubyl-Kation[Bearbeiten | Quelltext bearbeiten]
Ebenso wie das Cuban-Molekül selbst galt das Cubyl-Kation ebenfalls als unmöglich. Trotz vieler Argumente, die gegen dieses Kation sprachen, konnten verschiedene Reaktionen untersucht werden, in denen es eine signifikante Rolle spielen könnte.
So kann es bei der Umwandlung von einem Monoiodcuban durch UV-Bestrahlung in Essigsäure in ein Methoxycuban überführt werden. Des Weiteren besteht die Möglichkeit, dass das Cubyl-Kation an der Synthese von einem monofluorsubstituierten Cuban aus einem monoiodsubstituierten Cuban in Gegenwart von Xenondifluorid (XeF2) beteiligt ist.[6]
Dehydrocubane[Bearbeiten | Quelltext bearbeiten]
1,2-Dehydrocuban, auch Cuben, gilt als das extremste Beispiel für ein pyramidalisiertes Olefin. Der Pyramidalisierungswinkel wurde auf 84° berechnet. Cuben ist ein stark gespanntes, recht offenes und somit auch sterisch ungehindertes Olefin. Um seine Aktivität bei Diels-Alder-Additionen zu untersuchen, wurde 1,2-Diiodcuban mit tert-Butyllithium bei Raumtemperatur in Benzol, in Gegenwart von 11,12-Dimethylen-9,10-dihydro-9,10-ethanoantracen, umgesetzt. Das Ergebnis war ein Diels-Alder-Addukt besonderer Sockelstruktur mit einer Ausbeute von 64 %.[6]
Nutzung in der Zukunft[Bearbeiten | Quelltext bearbeiten]
Auch heute hat die Wissenschaft bei weitem noch nicht alles der grundlegenden Cubanchemie verstanden. Viele neue Derivate, als auch energiereiche Verbindungen können aus Cuban hergestellt werden. Cubane eignen sich ideal für die Herstellung von pharmazeutischen Stoffen. So wurde der Benzolring des Moleküls Lumacaftor, welches zur Behandlung von Mukoviszidose eingesetzt wird, durch einen Cubanwürfel ersetzt. Es zeigten sich eine Reihe von Optimierungen; eine deutlich verbesserte Löslichkeit und Metabolisierung im menschlichen Körper, eine geringere Bioaktivität, jedoch eine erhöhte Zellaktivität. Das Molekül Cuba-Lumacaftor würde also eine verbesserte Variante zu dessen Benzolderivat liefern.
Sowohl Cuban als auch Benzol haben ähnliche Größen; Cuban hat eine diagonale Breite von 2,72 Å hat, was der Breite von Benzol mit 2,79 Å ähnelt. Cuban weist keinerlei Aromatizität auf. Ein Vorteil hiervon ist die Vermeidung der Oxidation der Doppelbindungen im Benzol. Dies kann in biologischen Systemen, vorwiegend während des Stoffwechsels mit dem Enzym Cytochrom p450 stattfinden und häufig zu reaktiven Abbauprodukten mit unerwünschten Nebenwirkungen führen. Cuban könnte dieses Problem möglicherweise beseitigen.[6][22]
Des Weiteren zeigt sich eine Nutzung des Cubans als zukünftiges Treibstoffmittel, da es in seinen Bindungen sehr große Mengen an Energie speichert.[6]
Literatur[Bearbeiten | Quelltext bearbeiten]
- P. E. Eaton: Cubane: Ausgangsverbindungen für die Chemie der neunziger Jahre und des nächsten Jahrhunderts. In: Angew. Chem. Band 104, 1992, S. 1447–1462, doi:10.1002/ange.19921041105.
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b Eintrag zu Cuban. In: Römpp Online. Georg Thieme Verlag, abgerufen am 28. Dezember 2014.
- ↑ Jai Prakash Agrawal: High Energy Materials: Propellants, Explosives and Pyrotechnics , Wiley-VCH Verlag GmbH & Co. KGaA 2010, ISBN 978-3-527-32610-5, S. 138.
- ↑ The Merck Index. An Encyclopaedia of Chemicals, Drugs and Biologicals. 14. Auflage, 2006, ISBN 978-0-911910-00-1, S. 439.
- ↑ a b L. Hedberg, K. Hedberg, E. P. E Kenneth, N. Nodari, A. G. Robiette: Bond lengths and quadratic force field for cubane. In: J. Am. Chem. Soc. 113, 1991, S. 1514–1517, doi:10.1021/ja00005a007.
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ a b c d e f g h i j k l m n o p q r s P. E. Eaton: Cubane: Ausgangsverbindungen für die Chemie der 1990er Jahre und des nächsten Jahrhunderts. In: Angew. Chem., 104, 1992, S. 1447–1462, doi:10.1002/ange.19921041105.
- ↑ a b P. E. Eaton, T. W. Cole: Cubane. In: J. Am. Chem. Soc. 86 1964, S. 3157–3158, doi:10.1021/ja01069a041.
- ↑ P. E. Eaton, T. W. Cole: The Cubane System. In: J. Am. Chem. Soc. 86, 1964, S. 962–964, doi:10.1021/ja01059a072.
- ↑ N. B. Chapman, J. M. Key, K. J. Toyne: The Preparation and Properties of Cage Polycyclic Systems – I. Pentacyclo[5.3.0.02,5.03,9.04,8]decane and Pentacyclo[4.3.0.02,5.03,8.04,7]nonane Derivatives. In: J. Org. Chem. 35, 1970, S. 3860–3867. doi:10.1021/jo00836a062.
- ↑ Diego E. Collin, Edward H. Jackman, Nicolas Jouandon, Wei Sun, Mark E. Light, David C. Harrowven, Bruno Linclau: Decagram Synthesis of Dimethyl 1,4-Cubanedicarboxylate Using Continuous-Flow Photochemistry. In: Synthesis. Band 53, Nr. 07, April 2021, S. 1307–1314, doi:10.1055/s-0040-1705964.
- ↑ Michael J. Falkiner, Stuart W. Littler, Kenneth J. McRae, G. Paul Savage, John Tsanaktsidis: Pilot-Scale Production of Dimethyl 1,4-Cubanedicarboxylate. In: Organic Process Research & Development. Band 17, Nr. 12, 20. Dezember 2013, S. 1503–1509, doi:10.1021/op400181g.
- ↑ D. H. R. Barton, D. Crich, W. B. Motherwell: New and improved methods for the radical decarboxylation of acids. In: J. Chem. Soc., Chem. Commun. 1983, S. 939–941, doi:10.1039/C39830000939.
- ↑ a b c d e M. A. White, R. E. Wasylishen, P. E. Eaton, Y. Xiong, K. Pramod, N. Nodari: Orientational Disorder in Solid Cubane: A Thermodynamic and 13C NMR Study. In: J. Phys. Chem., 96, Nr. 1, 1992, S. 421–425, doi:10.1021/j100180a078.
- ↑ a b B. D. Kybett, S. Carroll, P. Natalis, D. W. Bonnell, J. L. Margrave, J. L. Franklin: Thermodynamic Properties of Cubane. In: J. Am. Chem. Soc., 88, 1966, S. 626–626, doi:10.1021/ja00955a056.
- ↑ E. B. Fleischer: X-Ray Structure Determination of Cubane. In: J. Am. Chem. Soc., 86, 1964, S. 3889–3890, doi:10.1021/ja01072a069.
- ↑ a b Fritz Vögtle: Reizvolle Moleküle der Organischen Chemie (= Teubner Studienbücher Chemie). Vieweg+Teubner Verlag, Wiesbaden 1989, ISBN 978-3-519-03503-9, doi:10.1007/978-3-322-96705-3.
- ↑ N. L. Allinger, P. E. Eaton: The geometries of pentaprismane and hexaprismane insights from molecular mechanics. In: Tetrahedron Lett., 24, 1983, S. 3697–3700, doi:10.1016/S0040-4039(00)94512-X.
- ↑ N. L. Allinger: Conformational Analysis. 130. MM2. A Hydrocarbon Force Field Utilizing V1 and V2 Torsional Terms. In: J. Am. Chem. Soc., 99, 1977, S. 8127–8134, doi:10.1021/ja00467a001.
- ↑ H.-D. Martin, T. Urbanek, P. Pföhler, R. Walsh: The pyrolysis of cubane; an example of a thermally induced hot molecule reaction. In: J. Chem. Soc., Chem. Commun., 1985, S. 964–965, doi:10.1039/C39850000964.
- ↑ P. E. Eaton, L. Cassar, J. Halpern: Silver(I)- and Palladium(II)-Catalyzed Isomerizations of Cubane. Synthesis and Characterization of Cuneane. In: J. Am. Chem. Soc., 92, 1970, S. 6366–6368, doi:10.1021/ja00724a061.
- ↑ L. Cessar, P. E. Eaton, J. Halpern: Catalysis of Symmetry-Restricted Reactions by Transition Metal Compounds. The Valence Isomerization of Cubane. In: J. Am. Chem. Soc., 92, 1970, S. 3515–3518, doi:10.1021/ja00714a075.
- ↑ Dongdong Wang, Xiaohong Lyu, Mengtao Sun, Yongqiang Liang: Spectral Analysis on Cuba-Lumacaftor: Cubane as Benzene Bioisosteres of Lumacaftor. In: ACS Omega. Band 8, Nr. 45, 14. November 2023, S. 43332–43340, doi:10.1021/acsomega.3c07532, PMID 38024720, PMC 10652726 (freier Volltext).