Glial Cell Line-derived neurotrophic Factor
| Glial Cell Line-derived neurotrophic Factor | ||
|---|---|---|
| ||
| Eigenschaften des menschlichen Proteins | ||
| Bezeichner | ||
| Gen-Name | GDNF | |
| Externe IDs | ||
| Vorkommen | ||
| Homologie-Familie | Hovergen | |
Glial cell line-derived neurotrophic factor (GDNF) ist ein Protein, welches beim Menschen durch das GDNF-Gen kodiert wird und das Überleben vieler Arten von Neuronen fördert.[1][2] Es wird durch GFRα-Rezeptoren, insbesondere GFRα1, signalisiert. Es ist auch für die Bestimmung von Spermatogonien zu primären Spermatozyten verantwortlich, d. h., es wird vom RET-Proto-Onkogen (RET) empfangen und teilt durch Bildung eines Gradienten mit SCF die Spermatogonien in zwei Zellen. Infolgedessen kommt es zur Retention von Spermatogonien und zur Bildung von Spermatozyten.
Die GDNF-Ligandenfamilie (GFL)[Bearbeiten | Quelltext bearbeiten]
GDNF wurde 1991 als erstes Mitglied der GDNF-Ligandenfamilie entdeckt.[3]
Funktion[Bearbeiten | Quelltext bearbeiten]
GDNF ist sowohl im peripheren als auch im zentralen Nervensystem weit verbreitet. Es kann von Astrozyten, Oligodendrozyten, Schwann-Zellen, Motoneuronen und Skelettmuskeln während der Entwicklung und des Wachstums von Neuronen und anderen peripheren Zellen sezerniert werden.[4]
Das GDNF-Gen kodiert einen hoch konservierten neurotrophen Faktor. Es wurde gezeigt, dass die rekombinante Form dieses Proteins das Überleben und die Differenzierung dopaminerger Neuronen in Kultur fördert und die durch Axotomie ausgelöste Apoptose von Motoneuronen verhindern kann. GDNF wird als 211 Aminosäuren langer Proteinvorläufer, pro-GDNF, synthetisiert.[4] Die Prä-Sequenz führt das Protein zur Sekretion in das endoplasmatische Retikulum. Während der Sekretion faltet sich der Proteinvorläufer über eine Sulfid-Sulfid-Bindung und dimerisiert. Während der Verpackung und Aufbereitung im Golgi-Apparat wird das Protein dann durch N-gebundene Glykosylierung modifiziert. Schließlich wird der Proteinvorläufer aufgrund einer proteolytischen Konsensussequenz an seinem C-Terminus einer Proteolyse unterzogen und damit in seine reife Form mit 134 Aminosäuren überführt.[4] Zu den Proteasen, die bei der Proteolyse von pro-GDNF zu reifem GDNF eine Rolle spielen, gehören Furin, PACE4, PC5A, PC5B und PC7. Da mehrere Proteasen den Proteinvorläufer spalten können, können vier verschiedene reife Formen von GDNF produziert werden.[4] Die proteolytische Verarbeitung von GDNF erfordert SorLA, einen Rezeptor für die Proteinsortierung. SorLA bindet an keine anderen GFLs.[5] Die reife Form des Proteins ist ein Ligand für das Produkt des Protoonkogens RET (rearranged during transfection). Neben dem Transkript, das für GDNF kodiert, wurden auch zwei weitere alternative Transkripte beschrieben, die für unterschiedliche Proteine kodieren, die als astrozytäre trophische Faktoren bezeichnet werden. Mutationen in diesem Gen können mit der Hirschsprung-Krankheit in Verbindung gebracht werden.[2]
GDNF ist in der Lage, die ERK-1- und ERK-2-Isoformen der MAP-Kinase in sympathischen Neuronen sowie den PI3K/AKT-Signalweg über die Aktivierung seiner Rezeptortyrosinkinasen zu aktivieren.[6][7] Über seinen GFRα1-Rezeptor kann er auch Kinasen der Src-Familie aktivieren.[8]
Die auffälligste Eigenschaft von GDNF ist seine Fähigkeit, das Überleben von dopaminergen[9] und motorischen Neuronen. Es verhindert die Apoptose in motorischen Neuronen während der Entwicklung, verringert den Gesamtverlust von Neuronen während der Entwicklung, rettet Zellen vor dem axotomie-induzierten Tod und verhindert die chronische Degeneration.[4]
Diese Neuronenpopulationen sterben im Verlauf der Parkinsonschen Krankheit und der amyotrophen Lateralsklerose (ALS) ab. GDNF reguliert auch die Nierenentwicklung und die Spermatogenese und hat in Rattenversuchen eine starke und schnelle negative (verbessernde) Wirkung auf den Alkoholkonsum.[10] GDNF fördert auch die Bildung von Haarfollikeln und die Wundheilung der Haut, indem es auf die im Bulge-Kompartiment ansässigen Haarfollikel-Stammzellen (BSCs) abzielt.[11]
Struktur[Bearbeiten | Quelltext bearbeiten]
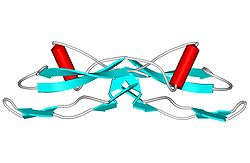
Die Struktur von GDNF ähnelt der von TGFβ2.[6] GDNF besitzt zwei fingerartige Strukturen, die mit dem GFRα1-Rezeptor interagieren. Die N-gebundene Glykosylierung, die während der Sekretion von pro-GDNF erfolgt, findet an der Spitze einer der fingerartigen Strukturen statt. Der C-Terminus des reifen GDNF spielt eine wichtige Rolle bei der Bindung sowohl an Ret als auch an den GFRα1-Rezeptor. Der C-Terminus bildet eine Schleife aus den Wechselwirkungen zwischen den Cysteinen Cys131, Cy133, Cys68 und Cys 72.[4]
Interaktionen[Bearbeiten | Quelltext bearbeiten]
Es wurde gezeigt, dass der Glial cell line-derived neurotrophic factor mit GFRA1 und dem Rezeptor alpha 1 der GDNF-Familie interagiert.[4][12] Die Aktivität von GDNF und anderen GFLs wird durch die Rezeptortyrosinkinase RET vermittelt. Damit der Rezeptor die GDNF-Aktivität modulieren kann, muss GDNF auch an GFRα1 gebunden sein.[6] Die Intensität und Dauer der RET-Signalisierung kann ebenfalls durch den GPI-Anker von GFRα1 überwacht werden, indem er mit Kompartimenten der Zellmembran interagiert, z. B. Lipid Rafts oder Spaltung durch Phospholipasen.[7] In Zellen, denen RET fehlt, können einige Liganden der GDNF-Familie auch durch das neurale Zelladhäsionsmolekül (NCAM) aktiviert werden. GDNF kann über seinen GFRα1-GPI-Anker mit NCAM assoziieren. Die Assoziation zwischen GDNF und NCAM führt zur Aktivierung der zytoplasmatischen Protein-Tyrosin-Kinasen Fyn und FAK.[13]
Therapeutisches Potential[Bearbeiten | Quelltext bearbeiten]
GDNF wurde als Mittel zur Behandlung der Parkinson-Krankheit erforscht, obwohl frühe Forschungsarbeiten keine signifikante Wirkung zeigten.[3][14]
Im Jahr 2012 begann die Universität Bristol eine fünfjährige klinische Studie mit Parkinson-Patienten, bei der Chirurgen jedem der 41 Teilnehmer einen Port in den Schädel einführten, durch den das Medikament direkt zu den geschädigten Zellen gelangen konnte.[15] Die Ergebnisse der Doppelblindstudie, bei der die Hälfte der Teilnehmer nach dem Zufallsprinzip regelmäßige GDNF-Infusionen und die andere Hälfte Placebo-Infusionen erhielt, zeigten keinen statistisch signifikanten Unterschied zwischen der aktiven Behandlungsgruppe und denjenigen, die ein Placebo erhielten, bestätigten aber die Auswirkungen auf die geschädigten Gehirnzellen.[16] Die Studie wurde von Parkinson's UK mit Unterstützung des Cure Parkinson's Trust finanziert, dessen Gründer Tom Isaacs einer der Teilnehmer war.[17]
Neuropsychopharmakologie[Bearbeiten | Quelltext bearbeiten]
Es gibt Hinweise darauf, dass Gdnf ein auf Alkohol reagierendes Gen ist, das bei kurzfristigem Alkoholkonsum hochreguliert wird, während es beim Entzug von übermäßigem Alkoholkonsum herunterreguliert wird.[18] Eine Studie konnte zeigen, dass Alkoholentzug die Expression von Gdnf in mit Sucht zusammenhängenden Hirnbereichen wie dem ventralen tegmentalen Areal (VTA) und dem Nucleus Accumbens sowie die DNA-Methylierung des Gdnf-Gens bei Ratten verändert.[19]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ Lin LF, Doherty DH, Lile JD, Bektesh S, Collins F: GDNF: a glial cell line-derived neurotrophic factor for midbrain dopaminergic neurons. In: Science. 260. Jahrgang, Nr. 5111, Mai 1993, S. 1130–2, doi:10.1126/science.8493557, PMID 8493557, bibcode:1993Sci...260.1130L (englisch).
- ↑ a b Entrez Gene: GDNF glial cell derived neurotrophic factor. (englisch).
- ↑ a b Vastag B: Biotechnology: Crossing the barrier. In: Nature. 466. Jahrgang, Nr. 7309, August 2010, S. 916–8, doi:10.1038/466916a, PMID 20725015 (englisch).
- ↑ a b c d e f g Cintrón-Colón AF, Almeida-Alves G, Boynton AM, Spitsbergen JM: GDNF synthesis, signaling, and retrograde transport in motor neurons. In: Cell and Tissue Research. 382. Jahrgang, Nr. 1, Oktober 2020, S. 47–56, doi:10.1007/s00441-020-03287-6, PMID 32897420, PMC 7529617 (freier Volltext) – (englisch).
- ↑ Glerup S, Lume M, Olsen D, Nyengaard JR, Vaegter CB, Gustafsen C, Christensen EI, Kjolby M, Hay-Schmidt A, Bender D, Madsen P, Saarma M, Nykjaer A, Petersen CM: SorLA controls neurotrophic activity by sorting of GDNF and its receptors GFRα1 and RET. In: Cell Reports. 3. Jahrgang, Nr. 1, Januar 2013, S. 186–99, doi:10.1016/j.celrep.2012.12.011, PMID 23333276 (englisch).
- ↑ a b c Kotzbauer PT, Lampe PA, Heuckeroth RO, Golden JP, Creedon DJ, Johnson EM, Milbrandt J: Neurturin, a relative of glial-cell-line-derived neurotrophic factor. In: Nature. 384. Jahrgang, Nr. 6608, Dezember 1996, S. 467–70, doi:10.1038/384467a0, PMID 8945474, bibcode:1996Natur.384..467K (englisch).
- ↑ a b Ibáñez CF, Andressoo JO: Biology of GDNF and its receptors - Relevance for disorders of the central nervous system. In: Neurobiology of Disease. 97. Jahrgang, Pt B, Januar 2017, S. 80–89, doi:10.1016/j.nbd.2016.01.021, PMID 26829643 (englisch).
- ↑ Airaksinen MS, Saarma M: The GDNF family: signalling, biological functions and therapeutic value. In: Nature Reviews. Neuroscience. 3. Jahrgang, Nr. 5, Mai 2002, S. 383–94, doi:10.1038/nrn812, PMID 11988777 (englisch).
- ↑ Oo TF, Kholodilov N, Burke RE: Regulation of natural cell death in dopaminergic neurons of the substantia nigra by striatal glial cell line-derived neurotrophic factor in vivo. In: The Journal of Neuroscience. 23. Jahrgang, Nr. 12, Juni 2003, S. 5141–8, doi:10.1523/JNEUROSCI.23-12-05141.2003, PMID 12832538, PMC 6741204 (freier Volltext) – (englisch).
- ↑ Carnicella S, Kharazia V, Jeanblanc J, Janak PH, Ron D: GDNF is a fast-acting potent inhibitor of alcohol consumption and relapse. In: Proceedings of the National Academy of Sciences of the United States of America. 105. Jahrgang, Nr. 23, Juni 2008, S. 8114–9, doi:10.1073/pnas.0711755105, PMID 18541917, PMC 2423415 (freier Volltext), bibcode:2008PNAS..105.8114C (englisch).
- ↑ Lisse TS, Sharma M, Vishlaghi N, Pullagura SR, Braun RE: GDNF promotes hair formation and cutaneous wound healing by targeting bulge stem cells. In: npj Regenerative Medicine. 5. Jahrgang, Nr. 13, Juni 2020, S. 13, doi:10.1038/s41536-020-0098-z, PMID 32566252, PMC 7293257 (freier Volltext) – (englisch).
- ↑ Cik M, Masure S, Lesage AS, Van Der Linden I, Van Gompel P, Pangalos MN, Gordon RD, Leysen JE: Binding of GDNF and neurturin to human GDNF family receptor alpha 1 and 2. Influence of cRET and cooperative interactions. In: The Journal of Biological Chemistry. 275. Jahrgang, Nr. 36, September 2000, S. 27505–12, doi:10.1074/jbc.M000306200, PMID 10829012 (englisch).
- ↑ Paratcha G, Ledda F, Ibáñez CF: The neural cell adhesion molecule NCAM is an alternative signaling receptor for GDNF family ligands. In: Cell. 113. Jahrgang, Nr. 7, Juni 2003, S. 867–79, doi:10.1016/s0092-8674(03)00435-5, PMID 12837245 (englisch).
- ↑ Intermittent Bilateral Intraputamenal Treatment with GDNF. In: The Michael J. Fox Foundation for Parkinson's Research | Parkinson's Disease. (englisch).
- ↑ The radical drug trial hoping for a miracle Parkinson's cure In: BBC News. Abgerufen am 10. März 2019 (englisch).
- ↑ GDNF clinical trial offers hope of restoring brain cells damaged in Parkinson's. In: Parkinsons UK. 27. Februar 2019, abgerufen am 10. März 2019 (englisch).
- ↑ Pioneering trial offers hope for restoring brain cells damaged in Parkinson's. In: University of Bristol. 19. Februar 2019 (englisch).
- ↑ Barak S, Ahmadiantehrani S, Logrip ML, Ron D: GDNF and alcohol use disorder. In: Add. Biol. 24. Jahrgang, Nr. 3, 2019, S. 335–343, doi:10.1111/adb.12628, PMID 29726054 (englisch).
- ↑ Maier, HB, Neyazi A, Hillemacher T, Pathak H, Rhein M, Bleich S, Goltseker K, Sadot-Sogrin Y, Even-Chen O, Frieling H, Barak S: Alcohol consumption alters Gdnf promoter methylation and expression in rats. In: J. Psych. Res. 121. Jahrgang, Februar 2020, S. 1–9, doi:10.1016/j.jpsychires.2019.10.020, PMID 31710958 (englisch).