Hydroperoxide
| Hydroperoxide |
|---|
| R ist eine Organylgruppe. Die funktionelle Gruppe ist blau markiert. |
Hydroperoxide sind eine Klasse organisch-chemischer Verbindungen mit der allgemeinen Struktur R–O–OH, wobei R ein kohlenstoffhaltiger Rest ist.
Gewinnung und Darstellung[Bearbeiten | Quelltext bearbeiten]
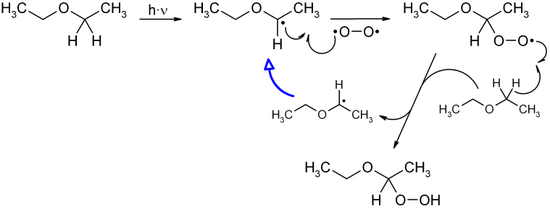
Hydroperoxide entstehen meist bei Autoxidationsprozessen (Selbstoxidation) durch Reaktion organischer Verbindungen mit Luftsauerstoff oder durch Reaktion metallorganischer Verbindungen (z. B. Grignard-Verbindungen) mit Sauerstoff. Das Formelschema zeigt den lichtinduzierten Mechanismus der Hydroperoxid-Bildung am Beispiel des Diethylether-Hydroperoxids („Etherperoxid“-Bildung):[1]
Das zunächst durch Lichteinstrahlung gebildete Radikal des Diethylethers reagiert mit Sauerstoff zum Etherperoxidradikal, welches mit einem weiteren Molekül Diethylether zum Diethyletherhydroperoxid und einem Diethylether-Radikal reagiert. Da bei jedem Umsetzungszyklus ein neues Diethylether-Radikal entsteht, kommt es zu einer Kettenreaktion, solange noch Sauerstoff vorhanden ist. Photooxygenierungen von Alkenen mit mindestens einem Wasserstoffatom in Allylstellung führen zu Hydroperoxiden.[2]
Für n-Alkane ist die Reaktion mit Luftsauerstoff zu Hydroperoxiden kaum messbar, verzweigte Kohlenwasserstoffe – vor allem solche mit tertiärem Kohlenstoffatom – jedoch sind der Selbstoxidation zugänglicher. Cumolhydroperoxid entsteht durch Luftoxidation von Cumol in der Benzylstellung. Dieses Verfahren spielt bei der industriellen Herstellung von Phenol und Aceton aus Benzol und Propen eine wichtige Rolle.[3]
Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Hydroperoxide sind instabile Verbindungen,[4] die meist nur in Lösung hergestellt und nur in Ausnahmefällen in Substanz isoliert werden können. Sie sind meist unbeständig und häufig explosiv. Aus diesem Grund müssen Ether, die nach obigem Mechanismus mit Luftsauerstoff reagieren können, unter Licht- und Luftausschluss aufbewahrt werden. Weiterhin werden Kaliumhydroxid-Plätzchen in das Etherbehältnis gegeben, um entstandene Hydroperoxide durch Deprotonierung in die entsprechenden Kaliumsalze zu überführen. Diese sind in der etherischen Phase unlöslich und fallen zu Boden, wodurch bei Etherentnahme die gleichzeitige Überführung von Hydroperoxidverbindungen in Reaktionsgefäße und dergleichen verhindert wird. Der Zerfall von Hydroperoxiden geschieht meist ebenfalls radikalisch.
Hydroperoxide sind schwach sauer und bilden das Hydroperoxid-Ion R–O–O−. Die Salze können in der Regel nicht isoliert werden.
Ein qualitativer Hinweis auf Hydroperoxide beruht auf ihrer oxidativen Wirkung. Man löst unter Erwärmen etwas Kaliumiodid in Eisessig und fügt einige Tropfen der zu prüfenden Substanz hinzu. Sind Hydroperoxide (oder auch Peroxide) anwesend, so färbt sich die zuvor farblose Lösung aufgrund des sich bildenden Iods augenblicklich tiefbraun. Das kommerziell erhältliche Kaliumiodid-Stärke-Papier (färbt sich in Gegenwart von Oxidationsmitteln tiefblau-violett) kann ebenfalls zum Schnelltest verwendet werden. Ethervorräte, die längere Zeit gelagert wurden, sollten auf diese Weise auf ihren Peroxidgehalt überprüft werden, bevor man sie verwendet oder gar destilliert. Da die Etherhydroperoxide einen höheren Siedepunkt als der zugrunde liegende Ether besitzen, würde bei einer Destillation der Peroxidgehalt im Rückstand gefährlich ansteigen, was zur Explosion führen kann. Eine weitere Methode zur Bestimmung von Hydroperoxiden verwendet das FOX-Reagenz.
Verwendung[Bearbeiten | Quelltext bearbeiten]
Ein technisch bedeutsames Hydroperoxid ist Cumolhydroperoxid, das bei der Acetonsynthese nach dem Hock-Verfahren als nicht isoliertes Zwischenprodukt auftritt.[5] Im Syntheselabor wird das vergleichsweise stabile, und daher auch kommerziell erhältliche tert-Butylhydroperoxid zur Epoxidierung verwendet. Eine besonders bekannte Anwendung dieser Art ist die Sharpless-Epoxidierung.
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ Albert Gossauer: Struktur und Reaktivität der Biomoleküle, Verlag Helvetica Chimica Acta, Zürich, 2006, S. 212–213, ISBN 978-3-906390-29-1.
- ↑ Siegfried Hauptmann: Organische Chemie, 2. Auflage, VEB Deutscher Verlag für Grundstoffindustrie, Leipzig, 1985, S. 777–778, ISBN 3-342-00280-8.
- ↑ Adalbert Wollrab: Organische Chemie, Springer Verlag, 2009, 2. Auflage, S. 76 ff., ISBN 978-3-642-00780-4.
- ↑ Unfälle durch peroxidbildende Substanzen Merkblatt der Berufsgenossenschaft Rohstoffe und chemische Industrie (Memento vom 22. Mai 2018 im Internet Archive), abgerufen am 21. Mai 2018.
- ↑ Siegfried Hauptmann: Organische Chemie, 2. Auflage, VEB Deutscher Verlag für Grundstoffindustrie, Leipzig, 1985, S. 334, ISBN 3-342-00280-8.