Integrase-Inhibitor
Integrase-Inhibitoren (Integrations-Inhibitoren) sind virustatisch wirkende Arzneistoffe. Es handelt sich um Wirkstoffe, die das Schlüsselenzym Integrase von Retroviren wie HIV-1 hemmen und speziell dort im Rahmen einer antiretroviralen Therapie eingesetzt werden. Substanzen dieser Klasse enthalten die Endsilbe „-tegravir“ im Namen.
Im Jahr 2000 wurde erstmals das Prinzip der Strangtransfer-Inhibition aufgedeckt, weswegen für die Substanzklasse die Bezeichnung Integrase-Strangtransfer-Inhibitor (INSTI) verwendet wird. 2005 begannen die ersten klinischen Studien, nachdem die Entwicklung bis 2000 durch einen Mangel an geeigneten Testmethoden und durch die hohe Toxizität einiger Wirkstoffe gebremst wurde. 2007 wurde Raltegravir als erster INSTI zugelassen.
HIV-1-Integrase[Bearbeiten | Quelltext bearbeiten]
Die Integrase (IN) ist neben der reversen Transkriptase und HIV-Protease eines der drei Schlüsselenzyme im Replikationszyklus von Retroviren wie HIV. Sie vermittelt die Integration viraler DNA in die Wirts-DNA im Zellkern und ist damit für die Vermehrung von HIV essentiell. Die HIV-1-Integrase entsteht aus dem Gal-pol-Polypeptid, das nach Eindringen von HIV in die Wirtszelle gebildet wird. Virionen enthalten aber bereits etwa 120 Kopien der Integrase, die damit vor Bildung des Polypeptides im Cytosol zur Verfügung stehen.[1]
Das reife Enzym besteht aus etwa 300 Aminosäuren und ist 32 kDa groß, Kristallstrukturen sind verfügbar. Die HIV-1-Integrase besteht aus drei Proteindomänen, die durch flexible Linker verbunden sind: einer katalytisch aktiven (catalytic core domain, CCD) sowie einer C- (CTD) und N-terminalen (NTD) Domäne.[1][2] CCD ist unter Retroviren hoch konserviert, hierbei bilden Asp64, Asp116 und Glu152 das katalytisches Zentrum, die durch Metallionen koordiniert werden und für die Interaktion mit der DNA wichtig sind.
Die Integration viraler DNA verläuft über mindestens vier Schritte. Jeder dieser Schritte könnte theoretisch inhibitiert werden.[3]
Zunächst bindet ein Multimer an HIV-1-Integrasen im Cytosol an die virale DNA, es entsteht ein sogenanntes Intasome, ein stabiler sogenannter Präintegrationskomplex.[1] Pyranodipyrimidine können diesen Schritt hemmen. Der Präintegrationskomplex wird im zweiten Schritt durch die Integrase prozessiert, wodurch 3'-Hydroxylenden bei der gebundenen DNA geschaffen werden. Hierbei inhibieren Styrylchinolone oder Diketosäuren diesen Prozessierungsschritt. Der vorbereitete Präintegrationskomplex gelangt durch die Kernporen in den Zellkern, es erfolgt der Strangtransfer durch die Integrase – die virale DNA wird gelangt in die menschliche DNA. Schließlich erfolgt die Reparatur der dabei entstandenen Lücken durch wirtseigene Reparaturenzyme, was mittels Methylxanthine gehemmt werden kann.
Wirkung[Bearbeiten | Quelltext bearbeiten]
Strangtransfer-Inhibitoren[Bearbeiten | Quelltext bearbeiten]
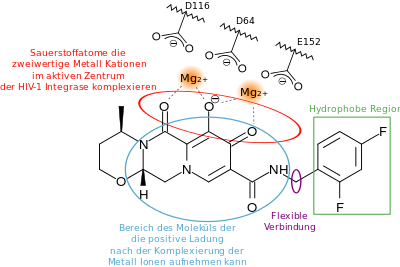
Zugelassene Integrase-Inhibitoren behindern den Strangtransfer, wodurch die Wirkstoffklasse auch als Integrase-Strangtransfer-Inhibitoren (INSTIs) bezeichnet wird.[3] Substanzen dieser Klasse enthalten die Endsilbe „-tegravir“ im Namen.[4] 2007 wurde Raltegravir als erster INSTI zugelassen, es ging aus den Vorarbeiten mit einer Diketosäure hervor. Der Pharmakophor von INSTIs bestehen aus einem Kernbereich, der Chelatkomplexe mit Metallionen bildet – in der Regel einer planeren Anordnung von drei Sauerstoffatomen.[1] Die Seitenkette ist ein Halogenaromat. Nur wenn die HIV-1-Integrase bereits ein Komplex mit der viralen DNA gebildet hat, binden INSTIs an dessen aktivem Zentrum und konkurrieren mit der Wirts-DNA. Auf die erste Generation der INSTIs (Raltegravir, Elvitegravir) folgte die zweite Generation (Cabotegravir, Dolutegravir und Bictegravir), deren Vertreter über eine höhere Resistenzbarriere verfügen, besser in das aktive Zentrum hineinpassen und ferner noch weitere Bindungen mit der IN ausbilden. Daher verweilen diese INSTIs auch länger im aktiven Zentrum – so betragen die Dissoziationshalbwertszeiten von Dolutegravir und Bictegravir etwa 100 bzw. 160 Stunden.[1]
Raltegravir und Cabotegravir sind nicht als Eintablettenregime verfügbar. Cabotegravir wird zudem als Depotpräparat ausschließlich zusammen mit dem nichtnukleosidischen Reverse-Transkriptase-Inhibitor Rilpivirin verabreicht (Cabotegravir plus Rilpivirin Long Acting, CARLA).
In-vitro wirken INSTIs bereits in nanomolaren Bereich, so liegt der IC50 von Bictegravir und Dolutegravir bei 0,2 ng/ml, von Ralegravir bei 2,2–5,3 ng/ml.[5] INSTIs liegen überwiegend proteingebunden vor, beispielsweise an Albumin, was den IC50 erheblich erhöht.
Allosterische Integrase-Inhibitoren[Bearbeiten | Quelltext bearbeiten]
Im Gegensatz zu INSTIs binden allosterische Integrase-Inhibitoren (ALLINIs) nicht am katalytisch aktiven Zentrum, sondern an einer davon weit entfernten konservierten Bindungstasche der CCD. Diese steht natürlicherseits für die Bindung des zellulären Coaktivators LEDGF/p75 (human lens epithelium-derived growth factor) zur Verfügung, der Cofaktor unterstützt u. a. die virale Replikation.[3] ALLINIs verursachen eine abnormale Hypermultimerisation der IN. Aufgrund des Namens der Coaktivators werden diese Inhibitoren auch LEDGINs bezeichnet, alternativ NCINI (nicht-katalytische INIs), INLAIs (Integrase-LEDGF allosterische Inhibitoren) oder MINIs (multimerische INIs).[1]
Substanzen dieser Klasse teilen drei Strukturmerkmale: ein Carboxygruppe, eine kompakte aliphatische Seitenkette (typischerweise tert-Butoxy) sowie eine relativ sperrige hydrophobische Gruppe wie ein (substituierter) Aromat.[1] Die Carboxygruppe bildet Wasserstoffbrückenbindungen mit den Amiden von Glu170 und His171 der Integrase aus, was bei LEDGF/p75 durch Asp366 erfolgt wäre. Die Seitenkette füllt die Basis der Bindungstasche, während der Aromat mit zahlreichen hydrophoben Resten beider Untereinheiten der Integrase interagiert – dies entspräche Ile365 bei LEDGF/p75.
ALLINIs wie z. B. Pirmitegravir befinden sich in klinischer Prüfung und sind daher noch nicht zugelassen.
Pharmakokinetik[Bearbeiten | Quelltext bearbeiten]
INSTIs können mit oder ohne Nahrung aufgenommen werden. Eine Ausnahme stellt das Eintablettenregime Dolutegravir/Rilpivirin dar, wegen Rilpivirin muss es mit dem Essen eingenommen werden.[5]
Die Substanzen werden kaum über die Nieren ausgeschieden, stattdessen in der Leber verstoffwechselt. So werden Dolutegravir, Raltegravir und Cabotegravir durch UDP-Glucuronosyltransferasen (UDP-GT) wie 1A1 umgesetzt, Bictegravir durch Cytochrom P450 3A4 (CYP3A4) sowie UDP-GT 1A1 und Elvitegravir insbesondere durch CYP3A4.[5] Daher muss Elvitegravir zusammen mit den Pharmakoenhancer Cobicistat verabreicht werden, das CYP3A4 inhibiert. Bis auf Elvitegravir sind INSTIs keine starken Inducer oder Inhibitoren metabolisierender Enzyme. Elvitegravir verstärkt die Aktivität von Cytochrom P450 2C9 (CYP2C9), das durch das gleichzeitig verabreichte Cobicistat wieder inhibiert wird. Arzneimittelwechselwirkungen können daher bei parallel verabreichten Arzneimitteln auftreten, die sich auf UDP-GT oder CYP3A4 auswirken.
INSTs bilden Chelate mit polyvalenten Kationen aus und vermindern deren Absorption. Beispielsweise sollen Calcium-enthaltende Antazida bei Raltegravir vermieden werden, wenn dieses einmal täglich eingenommen wird. Generell soll die Einnahme Calcium-, Aluminium- oder Magnesium-enthaltender Antazida dosis- und zeitversetzt zu INSTIs erfolgen.
Die Halbwertszeiten oral aufgenommener INSTIs liegt bei 9 bis knapp 40 Stunden.[5] Beim intramuskulär applizierten Cabotegravir beträgt diese als Depotpräparat bis zu knapp 15 Wochen.[5]
Nebenwirkungen[Bearbeiten | Quelltext bearbeiten]
Die häufigsten (> 10 %) unerwünschten Ereignisse während der klinischen Studien an derzeit bekannten Wirkstoffen waren Diarrhoe, Übelkeit, Kopfschmerzen und Fieber. Die Therapieabbruchrate aufgrund von unerwünschten Ereignissen lag bei mit Raltegravir behandelten Patienten bei zwei Prozent im Vergleich zu 1,4 Prozent bei Placebo.
Es ist umstritten, ob sich das Risiko für kardiovaskuläre Ereignisse bei therapienaiven HIV-Patienten unter einer INSTI-basierenden ART erhöht.[6]
Anwendungsgebiete[Bearbeiten | Quelltext bearbeiten]
Sie werden zur Bekämpfung der Replikation eines Virus eingesetzt.
Literatur[Bearbeiten | Quelltext bearbeiten]
- Andrea Savarino: A historical sketch of the discovery and development of HIV-1 integrase inhibitors. In: Expert Opinion on Investigational Drugs. Band 15, Nr. 12, Dezember 2006, S. 1507–1522, doi:10.1517/13543784.15.12.1507, PMID 17107277 (englisch).
- Yue Wang et al.: Advances in the development of HIV integrase strand transfer inhibitors. In: European Journal of Medicinal Chemistry. Band 225, 5. Dezember 2021, S. 113787, doi:10.1016/j.ejmech.2021.113787, PMID 34425310 (englisch).
- Nokuzola Mbhele et al.: HIV-1 integrase strand transfer inhibitors: a review of current drugs, recent advances and drug resistance. In: International Journal of Antimicrobial Agents. Band 57, Nr. 5, Mai 2021, S. 106343, doi:10.1016/j.ijantimicag.2021.106343, PMID 33852932 (englisch).
- Kimberly K. Scarsi et al.: HIV-1 Integrase Inhibitors: A Comparative Review of Efficacy and Safety. In: Drugs. Band 80, Nr. 16, November 2020, S. 1649–1676, doi:10.1007/s40265-020-01379-9, PMID 32860583, PMC 7572875 (freier Volltext) – (englisch).
- Goedele N. Maertens, Alan N. Engelman, Peter Cherepanov: Structure and function of retroviral integrase. In: Nature Reviews. Microbiology. Band 20, Nr. 1, Januar 2022, S. 20–34, doi:10.1038/s41579-021-00586-9, PMID 34244677, PMC 8671357 (freier Volltext) – (englisch).
- Christian Hoffmann: Substanzklassen, Medikamentenübersicht. In: Jürgen Rockstroh, Christian Hoffmann (Hrsg.): HIV 2022/2023. Medizin Fokus Verlag, Hamburg 2022, ISBN 978-3-941727-28-1, S. 80–88 (hivbuch.de [PDF]).
- John D. Loaiza et al.: Integrase inhibitors: current protagonists in antiretroviral therapy. In: Immunotherapy. Band 15, Nr. 17, Dezember 2023, S. 1477–1495, doi:10.2217/imt-2023-0011, PMID 37822251 (englisch).
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c d e f g Goedele N. Maertens et al.: Structure and function of retroviral integrase. In: Nature Reviews. Microbiology. Band 20, Nr. 1, Januar 2022, S. 20–34, doi:10.1038/s41579-021-00586-9, PMID 34244677, PMC 8671357 (freier Volltext) – (englisch).
- ↑ Andrea Savarino: A historical sketch of the discovery and development of HIV-1 integrase inhibitors. In: Expert Opinion on Investigational Drugs. Band 15, Nr. 12, Dezember 2006, S. 1507–1522, doi:10.1517/13543784.15.12.1507, PMID 17107277 (englisch).
- ↑ a b c Christian Hoffmann: Substanzklassen, Medikamentenübersicht. In: Jürgen Rockstroh, Christian Hoffmann (Hrsg.): HIV 2022/2023. Medizin Fokus Verlag, Hamburg 2022, ISBN 978-3-941727-28-1, S. 80–88 (hivbuch.de [PDF]).
- ↑ The use of stems in the selection of International Nonproprietary Names (INN) for pharmaceutical substances. (PDF) In: WHO. 2018, S. 191, abgerufen am 7. Juni 2023 (englisch).
- ↑ a b c d e Kimberly K. Scarsi et al.: HIV-1 Integrase Inhibitors: A Comparative Review of Efficacy and Safety. In: Drugs. Band 80, Nr. 16, November 2020, S. 1649–1676, doi:10.1007/s40265-020-01379-9, PMID 32860583, PMC 7572875 (freier Volltext) – (englisch).
- ↑ Sophia M. Rein et al.: Integrase strand-transfer inhibitor use and cardiovascular events in adults with HIV: an emulation of target trials in the HIV-CAUSAL Collaboration and the Antiretroviral Therapy Cohort Collaboration. In: The Lancet HIV. Band 10, Nr. 11, November 2023, S. e723–e732, doi:10.1016/S2352-3018(23)00233-3, PMID 37923486 (englisch).