Quecksilber(II)-sulfat
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
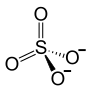
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Quecksilber(II)-sulfat | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | HgSO4 | |||||||||||||||
| Kurzbeschreibung |
weißer Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 296,68 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||
| Dichte |
6,47 g·cm−3[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit |
Zersetzung in Wasser[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| MAK |
0,1 mg·m−3[1] | |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Quecksilber(II)-sulfat ist eine chemische Verbindung des Schwermetalls Quecksilber mit der Summenformel HgSO4. Beim Erhitzen auf etwa 450 °C oder Einwirkung von energiereichem Licht zersetzt sich der Stoff und bildet elementares Quecksilber und Schwefeloxide. Wie die Verbindung selbst sind diese äußerst giftig und sollten deshalb nicht eingeatmet werden.
Gewinnung und Darstellung[Bearbeiten | Quelltext bearbeiten]
Quecksilber(II)-sulfat kann aus Quecksilber und konzentrierter Schwefelsäure hergestellt werden.[3]
Es kann nur aus schwefelsaurer Lösung auskristallisiert werden, da sich in wässriger Lösung schwerlösliches basisches Quecksilbersulfat HgSO4·2 HgO bildet. Dieses ist ein hellgelbes Pulver, das sich an Licht zersetzt und früher in der Pharmazie eingesetzt wurde.
In wenig Wasser bzw. in einer leicht mit Schwefelsäure angesäuerten Lösung bildet es ein Monohydrat aus HgSO4·H2O.[4]
Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Quecksilber(II)-sulfat ist ein weißes, nicht brennbares Pulver. Bei seiner Zersetzungstemperatur von 450 °C erglüht es und zerfällt in Quecksilber, Schwefeldioxid und zu einem geringen Teil auch in Schwefeltrioxid. Mit Alkalisulfaten bildet es Doppel- oder Komplexsalze aus, z. B.: K2SO4·3 HgSO4·2 H2O.[4] Es kristallisiert in einer orthorhombischen Struktur mit der Raumgruppe Pn21m (Raumgruppen-Nr. 31, Stellung 5) und den Gitterparametern a = 4,778 Å, b = 4,812 Å und c = 6,572 Å.[5]
Verwendung[Bearbeiten | Quelltext bearbeiten]
Quecksilber(II)-sulfat wird als Katalysator bei der Produktion von Acetaldehyd aus Ethin und Wasser verwendet. Dabei entsteht Methylquecksilber als Nebenprodukt.
In wässriger Lösung wird es als Denigés-Reagenz (benannt nach dem französischen Biochemiker Georges Denigés) zum Nachweis von Isoolefinen und tertiären Alkoholen verwendet, die in Gegenwart von Säure leicht zu Isoolefinen dehydratisiert werden können. Ein positiver Nachweis wird durch einen festen gelben oder roten Niederschlag angezeigt.[6][7]
Sicherheitshinweise[Bearbeiten | Quelltext bearbeiten]
Quecksilber(II)-sulfat ist sowohl für Tiere, als auch für den Menschen ein giftiger Stoff. Quecksilbersulfat ist ein Umweltgift und darf nicht auf normalem Wege entsorgt werden, da es besonders für Gewässer und deren Bewohner eine Bedrohung darstellt.
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c d e f g h Eintrag zu Quecksilber(II)-sulfat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- ↑ Nicht explizit in Verordnung (EG) Nr. 1272/2008 (CLP) gelistet, fällt aber mit der angegebenen Kennzeichnung unter den Gruppeneintrag inorganic compounds of mercury with the exception of mercuric sulphide and those specified elsewhere in this Annex im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Erwin Riedel; Anorganische Chemie, S. 750
- ↑ a b Heinrich Remy: Lehrbuch der Anorganischen Chemie Band II, Seite 640–641, Leipzig 1973, Akademische Verlagsgesellschaft Geest & Portig K.-G.
- ↑ K. Aurivillius, C. Stålhandske: Reinvestigation of the crystal structures of HgSO4 and CdSO4. In: Zeitschrift für Kristallographie, 153, 1980, S. 121–129, doi:10.1524/zkri.1980.153.14.121.
- ↑ Katsuhiko Ichikawa, Koichi Fujita, Osamu Itoh: Relation between Denigés Reaction and Oxymercuration. In: Bulletin of the Institute for Chemical Research, Kyoto University. Band 42, Nr. 4, 25. August 1964, hdl:2433/76026, S. 221–226.
- ↑ E. M. Marks, D. Lipkin: Reaction of Aliphatic Ethers With Denigès' Reagent. In: The Journal of Organic Chemistry. Band 3, Nr. 6, 1939, S. 598–602, doi:10.1021/jo01223a008.




