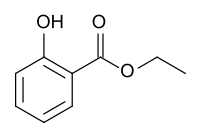
Salicylsäureethylester
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||
| Allgemeines | ||||||||||
| Name | Salicylsäureethylester | |||||||||
| Andere Namen |
Ethylsalicylat | |||||||||
| Summenformel | C9H10O3 | |||||||||
| Kurzbeschreibung |
farblose Flüssigkeit[1] mit minzeartigem Geruch | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 166,18 g·mol−1 | |||||||||
| Aggregatzustand |
flüssig | |||||||||
| Dichte |
1,13 g·cm−3[1] | |||||||||
| Schmelzpunkt | ||||||||||
| Siedepunkt |
232 °C[1] | |||||||||
| Dampfdruck | ||||||||||
| Löslichkeit |
| |||||||||
| Brechungsindex |
1,5296 (20 °C)[3] | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||
Salicylsäureethylester oder auch Ethylsalicylat ist der Ethylester der Salicylsäure. Es ist eine farblose Flüssigkeit, die nur schwer in Wasser löslich ist.
Darstellung
Salicylsäureethylester kann durch Veresterung von Salicylsäure mit Ethanol in Anwesenheit von Schwefelsäure[5] oder Salzsäure.[6] als Katalysator hergestellt werden.
Eigenschaften
Salicylsäureethylester ist eine klare, stark lichtbrechende Flüssigkeit mit angenehmem, minzeartigem[7] Geruch. Der Ester ist sehr gut in Ethanol und Diethylether, schlecht in Wasser löslich. Beim Stehen an der Luft färbt sich die Flüssigkeit gelblich bis braun. Alkalien sowie Eisen führen ebenfalls zur Zersetzung.[2]
Anwendung
Salicylsäureethylester wird in der Medizin als Arzneistoff vorwiegend in Cremes, Salben und Linimenten zur topischen Anwendung bei Muskel-, Gelenk- und Gliederschmerzen eingesetzt. Weiterhin dient ein mit Calciumhydroxid gebildetes Chelat als antibakterielles Mittel in der Zahnmedizin. Aufgrund des angenehmen Geruchs findet der Ester auch Verwendung als Geruchskomponente in Kosmetika und Parfums.[2]
Einzelnachweise
- ↑ a b c d e f g Eintrag zu Ethylsalicylat in der GESTIS-Stoffdatenbank des IFA (JavaScript erforderlich).
- ↑ a b c F. v. Bruchhausen, S. Ebel, A. W. Frahm, E. Hackenthal: Hagers Handbuch der Pharmazeutischen Praxis. Band 8: Stoffe E–O, Birkhäuser, 1995, ISBN 978-3-540-52688-9, S. 131.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Organic Compounds, S. 3-254.
- ↑ a b Datenblatt Ethyl salicylate bei Sigma-Aldrich (PDF). Angabe des Markenparameters in Vorlage:Sigma-Aldrich fehlerhaft bzw. nicht definiert
- ↑ Autorengemeinschaft: Organikum, 19. Auflage, Johann Ambrosius Barth, Leipzig · Berlin · Heidelberg 1993, ISBN 3-335-00343-8, S. 420.
- ↑ E. Fischer, A. Speier: "Darstellung der Ester" in Berichte der deutschen chemischen Gesellschaft 1895, 28, S. 3252ff. Volltext
- ↑ WIPO Patent Application WO/2008/012140 bei www.freepatentsonline.com

