Shono-Oxidation
Die Shono-Oxidation ist eine elektro-organische Reaktion bei der C-C-Bindungen in α-Position zu einer Amino-Gruppe durch anodische Oxidation geknüpft werden. Benannt wurde die Reaktion nach Tatsuya Shono (* 1929), der diese Reaktion 1981 erstmals beschrieb.[1]
Übersichtsreaktion[Bearbeiten | Quelltext bearbeiten]
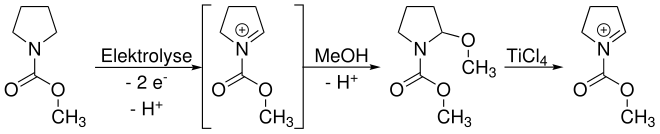
Shono beschrieb zunächst die anodische Oxidation von Carbamaten. Dabei wird Methanol sowohl als Kupplungspartner als auch als Lösungsmittel eingesetzt. Die Funktionalisierung geschieht dabei in α-Position zur Amin-Gruppe. Unter Einwirkung einer Lewis-Säure (häufig TiCl4) kann ein Methanolat-Anion (MeO-) eliminiert werden und es bildet sich ein Iminium-Kation. Durch Reaktion mit einem (Kohlenstoff-)Nucleophil (Nu-) wird eine neue Bindung geknüpft.

Mechanismus[Bearbeiten | Quelltext bearbeiten]
Prinzipiell sind zwei Reaktionswege möglich. Der in der Übersichtsreaktion gezeigte Weg zeigt ein Abfangen (trapping) eines intermediär entstehenden Iminium-Ions durch Methanol. Da eben dieses Iminium für die folgende Funktionalisierung wieder benötigt wird, muss es durch eine Lewis-Säure – hier Titan(IV)-chlorid – wieder freigesetzt werden. Das trapping ist hier nötig, da die meisten Nucleophile, die zur Funktionalisierung eingesetzt werden, unter den üblichen elektrolytischen Bedingungen nicht stabil sind.
Das trapping kann umgangen werden, indem bei tiefen Temperaturen elektrolysiert wird. In nicht-nucleophilen Lösungsmitteln ist das Iminium ausreichend stabil, um nach abgeschlossener Elektrolyse direkt mit einem Nucleophil umgesetzt zu werden.[2]
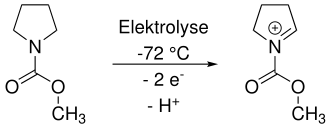
Das Herstellen und anschließende Umsetzen von Iminium-Ionen, aber auch anderen organischen Kationen wird als Kationen-Pool-Methode bezeichnet.[3]
Anwendung[Bearbeiten | Quelltext bearbeiten]
Die Shono-Oxidation kann in der Synthese von einigen bioaktiven Stoffen, wie zum Beispiel (+)-Myrtin, Iminozuckern, Ropivacain oder chiralen, cyclischen Aminosäuren, eingesetzt werden.[4]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ Tatsuya Shono, Yoshihiro Matsumura, Kenji Tsubata: Electroorganic chemistry. 46. A new carbon-carbon bond forming reaction at the α-position of amines utilizing anodic oxidation as a key step. In: Journal of the American Chemical Society. Band 103, Nr. 5, März 1981, S. 1172–1176, doi:10.1021/ja00395a029.
- ↑ Seiji Suga, Masayuki Okajima, Jun-ichi Yoshida: Reaction of an electrogenerated ‘iminium cation pool’ with organometallic reagents. Direct oxidative α-alkylation and -arylation of amine derivatives. In: Tetrahedron Letters. Band 42, Nr. 11, März 2001, S. 2173–2176, doi:10.1016/S0040-4039(01)00128-9.
- ↑ Jun‐ichi Yoshida, Seiji Suga: Basic Concepts of “Cation Pool” and “Cation Flow” Methods and Their Applications in Conventional and Combinatorial Organic Synthesis. In: Chemistry—A European Journal. Band 8, Mai 2002, S. 2650–2658, doi:10.1002/1521-3765(20020617)8:12<2650::AID-CHEM2650>3.0.CO;2-S.
- ↑ Alan M Jones, Craig E Banks: The Shono-type electroorganic oxidation of unfunctionalised amides. Carbon–carbon bond formation via electrogenerated N -acyliminium ions. In: Beilstein Journal of Organic Chemistry. Band 10, 18. Dezember 2014, ISSN 1860-5397, S. 3056–3072, doi:10.3762/bjoc.10.323.