Terpene

Terpene [] sind eine große und heterogene Gruppe chemischer Verbindungen mit einer Vielfalt an Kohlenstoffgerüsten, deren gemeinsames Merkmal darin besteht, dass sich ihr Grundgerüst auf Isopren-Einheiten zurückführen lässt. Die Terpene im engen Sinn sind reine Kohlenwasserstoffe, von denen viele natürlich in Organismen vorkommen,[1] oft als sekundäre Pflanzenstoffe.
Im weiteren Sinn werden auch die verwandten Terpenoide dazu gezählt, deren Grundgerüst sich ebenfalls von Isopren-Einheiten ableiten lässt. Im Unterschied zu den Terpenen sind sie durch zusätzliche funktionelle Gruppen gekennzeichnet, können aber auch in ihrem Kohlenstoffgerüst Unterschiede aufweisen. Terpenoide kommen in der Natur vorwiegend als Vertreter der Alkohole, Ether, Aldehyde, Ketone, Carbonsäuren, Carbonsäureester und Glycoside vor. Ätherische Öle, die aus Pflanzen gewonnen werden, bestehen zum Großteil aus Terpenen bzw. Terpenoiden. Sie spielen für die Pflanze eine wichtige Rolle bei der Modulation zellulärer Funktionen und in den Wechselwirkungen pflanzlicher und tierischer Arten eines Ökosystems, indem sie beispielsweise Fressfeinde abschrecken, Bestäuber anlocken oder mutualistische Formen des Zusammenlebens fördern. Die meisten der über 8000 Terpene und über 30.000 Terpenoide kommen als Naturstoffe vor.[2]
Die biologischen Funktionen von Terpenen sind bisher nur begrenzt erforscht worden. Eine bekannte Einsatzmöglichkeit ist z. B. die Wirkung der Teilgruppe der Pheromone als Lockmittel für Insektenfallen. Weiter wirken viele Terpene antimikrobiell. Die Wirkung zur Behandlung von Viren ist noch Gegenstand der Forschung[3][4][5] Zahlreiche Terpene bzw. Terpenoide werden als Geruchs- oder Geschmacksstoffe in Parfüms und kosmetischen Produkten eingesetzt,[6] daneben aber auch zur Vergällung.[7]
Für die vielfältigen Strukturvarianten sind verschiedene Klassifikationen möglich. Die IUPAC etwa zählt nur Kohlenwasserstoffe zu den Terpenen, wogegen alle sauerstoffhaltigen Isoprenabkömmlinge als Terpenoide gelten.[8] In der Praxis haben sich Trivialnamen für die Kohlenstoffgerüste eingebürgert, die sich häufig am wissenschaftlichen Namen jenes Organismus orientieren, aus dem diese erstmals isoliert wurden.
Geschichte
[Bearbeiten | Quelltext bearbeiten]
Die Terpene wurden nach einem Vorschlag des französischen Chemikers Marcelin Berthelot von August Kekulé nach dem Baumharz Terpentin benannt,[9] das neben Harzsäuren auch Kohlenwasserstoffe enthält. Ursprünglich wurden nur diese als Terpene bezeichnet; der Begriff wurde später erweitert und genauer spezifiziert. Wichtigste Forscher auf dem Gebiet der Terpene waren neben anderen vor allem Otto Wallach[10] und Leopold Ružička.[11] Beide Wissenschaftler wurden für ihre Leistungen zur Erforschung der Terpene mit dem Nobelpreis für Chemie (O. Wallach 1910[12] und L. Ruzicka 1939[13]) gewürdigt.
Zu den Anfangszeiten der Naturstoffisolierungen, im 19. Jahrhundert, war die Aufklärung von chemischen Strukturen sehr aufwändig,[14] was dazu führte, dass viele chemisch identische Terpene verschiedene Namen erhielten, die sich weitgehend von ihrer biologischen Herkunft ableiteten. Erst Otto Wallach zeigte 1884, dass viele dieser Verbindungen tatsächlich identisch waren. Im Jahr 1892 konnte Wallach die ersten neun Terpene eindeutig beschreiben und hat im Jahr 1914 seine Erkenntnisse in dem Buch Terpene und Campher veröffentlicht.[15] Er erkannte, dass die Terpene auf Isopreneinheiten aufbauen. Ein weiterer Pionier auf dem Gebiet der Strukturaufklärung der Terpene war Adolf von Baeyer.[16] Trotz der Forschungsarbeit waren lange Zeit nur sehr wenige niedere Terpene eindeutig identifiziert. So konnte erst 1910 die erste korrekte Formel eines Sesquiterpens, des Santalens, durch Friedrich Wilhelm Semmler ermittelt werden.[17]
Die Biogenetische Isoprenregel wurde 1887 von Otto Wallach aufgestellt und 1922 von Leopold Ružička unter diesem Namen formuliert.[11] Die Biosynthese der Terpene wurde schließlich von Feodor Lynen und Konrad Bloch im Jahr 1964 geklärt. Beide Wissenschaftler wurden mit dem Nobelpreis für Physiologie oder Medizin geehrt.[18][19]
Biosynthese
[Bearbeiten | Quelltext bearbeiten]Den Terpenen ist gemeinsam, dass sie sich auf ein Gerüst zurückführen lassen, dessen Grundeinheit einfach oder mehrfach der ungesättigte Kohlenwasserstoff Isopren ist. Ein zentraler Baustein in der Biosynthese von Terpenen ist das Dimethylallylpyrophosphat (DMAPP) und sein Doppelbindungsisomer Isopentenylpyrophosphat (IPP). Beide Bausteine enthalten fünf Kohlenstoff-Atome und eine Doppelbindung und können als aktiviertes Isopren aufgefasst werden. Der von F. Lynen und K. Bloch vorgestellte Biosyntheseweg[18] geht von Acetyl-CoA als ursprünglichen Baustein aus, welches zur Mevalonsäure umgesetzt wird. Aus der Mevalonsäure werden dann die Bausteine DMAPP und IPP synthetisiert.[1] Ein erst in jüngerer Zeit gefundener alternativer Biosyntheseweg, der sogenannte MEP (2C-Methyl-D-erythritol-4P)-pathway geht von einem Zucker-Derivat als C-5-Baustein aus. Dieser Weg wurde jedoch bisher nur in einigen Mikroorganismen, in grünen Algen und Pflanzen beobachtet. Beide Wege finden unabhängig voneinander statt.[20] Der Mevalonatbiosyntheseweg ist im Cytosol lokalisiert und der MEP-Biosyntheseweg in den Plastiden (Chloroplast, Leukoplast etc.). Der Austausch zwischen Substraten der beiden Stoffwechselwege ist minimal. Alle Mono- und Diterpene werden in den Plastiden synthetisiert und alle Sesquiterpene im Cytosol.
Die weitere Synthese beginnt mit DMAPP und IPP, den Endprodukten des Mevalonatwegs:
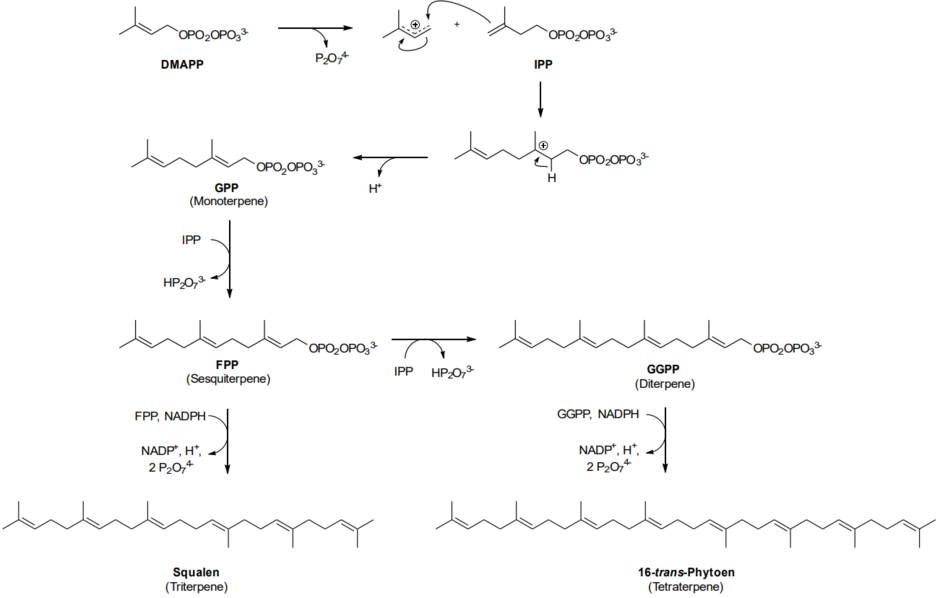
Die Farnesylpyrophosphatsynthase verknüpft ein Molekül DMAPP und zwei Moleküle IPP zum Farnesylpyrophosphat (FPP), das das Grundgerüst der cytosolischen Sesquiterpene ist. Aus zwei Einheiten Farnesylphosphat entsteht das Squalen (Squalensynthase), das Grundgerüst der Triterpene. Die plastidäre Geranylgeranylpyrophosphatsynthase verknüpft ein Molekül DMAPP mit drei Molekülen IPP zum Geranylgeranylpyrophosphat (GGPP), dem Grundgerüst der Diterpene. GGPP kann wiederum zum 16-trans-Phytoen reagieren, dem Grundgerüst der Tetraterpene. Jedes Terpen wird so über die Biosynthese dargestellt, indem die Schlüsselenzyme in der Terpenbiosynthese, die Terpensynthasen, diese Grundgerüste in die jeweiligen Terpene umwandeln.[21]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Die meisten Terpene sind in Wasser schwer löslich, lösen sich aber gut in unpolaren Lösungsmitteln wie Chloroform oder Diethylether. Bei Bedarf können sie aber mit Lösungsvermittlern oder in Form von Liposomen[22][23] auch in wässrige Lösung gebracht werden.
Besonders Mono-, Sesqui- und begrenzt Diterpene sind wasserdampfflüchtig, was bei ihrer Gewinnung aus Pflanzen durch Wasserdampfdestillation ausgenutzt wird.
Terpene haben reizendes (Haut, Atemwege) und allergisierendes Potential.[24]
Analytik
[Bearbeiten | Quelltext bearbeiten]Für die Strukturaufklärung der Terpene finden alle spektroskopischen und spektrometrischen Methoden wie NMR-Spektroskopie (ein- und mehrdimensional) und Massenspektrometrie Anwendung. Es wurden schon Terpen-Strukturen mit Hilfe der Kristallstrukturanalyse aufgeklärt und korrigiert.[25]
Zur Analytik von bekannten Terpenen wird die Gaschromatographie genutzt,[26] häufig in Kopplung mit einem Massenspektrometer. Hier können die Terpene zum einen über ihre Retentionszeiten und dem charakteristischen Fragmentierungsmuster im Massenspektrum im Vergleich mit einer bekannten Referenz identifiziert werden.
Gewinnung
[Bearbeiten | Quelltext bearbeiten]
Terpene, vor allem Mono-, Sesqui- und Diterpene, können aus Pflanzen(teilen) oder ätherischen Ölen durch physikalische Methoden wie Wasserdampfdestillation,[27] Extraktion oder Chromatographie gewonnen werden.[28] Dabei liefern die jugendlichen Pflanzen typischerweise die Terpen-Kohlenwasserstoffe und die älteren Pflanzen zunehmend die sauerstoffhaltigen Derivate, wie Alkohole, Aldehyde und Ketone.
Es gibt chemische Methoden zur großtechnischen Synthese von Terpenen, die meist sehr spezifisch sind.[29][30]
Klassifizierung
[Bearbeiten | Quelltext bearbeiten]
Die Terpene gehören in der Systematik der organischen Chemie zu den Lipiden. Der gemeinsame Baustein aller Terpene ist das Isopren. Daher lassen sich Terpene nach den sie aufbauenden Isopren-Einheiten unterteilen. Eine vollständige Isopren-Einheit umfasst jeweils 5 Kohlenstoffatome (C5-Regel). Generell wird zwischen acyclischen, mono-, bi-, tri-, tetra-, penta- bzw. polycyclischen Terpenen unterschieden, also Molekülen ohne, mit einem, mit zwei, drei, vier, fünf bzw. vielen Ringen. Weiterhin unterscheiden sich die Terpene durch das Kohlenstoffgerüst, auf dem sie aufbauen. Außerdem werden sie über ihre sekundäre Stoffgruppenzugehörigkeit klassifiziert.
Terpene mit 5 Kohlenstoffatomen werden Hemiterpene genannt (C5), Terpene mit 10 Monoterpene (C10), mit 15 Sesquiterpene (C15), mit 20 Diterpene (C20), mit 25 Sesterterpene (C25), mit 30 Triterpene (C30), mit 40 Tetraterpene (C40). Terpene mit mehr als 8 Isopreneinheiten, also mit mehr als 40 Kohlenstoffatomen, werden auch Polyterpene genannt (größer als C40). Die Namen kommen von griechischen bzw. lateinischen Zahlwörtern her (hemi ‚halb‘; mono ‚eins‘; sesqui ‚eineinhalb‘; di ‚zwei‘), wobei je eine Isopreneinheit als ein halbes Terpen gezählt wird.[1]

Unterschiede bestehen zudem darin, ob die Isopreneinheiten jeweils Kopf-Schwanz, Kopf-Kopf oder Schwanz-Schwanz verbunden sind. Bei dieser sogenannten „biogenetischen“ Unterscheidung wird jenes Ende der Isopreneinheit, das die Isopropylgruppe enthält, Kopf genannt; das unsubstituierte Ende der Isopreneinheit wird als Schwanz bezeichnet.[11]
Zu den Terpenen zählen die verwandten Terpenoide, die sich ebenfalls strukturell von verknüpften Isoprenen ableiten. Jedoch unterscheiden sie sich von den Terpenen im engen Sinn durch zusätzliche funktionelle Gruppen. Auch Abwandlungen des Kohlenstoffgerüstes kommen vor, bei denen in späteren Schritten der Biosynthese Kohlenstoffatome umgruppiert oder abgetrennt wurden. Folglich ist deren Anzahl an C-Atomen nicht mehr immer durch 5 teilbar. Dass sie dennoch zu den Terpenen gezählt werden, liegt an Gemeinsamkeiten der Biosynthese, nicht an gemeinsamen Eigenschaften. Die zahlreichen natürlich vorkommenden Terpene und Terpenoide zählen zu den sekundären Pflanzenstoffen.
Hemiterpene
[Bearbeiten | Quelltext bearbeiten]
Den Hemiterpenen liegt eine Isopreneinheit zugrunde. Es sind ungefähr zwei Dutzend Hemiterpene bekannt, die in der Natur in ungebundener Form äußerst selten vorkommen. Die wichtigsten Hemiterpene sind das Prenol sowie die Carbonsäuren Tiglinsäure, Angelicasäure, Seneciosäure und Isovaleriansäure. Sie kommen jedoch häufig als Pyrophosphate als Biosyntheseintermediat der Terpene und glycosidisch gebunden vor.[31]
Monoterpene
[Bearbeiten | Quelltext bearbeiten]

Den Monoterpenen liegen zwei Isopreneinheiten zugrunde, also ein Grundgerüst mit 10 C-Atomen. Es sind über 900 Monoterpene bekannt. Alle werden durch Monoterpensynthasen aus Geranylpyrophosphat synthetisiert; dies geschieht über eine Reihe von komplexen organisch-chemischen Reaktionen, die zu der großen strukturellen Vielfalt der Monoterpene führen.[1] Monoterpene haben für Kohlenwasserstoffe eine hohe Bioverfügbarkeit.
Tricyclische Monoterpene sind selten, ein Beispiel ist Tricyclen.
Monoterpene sind zusammen mit Sesquiterpenen Hauptbestandteile von ätherischen Ölen, die von Pflanzen in großen Mengen produziert werden. So lässt sich zum Beispiel aus einem Quadratmeter mit Nadelstreu bedecktem Waldboden bis zu ein Liter an Monoterpenen gewinnen. In den Bestandteilen von über 2.000 Pflanzen aus 60 verschiedenen Familien finden sich Monoterpene.[1]
Acyclische Monoterpene
[Bearbeiten | Quelltext bearbeiten]
Wichtige acyclische Kohlenwasserstoff-Monoterpene sind Myrcen, Ocimen und Cosmen. Alle sind Bestandteile ätherischer Öle. Linalool findet sich im Rosen- und bis zu 50 Prozent im Lavendelöl. Koriander und Palmarosaöl enthalten Geraniol und Nerol. Citronellol kann aus Citronellöl gewonnen werden, Myrcenol aus Thymianöl. Auch Lavandulol findet sich im Lavendelöl. Ipsdienol ist Duftstoff in den Blüten von Orchideenarten. Diese Verbindungen sind häufig vorkommende acyclische Monoterpen-Alkohole.
Die Terpen-Aldehyde Neral und Geranial bilden das Stereoisomerengemisch Citral, das intensiv nach Zitronen riecht und daher in Aromen verwendet wird. Citronellal wird als Insektenabwehrmittel verwendet. Eine Monoterpencarbonsäure ist die Geraniumsäure.
Als Furanoide acyclische Monoterpene sind zum Beispiel Perillen und Rosenfuran zu nennen. Rosenfuran ist eine geruchsbestimmende Komponente des Rosenöls. Perillen kommt in ätherischen Ölen vor und ist ein Abwehrpheromon.
Monocyclische Monoterpene
[Bearbeiten | Quelltext bearbeiten]
Die meisten monocyclischen Monoterpene, die sich vom p-Menthan ableiten lassen, weisen ein Cyclohexangerüst auf. Das Thioterpineol, der Stoff mit dem kleinsten bekannten Geruchsschwellenwert, lässt sich hier einordnen.[1] Doch gibt es auch solche mit Cyclopentangerüst, wie Junionon, oder mit Cyclobutangerüst wie Grandisol, ein Pheromon des Baumwollkapselkäfers, für das verschiedene Synthesewege bekannt sind,[32] auch photochemische[33] Verfahren. Zu den ein Cyclopropan-Gerüst enthaltenden Monoterpenen gehören Chrysanthemol und Chrysanthemumsäure, zu deren Estern einige Pyrethrine zählen.
Die monocyclischen Monoterpene mit Cyclohexangerüst werden meist nach ihrer sekundären Stoffgruppenzugehörigkeit unterteilt. Die wichtigsten Kohlenwasserstoffe sind hier Menthan, Limonen, Phellandren, Terpinolen, Terpinen und p-Cymol. Menthan ist im Vergleich zu den anderen Monoterpen-Kohlenwasserstoffen in der Natur eher selten. Limonen tritt sehr häufig in den verschiedensten Pflanzen auf, Terpinolen und Terpinen sind Duftstoffe und Bestandteil ätherischer Öle, Terpinolen ist ein Alarmpheromon der Termiten. Phellandren findet sich im Kümmel, Fenchel und Eukalyptusöl. p-Cymol findet sich im Einfachen Bohnenkraut.
Menthol ist Hauptbestandteil des Pfefferminzöls, es ist ein Analgetikum und wird für weitere medizinische Anwendungen verwendet. Auch Pulegol findet sich in Pfefferminzölen. Piperitol kommt in Eukalyptus- und Pfefferminzarten vor. Terpineol ist ein Duftstoff. Carveol findet sich in Zitrusölen. Thymol findet sich in den ätherischen Ölen des Thymians und Oreganos. Dihydrocarveol kommt im Kümmel, Pfeffer, Sellerie und Minze vor. Anethol findet sich im Anis und Fenchel.
Menthon und Pulegon, sowie deren Isomere, kommen wie das Menthol in Pfefferminzölen vor. Phellandral findet sich im Wasserfenchelöl. Carvon und Carvenon finden sich im Kümmel und Dill, Piperiton in Eukalyptusölen. Rosenoxid ist ein heterocyclisches Monoterpen mit Pyranring und Duftstoff des Rosenöls.
Bicyclische Monoterpene
[Bearbeiten | Quelltext bearbeiten]
1,4-Cineol und 1,8-Cineol (Eucalyptol) enthalten eine Etherbrücke, sind bicyclisch und gehören zu den Epoxy-Monoterpenen. 1,8-Cineol wirkt bakterizid und findet sich hauptsächlich in Eukalyptus und Lorbeer sowie zusammen mit dem 1,4-Cineol in Wacholder. Ascaridol ist ein Peroxid, das sich in Gänsefußarten findet.
Zu den bicyclischen Monoterpenen mit Cyclopentanring gehören Iridoide mit Cyclopentanpyrangerüst, die einen Sechs- und einen Fünfring enthaltenden. Entdeckt wurden solche Verbindungen zum ersten Mal in einer Ameisenart (Iridomyrmex) und sind somit einige der wenigen Terpene nichtpflanzlicher Herkunft. Durch Ausschleusung von Kohlenstoffmolekülen aus dem Grundgerüst entstehen Terpenoide, die nicht mehr zu den Terpenen zählen.[34] Zu den Iridoiden gehören zum Beispiel Aucubin und Catalpol aus Spitzwegerich (Plantago lanceolata) sowie Loganin aus Bitterklee. Auch in Baldrian (Valeriana officinalis) und Teufelskralle (Harpagophytum procumbens) sind Iridoide und Iridoidglycoside enthalten.

Die ebenfalls einen Sechsring enthaltenden Bicyclen von Caran, Thujan, Pinan, Bornan (veraltet auch: Camphan) und Fenchan, weiter gefasst auch Isobornylan und Isocamphan, sind die wichtige Stammverbindungen weiterer bicyclischer Monoterpene.
3-Caren findet sich in Terpentinölen (in russischem Terpentinöl, aus Pinus sylvestris, als zweithäufigste Komponente),[35] dem Öl des Schwarzen Pfeffers und kommt außerdem in Citrusölen, Tannen und Wacholder-Arten vor. Thujen[36] kommt im Koriander und Dill und außerdem neben Sabinen in Ölen vor. Thujon kommt im Wermutkraut vor, das zum Beispiel zu Absinth und Wermut verarbeitet wird. Thujanol kommt im Lebensbaum-, Wacholder- und Artemisia -Arten vor. Carbonsäuren mit Caran- beziehungsweise Carengrundgerüst, wie die Chaminsäure, kommen zum Beispiel in Scheinzypressen vor.
2-Pinen (α-Pinen) ist die Hauptkomponente der Terpentinöle, häufig findet sich auch 2(10)-Pinen (β-Pinen). Verbenol ist Bestandteil des Terpentins, es ist, zusammen mit dem in den Ölen des Rosmarins vorkommenden Verbenon ein Sexualpheromon des Borkenkäfers. Pinocarvon kommt in Eukalyptusölen vor und ist Sexualpheromonen des Kiefernspanners (Bupalus piniaria L.).
Campher ist durchblutungsfördernd, schleimlösend und hat viele weitere medizinisch-interessante Eigenschaften. Es kann aus dem Kampferbaum isoliert werden, ebenso wie Borneol. Isoborneol kommt in vielen Korbblütlern vor.
Die Fenchane, besonders Fenchon und Fenchol und deren Derivate, treten in mehreren ätherischen Ölen auf. Fenchen und seine Derivate sind selten in ätherischen Ölen.
Anethofuran ist ein bicyclisches Monoterpen mit Furankörper.
Sesquiterpene
[Bearbeiten | Quelltext bearbeiten]Den Sesquiterpenen liegen drei Isopreneinheiten zugrunde, also ein Grundgerüst mit 15 C-Atomen (und damit anderthalb – lateinisch sesqui – mal soviele wie die aus zwei Isopreneinheiten aufgebauten Monoterpene). Es gibt mehr als 3.000 Sesquiterpene, die damit die größte Untergruppe der Terpene darstellen. Sie leiten sich vom Farnesylpyrophosphat ab. Rund zwanzig der zahlreichen Sesquiterpene sind als Riech- und Aromastoffe von wirtschaftlicher Bedeutung.
Acyclische
[Bearbeiten | Quelltext bearbeiten]Farnesylpyrophosphat, die Stammverbindung der Sesquiterpene, kommt zum Beispiel in Ölschiefer vor, Farnesol im Rosen- und Jasminöl. Nerolidol findet sich in Orangenblüten, Sinensal im Orangenöl. Furanoide acyclische Sesquiterpene sind Dendrolasin, Sesquirosenfuran und Longifolin. Dendrolasin ist nicht nur pflanzlicher Herkunft, es kommt auch in Ameisen vor (der Name stammt von der Ameisengattung Dendrolasius). Die Abscisinsäure reguliert das Wachstum von Pflanzen; sie wird nicht direkt von Farnesylpyrophosphat aus synthetisiert, sondern über den Umweg des Carotinoid-Stoffwechsels (siehe Tetraterpene).
Monocyclische
[Bearbeiten | Quelltext bearbeiten]
Die monocyclischen Sesquiterpene werden hauptsächlich in die Stammverbindungen Bisabolane, Germacrane, Elemane und Humulane unterteilt.
Über 100 Bisabolane kommen natürlich in Pflanzen vor. Zingiberen kommt im Ingweröl vor. β-Bisabolen findet sich in Scheinzypressen und Kiefernarten, das entzündungshemmende Bisabolol im Öl der Kamille. Sesquisabinen kommt im Schwarzen Pfeffer, Sesquithujen im Ingwer vor. Die vom Germacran abgeleiteten Periplanone sind Sexualpheromone. Bicycloelemen und Elemol leiten sich vom Eleman ab, Elemol findet sich im Citronellöl, Bicycloelemen im Pfefferminzöl. Viele vom Humulan abgeleitete Terpene finden sich im Öl des Hopfens.
Polycyclische
[Bearbeiten | Quelltext bearbeiten]
Die meisten der Sesquiterpene sind polycyclisch. Unter den knapp 30 Caryophyllanen ist das wichtigste das Caryophyllen, es findet sich im Kümmel, Pfeffer und Gewürznelken. Von den Eudesmanen und Furanoeudesmanen sind ungefähr 450 bekannt. Selinen findet sich im Sellerie und Cannabis, Eudesmol in Eukalyptusarten, Costol in Costuswurzelnöl. Die Santonine wirken antihelmintisch. Ein wichtiges Furanoeudesman ist das Tubipofuran. Die etwa 150 bekannten Eremophilane und Valerane finden sich vor allem in höheren Pflanzen. Nootkaton sowie 11-Eremophilen-2,9-dion sind Geschmackstoffe im Grapefruitöl. Von den Cadinanen sind ungefähr 150 bekannt, Cadinadien findet sich im Hopfenöl, Muuroladien in Terpentinsorten, Cadinen im Kubebenpfeffer und Wacholder. Die Artemisiasäure wirkt antibakteriell. Guajane und Cycloguajane gibt es über 400. Guajadien findet sich im Tolubalsam. Eine Reihe von Pseudoguajanen, wie die Ambrosiasäure findet sich in Ambrosiaarten. Viele der Himachalane finden sich im Zedernöl. Mehrere Daucane finden sich in der Wilden Möhre (Daucus carota), nachdem diese benannt sind. Das von Marasman abgeleitete Isovelleral wirkt antibiotisch, das vom Isolactaran abgeleitete Merulidial ist ein Metabolit des Gallertfleischigen Fältlings (Phlebia tremellosa), eines Pilzes, der auf Totholz zu finden ist. Die Acorane, die 50 Chamigrane und die kleine Gruppe der Axanane sind Spiroverbindungen, die Chamigrane finden sich in Algen. Das vom Cedran abgeleitete Cedrol ist Geruchsstoff des Zedernöls. Hirsutane sind häufig Metaboliten von Pilzen, ein Beispiel ist die Hirsutumsäure. Das tricyclische Spathulenol findet sich im Beifuß (Artemisia vulgaris), Estragon (Artemisia dracunculus), der Echten Kamille und anderen Artemisiien,[37] in Baumwolle-Arten (Gossypium),[38] Hypericum perforatum[39] sowie in verschiedenen Nepeta-Arten.[40]
Es gibt einige Gruppen polycyclischer Sesquiterpene, die nicht vom Farnesan abstammen.
Diterpene
[Bearbeiten | Quelltext bearbeiten]
Den Diterpenen liegen vier Isopreneinheiten zugrunde, also ein Grundgerüst mit 20 C-Atomen Es gibt rund 5000 bekannte Diterpene, alle Diterpene leiten sich von der Ausgangsverbindung (E,E,E)-Geranylgeranylpyrophosphat ab.
Acyclische
[Bearbeiten | Quelltext bearbeiten]Phytan findet sich zum Beispiel zusammen mit der Phytansäure im Ölschiefer oder auch in der menschlichen Leber. Chlorophyll ist ein Ester des Phytols.
Cyclophytane bis Tetracyclophytane
[Bearbeiten | Quelltext bearbeiten]
Die meisten Cyclophytane leiten sich vom 10,15-Cyclophytan ab, 1,6-Cyclophytane sind seltener.[41]
Retinal, Retinol, Axerophthen und Tretinoin sind Vertreter der Vitamin-A-Reihe, Retinal ist mit dem Opsin in der Netzhaut des Auges zum Rhodopsin gebunden und dort für den Sehvorgang wichtig. Die aus Retinal gebildeten Retinsäuren üben Einfluss auf Wachstum und die Zelldifferenzierung aus. Agelasin E und Agelasidin B wirken krampflösend und antibakteriell.

Die etwa 400 Bicyclophytane leiten sich vom Labdan ab, seltener vom 1,6-Cyclophytan abgeleiteten Haliman oder Clerodan. Pumiloxid und Abienol finden sich in Fichten. Labdanolsäure und Oxocativinsäure finden sich in Kieferngewächsen, Sclareol in Salbeiarten, die Pinifolsäure in den Nadeln von Kieferngewächsen.
Wichtige Stammverbindungen der Tricyclophytane sind die Primarane, Cassane, Cleistanthane und Abietan. Die Primarane, wie Podocarpinol, Podocarpinsäure und Nimbiol, finden sich hauptsächlich in europäischen Kiefern. Von den Cassanen, hauptsächlich von der Cassainsäure, leiten sich Ester-Alkaloide ab. Cleistanthane sind zum Beispiel Auricularsäure und Cleistanol. Abietane finden sich hauptsächlich in Nadelbäumen, wie die Harzsäure Abietinsäure, Abietenol oder Palustrinsäure.


Das vom tricyclische Diterpenoid Baccatin III abgeleitete Terpen-Alkaloid Paclitaxel aus der Pazifischen Eibe wird auf Grund seiner Mitose hemmenden Wirkung als Zytostatikum in der Krebstherapie eingesetzt. Das ebenfalls tricyclische Forskolin wird in der Biochemie als Aktivator der Adenylylcyclase eingesetzt.
Die Tetracyclophytane werden in mehrere Stammgruppen unterteilt. Ein Kauran, 1,7,14-Trihydroxy-16-kauren-15-on, wirkt tumorhemmend. Die Atisane, wie das Atisen, lassen sich in bestimmte Alkaloide umwandeln. Von den Gibberellanen abgeleitete Terpenoide wie Gibberellinsäure beeinflussen als Phytohormone das Pflanzenwachstum. Die Grayanotoxane, wie das Leucothol C sind häufig toxisch und finden sich in vielen Blättern.
Sesterterpene
[Bearbeiten | Quelltext bearbeiten]
Den Sesterterpenen liegen fünf Isopreneinheiten zugrunde, also ein Grundgerüst mit 25 C-Atomen. Sesterterpene wurden erstmals 1965 aus Insektenwachs und niederen Pilzen isoliert. Es gibt ungefähr 150 bekannte Sesterterpene, davon haben 30 einen Furan-Körper, sie leiten sich von 3,7,11,15,19-Pentamethylicosan ab. Sesterterpene sind in der Natur eher selten, sie finden sich hauptsächlich in niederen Pflanzen, Pilzen oder in den Blättern der Kartoffel. Sesterterpene mit Furankörper können aus Schwämmen, wie der Art Ircinia campana, isoliert werden.
Die wichtigsten acyclischen Sesterterpene sind das 3,7,11,15,19-Pentamethyl-2,6-icosadien-1-ol, Ircinin I und 8,9-Dehydroircinin I. Das Ircin I hat eine antibakterielle Wirkung und findet sich zum Beispiel in dem Schwamm Ircinia oros, das 8,9-Dehydroircinin I in Cacospongia scalaris. Die monocyclischen Sesterterpene finden sich in Schwämmen und Wachsen von Insekten von Ceroplastes ceriferus. Zu nennen ist das Cyclohexan-Sesterterpen, Neomanoalid, welches antibakteriell wirkt, Cericeran und Cerifeol 1. Bicyclische Sesterpene sind zum Beispiel Dysideapalaunsäure, Salvisyriacolid und Salvisyriacolidmethylester. Das tricyclische Sesterterpen Cheilanthatriol findet sich in Farnen. Die tetracyclischen Sesterterpene finden sich in Schwämmen und bauen hauptsächlich auf dem Scalaran auf.
Triterpene
[Bearbeiten | Quelltext bearbeiten]
Den Triterpenen liegen sechs Isopreneinheiten zugrunde, also ein Grundgerüst mit 30 C-Atomen. Es gibt ungefähr 1700 Triterpene; sie leiten sich hauptsächlich vom Squalan ab, welches aus zwei Schwanz-Schwanz verknüpften Sesquiterpen-Einheiten besteht, sowie dem davon abgeleiteten Squalen. D-Vitamine und Gallensäuren sind oxidierte abgeleitete Triterpene, der Tetracyclus des Gonans findet sich abgeleitet bei den Steroiden. Acyclische Triterpene sind in der Natur relativ selten, vor allem tetracyclische und pentacyclische Triterpene sind in der Natur verbreitet.
Tetracyclische
[Bearbeiten | Quelltext bearbeiten] |
 |
Die tetracyclischen Triterpene besitzen das Gonangerüst als chemisches Grundgerüst, das auch in den Steroiden zu finden ist, Stammverbindungen sind die Protostane und Fusidane, Dammarane, Apotirucallane, Tirucallane und Euphane, Lanostane, Cycloartane und Cucurbitane. Einige von den Fusidanen abgeleiteten Terpenoide, wie die Fusidinsäure greifen selektiv in den bakteriellen Stoffwechsel ein und werden daher als Antibiotika eingesetzt. Ein wichtiges Apotirucallan ist das Melianin A. Es gibt ungefähr 200 Lanostane, ein Beispiel ist das Lanosterol. Von den Cycloartanen gibt es rund 120, die Ananassäure findet sich in Ananasholz. Von den Cucurbitanen gibt es nur circa 40 natürliche, die Cucurbitacine F und B werden als Chemotherapeutikum in der Krebstherapie erprobt.
Pentacyclische
[Bearbeiten | Quelltext bearbeiten]

Eine der Grundstrukturen der pentacyclischen Triterpene ist das Hopan (siehe Hopanoide). Die Fernáne, Adianane und Filicane finden sich in Farnen, wie einige Gammacerane. Zu den Adiananen und Filicanen gehört das Simiarenol und Filicenal, das im Frauenhaarfarn vorkommt, ein Gammaceran ist das Ketohakonanol. Es existieren mehrere auf andere Art entstandene pentacyclische Triterpene wie die Stictane, Serratane und Iridale. Stictane finden sich in der Baumrinde vieler Bäume, das Serratan 14-Serraten findet sich in europäischen Waldfarnen. Ein Iridal ist das Ambrein aus der Ambra des Pottwals. Die meisten Iridale finden sich jedoch hauptsächlich in Schwertlilien. Betulin und Betulinsäure (die HIV hemmt) finden sich in der Rinde von Birken.
Tetraterpene
[Bearbeiten | Quelltext bearbeiten]Den Tetraterpenen liegen acht Isopreneinheiten zugrunde, also ein Grundgerüst mit 40 C-Atomen. Zu den natürlich vorkommenden Tetraterpenen gehören die meisten der als fettlösliche Pigmente (Lipochrome) in Archaeen, Bakterien, Pflanzen und Tieren weit verbreiteten Carotinoide. Hierzu zählen die verschiedenen Carotine, reine Kohlenwasserstoffe wie das Lycopin mit der Summenformel C40H56, und auch deren sauerstoffhaltigen Derivate, die Xanthophylle. Einige davon abgewandelte Verbindungen mit verlängertem oder verkürztem Kohlenstoffgerüst, etwa Apocarotinoide oder Diapocarotinoide wie das Crocetin, werden ebenfalls als Carotinoide bezeichnet, stellen jedoch keine Tetraterpenoide dar.
Polyterpene
[Bearbeiten | Quelltext bearbeiten]
Polyterpene bestehen aus mehr als acht Isopreneinheiten; Leopold Ružička nannte diese Polyisoprene Polyprene.
cis-Polyisopren liegt im Naturkautschuk vor, der kommerziell aus dem Latex des Kautschukbaums und aus dem der Guayule-Pflanze gewonnen wird. Es ist daneben im Latex vieler anderer Pflanzenarten enthalten,[42] z. B. im Russischen Löwenzahn und im Gummibaum.[43][44]
trans-Polyisopren ist Hauptbestandteil des gummigen Anteils von Guttapercha und Balata sowie des „Gummis“ der Gummiulme und kommerziell weniger bedeutend. Chicle, aus dem Breiapfelbaum gewonnen, enthält ein 1:1 bis 4:1-Gemisch von trans- und cis-Polyisopren.[45]
Zu den Polyterpenen werden auch aus Isopren-Untereinheiten aufgebaute langkettige Polymere mit endständiger Hydroxygruppe gezählt, Polyprenole genannt. Im Unterschied zu bakteriellen Polyprenolen sind die eukaryotischen wie die von Archaeen an dem die funktionelle OH-Gruppe tragenden Isoprenoid α-ungesättigt. Hierzu gehören beispielsweise pflanzliche Betulaprenole und beim Menschen Dolichol, das u. a. als Lipidkomponente im Neuromelanin der Substantia nigra vorkommt.[46]
Prenylchinone sind Terpenoide mit bis zu zehn Isopreneinheiten, unter ihnen finden sich Vitamin K1 und K2, Vitamin E, Plastochinon sowie die Ubichinone.
Literatur
[Bearbeiten | Quelltext bearbeiten]- Eberhard Breitmaier: Terpene. Teubner Verlag, Januar 1999, ISBN 3-519-03548-0.
- Lutz Roth: Terpene, Terpentinöl. Ecomed Verlag, Landsberg, Juni 2001, ISBN 3-609-69140-9.
- Gerhard Habermehl, Peter E. Hammann, Hans C. Krebs, Naturstoffchemie. 2. Auflage, Springer Verlag, 2002, ISBN 3-540-43952-8.
- Peter Nuhn: Naturstoffchemie. Mikrobielle, pflanzliche und tierische Naturstoffe. 2. Auflage, S. Hirzel Wissenschaftliche Verlagsgesellschaft Stuttgart, 1990, ISBN 3-7776-0473-9.
- J. D. Conolly, R. A. Hill: Dictionary of Terpenoids. Chapman & Hall, London, New York, Tokyo, Melbourne, Madras 1991.
Siehe auch
[Bearbeiten | Quelltext bearbeiten]Weblinks
[Bearbeiten | Quelltext bearbeiten]Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e f E. Breitmaier: Terpene – Aromen, Düfte, Pharmaka, Pheromone, 1. Auflage, B. G. Teubner, Stuttgart, Leipzig 1999, ISBN 3-519-03548-0.
- ↑ Peter Nuhn: Naturstoffchemie: Mikrobielle, pflanzliche und tierische Naturstoffe, 4., neu bearb. Auflage, Hirzel S. Verlag, Stuttgart, ISBN 3-7776-1363-0.
- ↑ Georg Sticker: Heilwirkungen der terpenhaltigen Öle und Harze. Wien und Leipzig 1917.
- ↑ Paul Schnitzler: Essential Oils for the Treatment of Herpes Simplex Virus Infections. In: Chemotherapy. Band 64, Nr. 1, 2019, S. 1–7, doi:10.1159/000501062 (karger.com [abgerufen am 12. Juli 2021]).
- ↑ C. Koch, J. Reichling, J. Schneele, P. Schnitzler: Inhibitory effect of essential oils against herpes simplex virus type 2. In: Phytomedicine. Band 15, Nr. 1-2, Januar 2008, S. 71–78, doi:10.1016/j.phymed.2007.09.003.
- ↑ Hagers Handbuch der Pharmazeutischen Praxis – 4. Auflage.
- ↑ Cathleen Terhune Alty, BA, RDH: Do you want that mouthwash straight up or on the rocks? 12. Mai 2014, abgerufen am 12. Juli 2021.
- ↑ IUPAC-Definition für Terpene und Terpenoide.
- ↑ A. Kekulé (1863) Lehrbuch der organischen Chemie. Verlag von Ferdinand Enke, Erlangen.
- ↑ O. Wallach: Zur Kenntniss der Terpene und der ätherischen Oele. In: Justus Liebigs Annalen der Chemie. Band 227, Nr. 3, 1885, S. 277–302, doi:10.1002/jlac.18852270306.
- ↑ a b c L. Růžička: Perspektiven der Biogenese und der Chemie der Terpene. In: Pure and Applied Chemistry. Band 6, Nr. 4, 1963, S. 493–524, doi:10.1351/pac196306040493.
- ↑ O. Wallach Nobelpreisvortrag (PDF, engl.; 82 kB).
- ↑ L. Ruzicka Nobelpreisvortrag (PDF,engl.; 537 kB).
- ↑ Dissertation zur Strukturaufklärung von Cedren, G. W. Kusserow ETH Zürich 1948
- ↑ O. Wallach: Terpene und Campher : Zusammenfassung eigener Untersuchungen auf d. Gebiet d. alicyclischen Kohlenstoffverbindungen Terpene und Campher: Zusammenfassung eigener Untersuchungen auf d. Gebiet d. alicyclischen Kohlenstoffverbindungen, Veit Leipzig 1914. DNB 361835116.
- ↑ A. de Meijere: Adolf von Baeyer – Nobelpreisträger für Chemie 1905, Angew. Chem., 2008, 117, S. 8046–8050; doi:10.1002/ange.200503351.
- ↑ F. W. Semmler: Zur Kenntnis der Bestandteile ätherischer Öle. (Konstitution der α-Santalol- und α-Santalen-Reihe: Die Konstitution der Sesquiterpenalkohole und Sesquiterpene.). In: Berichte der deutschen chemischen Gesellschaft. 43, 1910, S. 1893, doi:10.1002/cber.191004302121.
- ↑ a b Nobelpreisvortrag von F. Lynen (PDF; 536 kB).
- ↑ Nobelpreisvortrag von K. Bloch (PDF; 191 kB).
- ↑ M. Rohmer: The discovery of a mevalonate-independent pathway for isoprenoid biosynthesis in bacteria, algae and higher plants, in: Nat Prod Rep., 1999, 16, S. 565–574; doi:10.1039/A709175C.
- ↑ H. Kleinig: The Role of Plastids in Isoprenoid Biosynthesis. In: Annual Review of Plant Physiology and Plant Molecular Biology. Band 40, Juni 1989, S. 39–59, doi:10.1146/annurev.pp.40.060189.000351.
- ↑ Patent EP0776202: Liposomal verkapseltes Taxol, seine Herstellung und seine Verwendung. Angemeldet am 18. August 1995, veröffentlicht am 17. Mai 2000, Anmelder: Max-Delbrück-Centrum für Molekulare Medizin, Erfinder: Martin Brandl, Iduna Fichtner, Regine Reszka, Gernot Warnke.
- ↑ Patent EP1471886: Verfahren zur Erhöhung der Wasserlöslichkeit lipophiler Wirkstoffe; Herstellung von hochkonzentrierten wässrigen Zusammensetzungen dieser Wirkstoffe; derartige Produkte und ihre Verwendung. Angemeldet am 15. Januar 2003, veröffentlicht am 15. August 2007, Anmelder: KliniPharm GmbH, Erfinder: Eva Bogdanovic, Katja Grzimek, Wolfgang Schatton.
- ↑ Umweltbundesamt: Es liegt was in der Luft - über Duftstoffe im öffentlichen und privaten Bereich, abgerufen am 3. Januar 2020.
- ↑ M. Dobler, J: D. Dunitz, B. Gubler, H. P. Weber, G. Büchi, J. Padilla O.: The Structure of Patchouli Alcohol. In: Proceedings of the Chemical Society. Nr. 12, 1963, S. 383, doi:10.1039/PS9630000357.
- ↑ E. von Rudloff: Gas-Liquid Chromatography of Terpens. In: Canadian Journal of Chemistry. 30, 1961, S. 1200–1206, doi:10.1139/v61-152.
- ↑ Beschreibung eines Schulversuchs.
- ↑ E. Stahl, W. Schild: Isolierung und Charakterisierung von Naturstoffen. Gustav Fischer Verlag, Stuttgart 1986, ISBN 3-437-30511-5.
- ↑ Patent zur großtechnischen Synthese von Menthol:
Patent EP1162186: Verfahren zur Herstellung von d,l-Menthol. Angemeldet am 30. April 2001, veröffentlicht am 12. Dezember 2001, Anmelder: Bayer AG, Erfinder: Claus Dreisbach, Michael Friederich, Hans-Jürgen Gross, Jörg-Dietrich Jentsch, Gerald John, Reinhard Langer, Thomas Prinz, Andreas Schlemenat, Andreas Schulze-Tilling. - ↑ Patent zur großtechnischen Synthese von Campher:
Patent EP0539990: Verfahren zur Herstellung von Camphen durch Umlagerung von alpha-Pinen. Angemeldet am 29. Oktober 1992, veröffentlicht am 8. Januar 1997, Anmelder: Hoechst Aktiengesellschaft, Erfinder: Eberhard Ritter, Thomas Wisser, Alfred Riedel, Manfred Gscheidmeier, Joachim Maginot. - ↑ Beispiel für die Isolierung von Hemiterpenen als Glycoside:
Søren Damtoft, Søren Rosendal Jensen: Hemialboside, a hemiterpene glucoside from Lamium album. In: Phytochemistry. Band 39, Nr. 4, Juli 1995, S. 923–924, doi:10.1016/0031-9422(95)00085-L. - ↑ T. Graham, E. Gray, J. Burgess, B. Goess: An Efficient Synthesis of (±)-Grandisol Featuring 1,5-Enyne Metathesis. In: Journal of Organic Chemistry. Band 75, Nr. 1, 2010, S. 226–228; doi:10.1021/jo9020375, PMC 2798917 (freier Volltext).
- ↑ K. Langer, J. Mattay, A. Heidbreder, M. Möller: A New Stereoselective Synthesis of Grandisol. In: European Journal of Organic Chemistry. März 1992, S. 257–260, doi:10.1002/jlac.199219920144.
- ↑ www.kliniken.de: Iridoide. ( vom 2. August 2012 im Webarchiv archive.today)
- ↑ Eintrag zu Terpentinöl. In: Römpp Online. Georg Thieme Verlag, abgerufen am 25. Mai 2014.
- ↑ L. Tschugaeff: Ueber das Thujen, ein neues bicyclisches Terpen. In: Berichte der deutschen chemischen Gesellschaft, 1900, 33, S. 3118–3126; doi:10.1002/cber.19000330363.
- ↑ Ziaei, A. et al.: Identification of spathulenol in Salvia mirzayanii and the immunomodulatory effects, in: Phytother Res, 2011, 25 (4), S. 557–562; doi:10.1002/ptr.3289; PMID 20857430.
- ↑ G. W. Elzen, H. J. Williams, S. B. Vinson: Isolation and identification of cotton synomones mediating searching behavior by parasitoid Campoletis sonorensis. In: Journal of Chemical Ecology. Band 10, Nr. 8, August 1984, S. 1251–1264, doi:10.1007/BF00988552.
- ↑ K. H. C. Baser, T. Ozek, H. R. Nuriddinov, A. B. Demirci: Essential Oils of Two Hypericum Species from Uzbekistan. In: Chemistry of Natural Compounds. Band 38, Nr. 1, Januar 2002, S. 54–57, doi:10.1023/A:1015781715535.
- ↑ K. H. C. Baser, N. Kirimer, M. Kurkcuoglu, B. Demirci: Essential Oils of Nepeta Species Growing in Turkey. In: Chemistry of Natural Compounds. Band 36, Nr. 4, Juli 2000, S. 356–359, doi:10.1023/A:1002832628159.
- ↑ Eberhard Breitmaier: Terpene: Aromen, Düfte, Pharmaka, Pheromone. 2. Auflage, WILEY-VCH Verlag GmbH & Co. KGaA, Weinheim, 2005, S. 52, doi:10.1002/9783527623693.
- ↑ Shinzo Kohjiya, Yuko Ikeda: Chemistry, Manufacture and Applications of Natural Rubber. Woodhead, 2014, ISBN 978-0-85709-683-8, S. 30–34. (eingeschränkte Vorschau in der Google-Buchsuche)
- ↑ Charles E. Carraher Jr., L. H. Sperling: Polymer Applications of Renewable-Resource Materials. Plenum Press, 1983, ISBN 978-1-4613-3505-4 (Reprint) S. 9.
- ↑ A. Behr, Th. Seidensticker: Einführung in die Chemie nachwachsender Rohstoffe. Springer, 2018, ISBN 978-3-662-55254-4, S. 234. (eingeschränkte Vorschau in der Google-Buchsuche)
- ↑ A. Steinbüchel, T. Koyama: Biopolymers. Band 2: Polyisoprenoids, Wiley, 2001, ISBN 978-3-527-30221-5, S. 11.
- ↑ H. Fedorow, R. Pickford, J. Hook, K. Double, G. Halliday, M. Gerlach, P. Riederer, B. Garner: Dolichol is the major lipid component of human substantia nigra neuromelanin. In: Journal of Neurochemistry. 92. Jahrgang, Nr. 4, Februar 2005, S. 990–995, doi:10.1111/j.1471-4159.2004.02975.x (englisch).