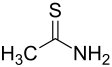
Thioacetamid
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Thioacetamid | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C2H5NS | ||||||||||||||||||
| Kurzbeschreibung |
farbloser, nach faulen Eiern riechender, kristalliner Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 75,13 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||||||||
| Dichte |
1,37 g·cm−3[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit |
leicht in Wasser (163 g·l−1)[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Thermodynamische Eigenschaften | |||||||||||||||||||
| ΔHf0 |
−71,7 kJ/mol[4] | ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Thioacetamid ist das Amid der Thioessigsäure. Es besitzt die Summenformel C2H5NS und ist strukturell eng verwandt mit Acetamid.
Verwendung[Bearbeiten | Quelltext bearbeiten]
Beim Erwärmen in wässriger Lösung zerfällt es zu Schwefelwasserstoff und Ammoniumacetat. Deshalb wird es im klassischen Kationentrennungsgang sowie in der gravimetrischen Kupferbestimmung zur In-situ-Erzeugung von Schwefelwasserstoff benutzt.
Vorteilhaft gegenüber dem direkten Einsatz von Schwefelwasserstoffgas ist die sehr bequeme Dosierung und Anwendung, der günstige Verlauf der homogenen Fällung und vor allem die Tatsache, dass kein giftiges H2S-Gas gelagert und eingesetzt werden muss.

Thioacetamid ist selbst giftig und karzinogen, aber gut zu handhaben, da es sich um einen Feststoff handelt. Im Labor ist es meist die bessere Alternative, in der Technik wird nach wie vor das wesentlich preiswertere Schwefelwasserstoffgas verwendet.
TAA spielt auch eine Rolle als profibrogene Substanz zur Erforschung der Fibrose von Organen, speziell Leberfibrose und Zirrhose. Hier wird es zur Induktion von Leberschäden in Tiermodellen eingesetzt.[5]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c d e f Eintrag zu Thioacetamid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- ↑ a b Datenblatt Thioacetamid bei Merck, abgerufen am 18. Januar 2011.
- ↑ Eintrag zu Thioacetamide im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-22.
- ↑ Pauline Heizer: Desoxyribose nuclei acid (DNA) content and size of rat liver nuclei during thioacetamide intoxication and recovery. In: Chromosoma 7: 281–327, 1955.


