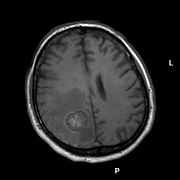
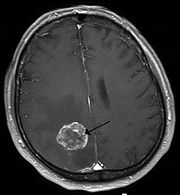
Hirnmetastase
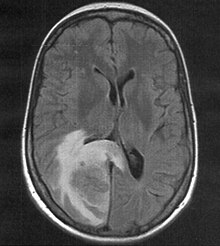
MRT mit T2-Flair-Wichtung, die zugehörige PET-Untersuchung ist weiter unten abgebildet.
| Klassifikation nach ICD-10 | |
|---|---|
| C79.3 | Sekundäre bösartige Neubildung des Gehirns und der Hirnhäute |
| ICD-10 online (WHO-Version 2019) | |
Als Hirnmetastase wird eine Absiedlung von Krebszellen (Metastasierung) in das Hirngewebe bezeichnet, die von bösartigen Tumoren außerhalb des Gehirns ausgeht. Synonym sind die Begriffe Hirnfilia (von lateinisch filia „Tochter“) oder zerebrale Metastase (lateinisch cerebralis „zum Gehirn gehörig“).
Häufige Ausgangstumore sind Lungenkrebs, Brustkrebs, Nierenzellkarzinom und bösartiges Melanom.[1] Hirnmetastasen sind die häufigsten Tumoren der im Bereich des Gehirns[2] auftretenden bösartigen Tumoren und können sich unter anderem durch Kopfschmerzen, neurologische Ausfallerscheinungen, Krampfanfälle und Wesensänderungen bemerkbar machen. Behandlung und Heilungsaussichten sind von vielen Faktoren abhängig, Hirnmetastasen sind jedoch meist ein prognostisch ungünstiger Umstand.
Systematik[Bearbeiten | Quelltext bearbeiten]
- Eine solitäre Hirnmetastase liegt vor, wenn neben dem Ausgangstumor (Primärtumor) eine einzelne Hirnmetastase besteht und keine weiteren Metastasen außerhalb des zentralen Nervensystems vorliegen.
- Bei einer singulären Hirnmetastase hingegen können neben einer einzelnen Hirnmetastase weitere Metastasen außerhalb des zentralen Nervensystems vorliegen.
- Insgesamt häufiger sind multiple, also mehrfache, Hirnmetastasen.[1]
Von den hier behandelten soliden Hirnmetastasen abzugrenzen ist die Aussaat von Tumorzellen in die Flüssigkeitsräume des zentralen Nervensystems bei der Meningeosis neoplastica sowie die seltene diffuse Infiltration des Hirngewebes durch Tumorzellen eines nicht-hirneigenen Tumors (Karzinose).
Häufigkeit[Bearbeiten | Quelltext bearbeiten]
Verlässliche epidemiologische Daten über die Häufigkeit von Hirnmetastasen im deutschsprachigen Raum liegen nicht vor. Für die Vereinigten Staaten wurde die jährliche Inzidenz auf etwa 8,3 pro 100.000 Einwohnern geschätzt. Dort machen Hirnmetastasen etwa die Hälfte aller klinisch diagnostizierten Hirntumoren aus.[3] Die Zahl der zu Lebzeiten unerkannt bleibenden Hirnmetastasen ist jedoch vermutlich höher: In einer Untersuchung aus den 1960er Jahren konnten Hirnmetastasen autoptisch bei etwa 1,6 % aller Verstorbenen und etwa 8 % aller Verstorbenen mit bösartigen Tumoren, die außerhalb des zentralen Nervensystems lagen, nachgewiesen werden.[4]
Herkunft[Bearbeiten | Quelltext bearbeiten]
Die häufigsten Primärtumoren bei Hirnmetastasen sind Lungenkrebs (54–72 %), Brustkrebs (20–34 %), malignes Melanom und Nierenzellkarzinom. Grundsätzlich kann jedoch jeder bösartige Tumor in das Gehirn metastasieren. Bei Kindern überwiegen Absiedlungen von Rhabdomyosarkomen und Keimzelltumoren.[5] Hirnmetastasen treten bei etwa 20 % aller Patienten mit Lungenkrebs, 7 % aller Patienten mit malignem Melanom, 7 % aller Patienten mit Nierenzellkarzinom, 5 % aller Patienten mit Brustkrebs und 2 % aller Patienten mit Darmkrebs auf.[6]
Lokalisation[Bearbeiten | Quelltext bearbeiten]
Hirnmetastasen sind meist im Bereich des Großhirns gelegen, können jedoch auch in Kleinhirn und Hirnstamm auftreten. Überwiegend erreichen die Tumorzellen das Gehirn mit dem Blutstrom (hämatogene Metastasierung). Die Extravasation, also das Verlassen der Gefäße, geschieht auf der arteriolären oder kapillären Ebene, weswegen die Tumoransiedlung vorzugsweise an der Grenze zwischen Hirnrinde und Marklager erfolgt. Ein Sonderfall ist die Metastasierung bösartiger Tumoren in vorbestehende gutartige Hirntumoren.[7]
Symptome[Bearbeiten | Quelltext bearbeiten]
Hirnmetastasen können sich bemerkbar machen, bevor der Primärtumor klinisch auffällig wird. So ist bei etwa einem Drittel der Patienten zum Zeitpunkt der Diagnosestellung kein Tumorleiden bekannt. In Einzelfällen bleibt der Primärtumor trotz intensiver Suche verborgen (Cancer of Unknown Primary). Andererseits können Hirnmetastasen auch noch Jahre nach dem Auftreten und der Behandlung eines Krebsleidens zeitlich versetzt (metachron) auftreten.
Insgesamt entsprechen die Symptome von Hirnmetastasen denen von bösartigen hirneigenen Tumoren wie dem Glioblastom. Da die meisten Hirnmetastasen rasch wachsen und sich eine Gewebsschwellung der Umgebung (perifokales Ödem) entwickelt, beträgt die Lebenserwartung unbehandelt nur einige Wochen bis wenige Monate.
Ein häufiges aber unspezifisches Symptom sind Kopfschmerzen. Ursache hierfür ist die raumfordernde Wirkung von Metastase und Ödem, die zu einer Dehnung der schmerzempfindlichen Hirnhäute führen kann.
Weitere neurologische Symptome treten in Abhängigkeit von der Lokalisation auf: befindet sich die Hirnmetastase im Bereich des Großhirns, können epileptische Anfälle, Paresen, Sensibilitätsstörungen, Gesichtsfeldausfälle oder Sprachstörungen auftreten. Persönlichkeits- und Stimmungsänderungen (zum Beispiel beim Frontalhirnsyndrom) sind nicht selten auch für die Umstehenden erkennbar. Manchmal kommt es zur Ausbildung eines akuten organischen Psychosyndroms mit paranoiden oder aggressiven Zügen im Sinne eines Delirs. Bei einer Lokalisation im Bereich von Kleinhirn oder Hirnstamm können Schwindel, Ataxie oder Hirnstammsyndrome auftreten.
Durch Zunahme des Hirndrucks kann es zu Apathie, Müdigkeit und Bewusstseinstrübungen kommen. Unstillbares Erbrechen oder Koma sind Spätzeichen mit schlechter Prognose.
Diagnostik[Bearbeiten | Quelltext bearbeiten]
Klinische Untersuchung[Bearbeiten | Quelltext bearbeiten]
Bei neurologischen Symptomen oder Beschwerden, die angesichts einer bekannten Krebserkrankung an das mögliche Vorliegen von Hirnmetastasen denken lassen, kommt der gezielten neurologischen Untersuchung eine wichtige Rolle zu. Gesucht wird unter anderem nach Hirndruckzeichen (Stauungspapille), Hirnnervenausfällen und zentralen Lähmungen, die sich durch gesteigerten Muskeltonus und betonte Eigenreflexe, manchmal auch durch Pyramidenbahnzeichen bemerkbar machen. Psychische Veränderungen, Verlangsamung oder Störungen des Erlebens fallen oft schon im Anamnesegespräch auf.
Bildgebung[Bearbeiten | Quelltext bearbeiten]
Kernstück der Diagnostik sind bildgebende Verfahren, wobei die Kernspintomographie (MRT) der Computertomographie (CT) überlegen ist.

Computertomographie
Die Computertomographie spielt als schnell durchführbares und breit verfügbares Verfahren vor allem eine Rolle in der Notfallmedizin. Größere Metastasen grenzen sich als hypodense oder selten (Malignes Melanom, Chorionkarzinom) hyperdense Struktur gegen das normale Hirnparenchym ab. Da Metastasen aber auch isodens sein können, ist womöglich nur die raumfordernde Wirkung als Massenverschiebung oder die hypodense Formation des Perifokalödems abgrenzbar. Zentrale Einblutungen, wie sie insbesondere bei Metastasen von malignen Melanomen oder Nierenzellkarzinomen vorkommen, sind in der CT gut nachweisbar. In Abhängigkeit von der gewählten Schichtdicke liegt die Nachweisgrenze bei etwa einem Zentimeter, so dass kleinere Metastasen der nativen Computertomographie entgehen können.
Da die Computertomographie einen relativ geringen Weichteilkontrast aufweist, ist die Gabe von Kontrastmittel entscheidend: aufgrund der Störung der Blut-Hirn-Schranke im Bereich der Metastase kommt es zur Anreicherung von Kontrastmittel (Enhancement), das bei Vorliegen einer zentralen Nekrose häufig ring- oder girlandenförmig erscheint.
Kernspintomographie
Die Kernspintomographie weist bei besserer Weichteildifferenzierung, insbesondere nach Gabe von Gadolinium als Kontrastmittel, eine deutlich höhere Sensitivität auf und ist somit geeigneter für die Suche nach Hirnmetastasen. So ist im Vergleich zur CT-Untersuchung die Rate der Patienten mit im MRT nachgewiesenen Hirnmetastasen mehr als doppelt so hoch.[8] Das gilt besonders für sehr kleine Befunde und Metastasen im Bereich der hinteren Schädelgrube. Die Kernspintomographie kann zur Abgrenzung gegen Hirnabszesse oder andere möglicherweise ähnlich imponierende Läsionen um eine Kernspinresonanzspektroskopie ergänzt werden.[9]

Positronen-Emissions-Tomographie
Die Positronen-Emissions-Tomographie (PET) als funktionelles bildgebendes Verfahren (sie gibt, vereinfacht gesprochen, die Stoffwechselaktivität bildlich wieder) erlaubt die Beantwortung spezieller Fragen. Eine solche wäre zum Beispiel die Unterscheidung eines lokalen Rezidivs von einer Strahlennekrose unter der Behandlung, wenn diese Differenzierung nicht aus der Kernspintomographie allein abgeleitet werden kann.[10]
Angiographie
Die Angiographie spielt heute bei der Metastasendiagnostik nur noch eine untergeordnete Rolle,[11] kann aber im Einzelfall zur Operationsplanung sinnvoll sein.
Liquordiagnostik[Bearbeiten | Quelltext bearbeiten]
Bei an der Hirnoberfläche gelegenen Metastasen kann es zu einer Aussaat von Tumorzellen in die Flüssigkeitsräume des zentralen Nervensystems kommen, was als Meningeosis neoplastica bezeichnet wird. Im durch Lumbalpunktion gewonnenen Nervenwasser (Liquor cerebrospinalis) können dann Tumorzellen nachgewiesen werden, deren Zytologie und immunhistochemisches Expressionsprofil häufig Rückschlüsse auf den Primärtumor zulassen.

Diagnostik bei unbekanntem Primärtumor[Bearbeiten | Quelltext bearbeiten]
Ist beim Nachweis von Hirnmetastasen kein zugrunde liegendes Krebsleiden bekannt, gilt es zunächst, den Primärtumor aufzufinden. Zum Untersuchungsprogramm gehört die gründliche Untersuchung der Haut, eine Röntgenaufnahme des Thorax, Sonographie und/oder Computertomographie von Thorax, Abdomen und Becken, bei Frauen eine gynäkologische Untersuchung und eine Mammographie sowie bei begründetem Verdacht eine Bronchoskopie mit bronchoalveolärer Lavage, gegebenenfalls auch die Positronen-Emissions-Tomographie oder die Skelettszintigraphie. Laboruntersuchungen auf erhöhte Tumormarker sind eher unspezifisch und helfen meistens nicht weiter.
Wird kein Primärtumor gefunden, kann zur Diagnosesicherung eine Gewebeprobe operativ entnommen werden, was meist durch eine stereotaktische Biopsie erfolgt. Bei einer Mortalität von unter 1 % kann so in bis zu 96 % der Fälle eine histologische Diagnose gestellt werden.[12]
Differentialdiagnostik[Bearbeiten | Quelltext bearbeiten]
Differentialdiagnostisch zu bedenken sind neben bösartigen hirneigenen Tumoren und Lymphomen auch entzündliche Erkrankungen des Gehirns, deren Klinik und Bildgebung denen von Hirnmetastasen ähneln kann.[13] So werden nicht selten Entzündungsherde bei der Toxoplasmose oder solitäre entzündliche Entmarkungsherde[14] unter dem klinischen Verdacht einer Hirnmetastase operiert. Auch septisch-embolische Hirnabszesse, die bei einer hämatogenen Streuung aus einem Entzündungsherd (zum Beispiel einer infizierten Herzklappe bei Endokarditis) auftreten können, sind manchmal schwer von Metastasen zu unterscheiden. Weiterhin abzugrenzen sind gutartige Hirntumoren wie zum Beispiel Meningeome, die im Verlauf eines Tumor-Stagings zufällig gefunden werden.
Wenn sich durch erweiterte Bildgebung (Kernspintomographie, Spektroskopie) und Zusatzuntersuchungen (Liquorentnahme) keine Klärung erreichen lässt, ist auch hier die Biopsie angezeigt.
Pathologie[Bearbeiten | Quelltext bearbeiten]

Die neuropathologische Untersuchung des durch stereotaktische Biopsie oder Resektion gewonnenen Operationsmaterials dient der Sicherung der Diagnose und dem Ausschluss anderer Erkrankungen, deren klinisches und radiologisches Bild dem einer Hirnmetastase ähnelt. Da Hirnmetastasen sich auch primär durch eine Hirnblutung bemerkbar machen können,[15] wird bei der neurochirurgischen Ausräumung von Hirnblutungen gewonnenes Material immer auf das etwaige Vorliegen von Tumorbestandteilen untersucht.
Histologie
Die Histologie von Hirnmetastasen ähnelt häufig dem des Primärtumors und kann so erste Hinweise auf deren Herkunft geben. Charakteristisch für Hirnmetastasen ist die relativ deutliche Abgrenzung des Tumors gegenüber dem umgebenden Hirngewebe, das von Tumor zapfenförmig infiltriert wird.
Immunhistochemie
Insbesondere wenn eine Hirnmetastase die bisher einzige erkennbare Manifestation eines Krebsleidens ist, können immunhistochemische Untersuchungen wertvolle Hinweise auf die Lokalisation des Primärtumors geben. Hierbei werden Expressionsmuster von Proteinen, die relativ typisch für die verschiedenen Primärtumoren sind, untersucht.

So wird bei Hirnmetastasen von Adenokarzinomen eine Gruppe immunhistochemischer Marker eingesetzt, die unter anderem die Zytokeratinsubtypen CK7 und CK20, den thyroidalen Transkriptionsfaktor 1 (TTF1) und das Prolactin-induzierte Protein (PIP, GCDFP-15) umfasst.[16][17][18]
Bei Metastasen bösartiger Melanome, die kein Melaninpigment aufweisen, kann deren melanosomale Differenzierung durch eine Färbung für melanosomale Antigene (melanA und HMB45) nachgewiesen werden.
| Primärtumor | Expressionsprofil |
|---|---|
| Lungenkrebs | CK7+, CK20–, TTF1+, GCDFP15–, melanosomale Antigene– |
| Brustkrebs | CK7+, CK20–, TTF1−, GCDFP15+, melanosomale Antigene– |
| Darmkrebs | CK7–, CK20+, TTF1–, GCDFP15–, melanosomale Antigene– |
| Malignes Melanom | CK7–, CK20–, TTF1–, GCDFP15–, melanosomale Antigene+ |
Therapie und Prognose[Bearbeiten | Quelltext bearbeiten]
Therapie und Prognose sind eng miteinander verknüpft, da einerseits von den Prognosefaktoren abhängig ist, welche Therapieoptionen infrage kommen, und andererseits die Auswahl des therapeutischen Verfahrens die Lebenserwartung wesentlich beeinflusst.
Es gibt verschiedene therapeutische Verfahren, die bei Hirnmetastasen zum Einsatz kommen. Welches Verfahren angewendet wird, ist unter anderem von der Anzahl, Lage und Größe der Hirnmetastasen sowie vom Primärtumor abhängig. Einen wichtigen Stellenwert hat darüber hinaus der Allgemeinzustand des Patienten, der die Prognose und damit auch die Auswahl des Verfahrens maßgeblich beeinflusst. Patienten in schlechtem Allgemeinzustand tolerieren invasive Verfahren wie eine operative Entfernung der Hirnmetastasen weniger gut als Patienten in gutem Allgemeinzustand. Mit Hilfe des Karnofsky-Indexes wird der Allgemeinzustand objektivier- und vergleichbar. Nach Möglichkeit werden operative, radio- und chemotherapeutische Verfahren kombiniert.
Symptomatische Therapie[Bearbeiten | Quelltext bearbeiten]
Glucocorticoide führen über eine Rückbildung des Ödems zu einer Verminderung des Drucks auf das umgebende Hirngewebe (Masseneffekt) und damit zu einer Linderung der Beschwerden; die Lebenserwartung wird ohne weitere Maßnahmen auf durchschnittlich ein bis zwei Monate erhöht.[19] Die Behandlung erfolgt in der Regel mit Dexamethason, initial mit relativ hohen Dosen von bis zu 24 Milligramm pro Tag. Sie wird so bald wie möglich reduziert, da eine längerfristige Gabe von Glukokortikoiden zu einem Cushing-Syndrom führen kann.[20][21] Bei der notfallmäßigen Behandlung mit Glukokortikoiden wird dessen Diagnose erschwert, falls differentialdiagnostisch auch ein Lymphom in Frage kommt.
Epileptische Anfälle, die symptomatisch bei Hirnmetastasen auftreten, werden mit krampfhemmenden Medikamenten (Antikonvulsiva) behandelt. Im Gegensatz zu Gelegenheitsanfällen wird eine Dauerbehandlung hier bereits nach dem erstmaligen Anfallsereignis begonnen, da ein hohes Wiederholungsrisiko besteht. Zur symptomatischen Behandlung gehört auch die Gabe von Analgetika bei Kopfschmerzen und Antiemetika, wenn Übelkeit und Erbrechen auftreten.

Operation[Bearbeiten | Quelltext bearbeiten]
Bei ausreichend gutem Allgemeinzustand des Patienten werden solitäre und singuläre Hirnmetastasen nach Möglichkeit vollständig operativ reseziert. Wesentlich für die Entscheidung zur Operation sind der Allgemeinzustand des Patienten, das Stadium der Tumorerkrankung und die operative Zugänglichkeit der Hirnmetastase. Wenn die genannten Bedingungen zutreffen, kann in Einzelfällen auch bei zwei oder drei gut erreichbaren Metastasen operiert werden. Hirnmetastasen kleinzelliger Bronchialkarzinome werden im Allgemeinen nicht operiert, da sie auf Strahlen- und Chemotherapie gut ansprechen.
Bei Verlegung der Liquorwege (Hydrocephalus) durch Massenverschiebung kann unter Umständen die Ableitung des Liquors über eine innere oder äußere Drainage erwogen werden.[22]
Radiochirurgie[Bearbeiten | Quelltext bearbeiten]
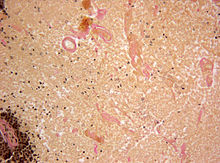
EvG-Färbung. Vergrößerung 1:200
Unter Radiochirurgie versteht man die Anwendung einer hohen Strahleneinzeldosis, die perkutan (durch die Haut) und stereotaktisch appliziert wird. Sie kann bis zu einem Metastasendurchmesser von drei Zentimetern eine Alternative zur konventionellen Operation darstellen und wird auch bei Patienten, die aufgrund eines schlechten Allgemeinzustands oder der Lokalisation der Metastase (beispielsweise im Hirnstamm) nicht operabel sind, eingesetzt. Je nach Größe der behandelten Metastase werden Dosen zwischen 15 und 24 Gray toleriert.
Ganzhirnbestrahlung[Bearbeiten | Quelltext bearbeiten]
Die Ganzhirnbestrahlung ist eine wichtige Therapieoption im Rahmen des Behandlungskonzepts von Hirnmetastasen.[23] Die Bestrahlung erfolgt in der Regel fraktioniert, das heißt in mehreren Einzeldosen bei einer Gesamtdosis von 30 bis 45 Gray, und umfasst das gesamte Gehirn einschließlich der Schädelbasis und der ersten beiden Halswirbel. In Einzelfällen konnte ein völliges Verschwinden der Hirnmetastasen erreicht werden.[24] Die Ganzhirnbestrahlung kann als adjuvante Therapie andere Therapieformen ergänzen, die alleinige Therapieform darstellen oder auch prophylaktisch eingesetzt werden.
Bei solitären oder singulären Hirnmetastasen kann die Ganzhirnbestrahlung adjuvant nach operativer Entfernung der Hirnmetastasen oder der stereotaktischen Radiochirurgie durchgeführt werden. Ob eine zusätzliche Ganzhirnbestrahlung im Vergleich zur alleinigen Operation einen Überlebensvorteil bietet, wird derzeit im Rahmen randomisierter Studien untersucht.[25] Bei Vorliegen multipler Metastasen kann die Ganzhirnbestrahlung zusätzlich zur Operation oder auch als alleinige Therapieform eingesetzt werden. Eine prophylaktische Ganzhirnbestrahlung kann bei Patienten mit kleinzelligem Bronchialkarzinom das Auftreten symptomatisch werdender Hirnmetastasen verringern und die Überlebenszeit auch bei fortgeschrittener Erkrankung verlängern.[26]
Nach einer Ganzhirnbestrahlung kann es zu verschiedenen Nebenwirkungen und Komplikationen wie einer Ödembildung kommen. Insbesondere bei größeren Metastasen besteht aufgrund des Druckes der Ödeme auf benachbarte Strukturen die Gefahr von schwerwiegenden neurologischen Ausfallerscheinungen. Die Gabe von Glukokortikoiden kann das Ausmaß der Ödeme und damit das der Nebenwirkungen reduzieren.
Chemotherapie[Bearbeiten | Quelltext bearbeiten]
Die meisten in das Gehirn metastasierenden Tumoren sind wenig sensibel für eine Chemotherapie, die daher nur eine geringe Rolle bei der Behandlung von Hirnmetastasen einnimmt. Wichtige Ausnahmen hiervon sind das kleinzellige Bronchialkarzinom, das Mammakarzinom, das Chorionkarzinom und Keimzelltumore. Es werden in der Regel dieselben Zytostatika verwendet, die bei Metastasen außerhalb des Gehirns Anwendung finden. Bei vielen Patienten führt die Chemotherapie zu einem vorübergehenden Ansprechen, die Lebensverlängerung ist aber insgesamt gering.
Prognose[Bearbeiten | Quelltext bearbeiten]
Eine pauschale Aussage zur Prognose bei Hirnmetastasen ist nicht möglich, da sie von verschiedenen Faktoren beeinflusst wird. Zu den wichtigsten Prognosefaktoren gehören
- die im Karnofsky-Index gemessene Einschränkung bei Aktivitäten des täglichen Lebens durch die Tumorerkrankung,
- das Alter des Patienten,
- die Kontrolle des Primärtumors,
- das Zeitintervall zwischen Auftreten des Primärtumors und der Hirnmetastase,
- die Histologie des Primärtumors,
- die Anzahl, Lage und Größe der Hirnmetastasen sowie
- das Vorhandensein und das Ausmaß von Metastasen außerhalb des Gehirns.[20]
Um in kurzer Zeit einerseits eine angemessene Information geben und andererseits klinisch adäquate Therapieentscheidung treffen zu können, wurden im Laufe der Zeit verschiedene prognostische Scores entwickelt. Diese Indices (z. B. GPA, DS-GPA, Lung-mol GPA) werden laufend verbessert und immer weiter spezifiziert.[27]
Generell gelten metastasierte Krebsleiden als nicht endgültig heilbar, Ausnahmen hiervon sind einige Keimzelltumore. Die Gesamtprognose bei Metastasen im Gehirn ist schlecht. Unbehandelt liegen die Überlebenszeiten im Rahmen von wenigen Wochen bis einigen Monaten. Eine rapide Verschlechterung mit plötzlichem Versterben kann durch massive Einblutung in eine Metastase oder durch akuten Liquoraufstau entstehen. Metastasen der hinteren Schädelgrube (Kleinhirn und Hirnstamm) führen schon bei geringer Größenzunahme zur Einklemmung und damit zum Tod. Die optimale Therapie erlaubt im Fall des Ansprechens eine Besserung der Lebensqualität und eine Verlängerung des Überlebens, im Einzelfall um mehrere Monate bis einige Jahre.
Tiermedizin[Bearbeiten | Quelltext bearbeiten]
Hirnmetastasen kommen auch bei Tieren vor. Speziell bei kleinen Haus- und Heimtieren (Hunde und Katzen) wird seit Mitte der 1980er Jahre in der Tiermedizin eine Zunahme an Hirnmetastasen beobachtet, was vor allem auf verfeinerte Untersuchungsmethoden zurückgeführt wird. Eine neuere Untersuchung gelangt zu dem Schluss, dass mehr als 60 % aller im Hirn festgestellter Tumoren metastatischen Ursprungs sind. Prozentual scheinen Hunde etwas öfter als Katzen betroffen zu sein. Häufigste Primärtumoren sind Sarkome (Fibro-, Osteo-, Chondro- und Hämangiosarkome). Weiterhin kommen Hirnmetastasen von Karzinomen der Milchdrüse, der Lunge, der Nase und der Nieren sowie lymphatischer Tumoren vor.[28]
Forschungsgeschichte[Bearbeiten | Quelltext bearbeiten]
Die Möglichkeit der Bildung von Hirnmetastasen ist schon seit einigen Jahrhunderten bekannt. Die Bedeutung von Hirnmetastasen wurde vor allem hinsichtlich der Häufigkeit bis ins späte 19. Jahrhundert hinein deutlich unterschätzt. Ihr Auftreten wurde als selten und ungewöhnlich gewertet. Die ersten bedeutenden Veröffentlichungen gehen auf die britischen Ärzte William Richard Gowers und Byrom Bramwell im Jahre 1888 zurück. Gowers veröffentlichte eine Klassifikation, in der die Ursachen intrakraniellen Wachstums in sechs Kategorien eingeteilt und nach Häufigkeit geordnet waren. Hirnmetastasen waren als Untergruppe von Karzinomen an dritter Stelle vertreten. Bramwell erkannte, dass Hirnmetastasen prinzipiell von jedem bösartigen Tumor ausgehen können, eine Ansicht, die bis heute unumstritten ist. Darüber hinaus unterstrich Bramwell die Bedeutung von Hirnmetastasen, indem er das mögliche Wachstum im Hirngewebe mit dem Wachstum von Mikroorganismen auf dem 1882 im Umfeld von Robert Koch aufgekommenen Agar-Nährboden verglich. Die erste klinisch-pathologische Studie geht auf Globus und Selinsky aus dem Jahre 1927 zurück. Sie beschrieben typische Symptome und pathologische Veränderungen, die bei Hirnmetastasen auftreten. Die Erkenntnisse über die Eigenschaften von Hirnmetastasen basieren teilweise noch heute auf diesen frühen Veröffentlichungen und wurden durch zahlreiche Forschungsarbeiten stetig erweitert.[29]
Literatur[Bearbeiten | Quelltext bearbeiten]
Lehrbücher[Bearbeiten | Quelltext bearbeiten]
- Mitchel Berger, Michael Prados (Hrsg.): Textbook of neuro-oncology. 1. Auflage, Elsevier, Philadelphia 2005, ISBN 0-7216-8148-4.
- Uwe Schlegel, Michael Weller und Manfred Westphal: Neuroonkologie. 2. Auflage, Thieme, Stuttgart 2003, ISBN 978-3-13-109062-1.
- Wolfgang Wick und Michael Weller: Hirnmetastasen. In: Thomas Brandt, Johannes Dichgans und Hans Christoph Diener (Hrsg.): Therapie und Verlauf neurologischer Erkrankungen. 5. Auflage, Kohlhammer, Stuttgart 2007, ISBN 978-3-17-019074-0.
Leitlinien[Bearbeiten | Quelltext bearbeiten]
- S2k-Leitlinie Hirnmetastasen und Meningeosis neoplastica der Deutschen Gesellschaft für Neurologie (DGN). In: AWMF online (Stand 2014)
Weblinks[Bearbeiten | Quelltext bearbeiten]
- Leitlinien Neuro-Onkologische Arbeitsgemeinschaft Metastasen und Meningeosis neoplastica (Stand 2014; PDF; 245 kB)
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b Uwe Schlegel, Michael Weller, Manfred Westphal: Neuroonkologie. Thieme, Stuttgart 2003, ISBN 978-3-13-109062-1
- ↑ Hirnmetastasen: Abwanderung von Krebszellen ins Zentralnervensystem, Krebsinformationsdienst des Deutschen Krebsforschungszentrums (DKFZ), Heidelberg. Vom 5. März 2007. Zuletzt abgerufen am 4. September 2014.
- ↑ Walker et al.: Epidemiology of brain tumors: the national survey of intracranial neoplasms. In: Neurology. Band 35, Nummer 2, Februar 1985, S. 219–226, ISSN 0028-3878. PMID 3969210.
- ↑ Jänisch et al.: Über die Häufigkeit und Herkunft von Metastasen im Zentralnervensystem. In: Deutsche Zeitschrift für Nervenheilkunde. Band 189, Nummer 1, Juni 1966, S. 79–86, ISSN 0367-004X. PMID 5982815.
- ↑ Paulus: Hirnmetastasen. In: Neuropathologie, herausgegeben von Pfeiffer, Schröder und Paulus. Springer Verlag. 2. Auflage. Berlin 2002 ISBN 3-540-41333-2
- ↑ Barnholtz-Sloan et al.: Incidence proportions of brain metastases in patients diagnosed (1973 to 2001) in the Metropolitan Detroit Cancer Surveillance System. In: Journal of Clinical Oncology. Band 22, Nummer 14, Juli 2004, S. 2865–2872, ISSN 0732-183X. doi:10.1200/JCO.2004.12.149. PMID 15254054.
- ↑ Jarrell et al.: Metastases to hemangioblastomas in von Hippel-Lindau disease. In: Journal of Neurosurgery. Band 105, Nummer 2, August 2006, S. 256–263, ISSN 0022-3085. doi:10.3171/jns.2006.105.2.256. PMID 17219831.
- ↑ Seute et al.: Detection of brain metastases from small cell lung cancer: consequences of changing imaging techniques (CT versus MRI). In: Cancer. Band 112, Nummer 8, April 2008, S. 1827–1834, ISSN 0008-543X. doi:10.1002/cncr.23361. PMID 18311784.
- ↑ Poptani et al.: Characterization of intracranial mass lesions with in vivo proton MR spectroscopy. In: AJNR. American journal of neuroradiology. Band 16, Nummer 8, September 1995, S. 1593–1603, ISSN 0195-6108. PMID 7502961.
- ↑ Chen: Clinical applications of PET in brain tumors. In: Journal of nuclear medicine : official publication, Society of Nuclear Medicine. Band 48, Nummer 9, September 2007, S. 1468–1481, ISSN 0161-5505. doi:10.2967/jnumed.106.037689. PMID 17704239.
- ↑ Kretzschmar et al.: Der Wert der Computer-Tomographie und Angiographie für die Diagnose supratentorieller Hirntumoren. In: Neuroradiology. Band 16, 1978, S. 487–490, ISSN 0028-3940. PMID 745745.
- ↑ W. A. Hall: The safety and efficacy of stereotactic biopsy for intracranial lesions. In: Cancer. Band 82, Nummer 9, Mai 1998, S. 1749–1755, ISSN 0008-543X. PMID 9576298.
- ↑ Omuro et al.: Pitfalls in the diagnosis of brain tumours. In: The Lancet Neurology. Band 5, Nummer 11, November 2006, S. 937–948, ISSN 1474-4422. doi:10.1016/S1474-4422(06)70597-X. PMID 17052661.
- ↑ J. J. Kepes: Large focal tumor-like demyelinating lesions of the brain: intermediate entity between multiple sclerosis and acute disseminated encephalomyelitis? A study of 31 patients. In: Annals of neurology. Band 33, Nummer 1, Januar 1993, S. 18–27, ISSN 0364-5134. doi:10.1002/ana.410330105. PMID 8494332.
- ↑ B. Licata, S. Turazzi: Bleeding cerebral neoplasms with symptomatic hematoma. In: Journal of neurosurgical sciences. Band 47, Nummer 4, Dezember 2003, S. 201–210, ISSN 0390-5616. PMID 14978474.
- ↑ Park et al.: Panels of immunohistochemical markers help determine primary sites of metastatic adenocarcinoma. In: Archives of Pathology & Laboratory Medicine, Band 131, Nummer 10, Oktober 2007, S. 1561–1567, ISSN 1543-2165. doi:10.1043/1543-2165(2007)131[1561:POIMHD]2.0.CO;2 (zurzeit nicht erreichbar). PMID 17922593.
- ↑ Drlicek et al.: Immunohistochemical panel of antibodies in the diagnosis of brain metastases of the unknown primary. In: Pathology, research and practice. Band 200, Nummer 10, 2004, S. 727–734, ISSN 0344-0338. doi:10.1016/j.prp.2004.09.002. PMID 15648611.
- ↑ Mazoujian et al.: Immunohistochemistry of a gross cystic disease fluid protein (GCDFP-15) of the breast. A marker of apocrine epithelium and breast carcinomas with apocrine features. In: The American Journal of Pathology. Band 110, Nummer 2, Februar 1983, S. 105–112, ISSN 0002-9440. PMID 6130702. PMC 1916150 (freier Volltext).
- ↑ Wen et al.: Treatment of brain metastases in favorable prognosis patients. UpToDate August 2007.
- ↑ a b c Leitlinien der DGN: Solide Hirnmetastasen. Stand: 2008 (Online-Version)
- ↑ Drappaz et al.: Management of vasogenic edema in patients with primary and metastatic brain tumors. UpToDate August 2007.
- ↑ J. Lokich, H. Levine, I. Nasser: Malignancy-related hydrocephalus: clinical features and results of ventricular peritoneal shunt procedure in three patients. In: American Journal of Clinical Oncology. Band 21, Nummer 4, August 1998, S. 366–368, ISSN 0277-3732. PMID 9708635.
- ↑ Astner et al.: Strahlentherapie intrazerebraler Metastasen. Der Onkologe 2008;14:246-254
- ↑ J. G. Cairncross, N. L. Chernik, J. H. Kim, J. B. Posner: Sterilization of cerebral metastases by radiation therapy. In: Neurology. Band 29, Nummer 9 Pt 1, September 1979, S. 1195–1202, ISSN 0028-3878. PMID 225696.
- ↑ European Organization for Research and Treatment of Cancer: Adjuvant Radiation Therapy in Treating Patients With Brain Metastases. ClinicalTrials.gov Identifier: NCT 00002899
- ↑ Slotmann et al.: Prophylactic cranial irradiation in extensive small-cell lung cancer. In: The New England journal of medicine. Band 357, Nummer 7, August 2007, S. 664–672, ISSN 1533-4406. doi:10.1056/NEJMoa071780. PMID 17699816.
- ↑ Carsten Nieder, Minesh P. Mehta: Prognostic indices for brain metastases--usefulness and challenges. In: Radiation Oncology (London, England). Band 4, 4. März 2009, ISSN 1748-717X, S. 10, doi:10.1186/1748-717X-4-10, PMID 19261187, PMC 2666747 (freier Volltext).
- ↑ Koestner & Higgins: Metastatic tumors of the central nervous system. In Meuten DJ: Tumors in Domestic Animals. Blackwell, 2002:737-738 ISBN 0-8138-2652-7
- ↑ Raymond Sawaya: Intracranial Metastases: Current Management Strategies. Wiley-Blackwell 2004, ISBN 1-4051-1646-3