Rutenio
| Rutenio | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aspetto | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Generalità | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nome, simbolo, numero atomico | rutenio, Ru, 44 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Serie | metalli di transizione | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gruppo, periodo, blocco | 8, 5, d | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densità | 12 370 kg/m³ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Durezza | 6,5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configurazione elettronica | 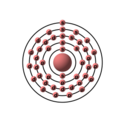 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Termine spettroscopico | 5F5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Proprietà atomiche | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Peso atomico | 101,07 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Raggio atomico (calc.) | 130(178) pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Raggio covalente | 126 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configurazione elettronica | [Kr]4d75s1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| e− per livello energetico | 2, 8, 18, 15, 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Stati di ossidazione | 2, 3, 4, 6, 8 (debolmente acido) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Struttura cristallina | esagonale | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Proprietà fisiche | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Stato della materia | solido | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto di fusione | 2 607 K (2 334 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto di ebollizione | 4 423 K (4 150 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Volume molare | 8,17×10−6 m³/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpia di vaporizzazione | 595 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Calore di fusione | 24 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tensione di vapore | 1,4 Pa a 2 523 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Velocità del suono | 5970 m/s a 293,15 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Altre proprietà | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Numero CAS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elettronegatività | 2,2 (scala di Pauling) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Calore specifico | 238 J/(kg·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conducibilità elettrica | 13,7×106/(m·Ω) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conducibilità termica | 117 W/(m·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energia di prima ionizzazione | 710,2 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energia di seconda ionizzazione | 1 620 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energia di terza ionizzazione | 2 747 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isotopi più stabili | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| iso: isotopo NA: abbondanza in natura TD: tempo di dimezzamento DM: modalità di decadimento DE: energia di decadimento in MeV DP: prodotto del decadimento | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Il rutenio è l'elemento chimico di numero atomico 44 e il suo simbolo è Ru. È il secondo elemento del gruppo 8 del sistema periodico (collocato tra il ferro e l'osmio); fa quindi parte del blocco d, ed è un elemento di transizione della seconda serie (5° periodo). È un metallo raro, come la maggior parte dei metalli del gruppo del platino, dei quali fa parte. Si trova nei minerali del platino ed in lega con esso viene usato come catalizzatore.
Caratteristiche[modifica | modifica wikitesto]
Il rutenio è un metallo bianco e duro, si presenta in quattro forme cristalline diverse e non si opacizza a temperature ordinarie. Si ossida con reazione esplosiva. Il rutenio si scioglie negli alcali fusi; non viene attaccato dagli acidi, ma subisce l'aggressione degli alogeni e ad alte temperature degli idrossidi alcalini. Piccole quantità di rutenio possono aumentare la durezza del platino e del palladio nonché rendere il titanio più resistente alla corrosione. Il rutenio può essere impiegato come rivestimento sia per elettrodeposizione sia per decomposizione termica. Una lega di rutenio-molibdeno è superconduttrice a temperature inferiori a 10,6 K.
Gli stati di ossidazione del rutenio variano da +1 a +8 e sono noti anche composti con numero di ossidazione −2. I più comuni nei suoi composti sono +2, +3 e +4.
Applicazioni[modifica | modifica wikitesto]
Per via del suo effetto indurente su platino e palladio, il rutenio viene usato in lega con essi per produrre contatti elettrici molto resistenti all'usura.
L'aggiunta dello 0,1% di rutenio al titanio ne aumenta la resistenza alla corrosione fino a 100 volte.
Il rutenio è anche un versatile catalizzatore: ad esempio l'acido solfidrico può essere decomposto dalla luce usando una sospensione acquosa di particelle di solfuro di cadmio (CdS) e diossido di rutenio. Il rutenio viene inoltre utilizzato come catalizzatore per reazioni di idrogenazione, per le quali assicura un'efficienza catalitica maggiore del rodio. Inoltre, complessato con il BINAP, costituisce il catalizzatore di Noyori per la idrogenazione asimmetrica di aldeidi, chetoni e immine e garantisce un alto grado di stereoselezione.
I complessi organometallici tra rutenio e carbene e tra rutenio e allenilidene si sono rivelati catalizzatori molto efficienti per la metatesi delle olefine, ossia per il riarrangiamento dei gruppi alchilici attorno agli atomi coinvolti nel doppio legame carbonio-carbonio, con importanti ricadute nella sintesi di composti organici e molecole di interesse farmaceutico.
Complessi organo-metallici del rutenio hanno evidenziato delle proprietà anti-tumorali portando allo sviluppo di medicinali sperimentali.
Altri complessi del rutenio, per via della loro capacità di assorbire la luce di tutto lo spettro visibile, sono oggetto di ricerca nello sviluppo di tecnologie solari.
Alcune leghe di rutenio-iridio sono utilizzate da aziende produttrici di accessori di lusso quali Mont Blanc e Rolex.
Storia[modifica | modifica wikitesto]
Il rutenio, dal latino Ruthenia che significa Russia, fu isolato da Karl Ernst Claus nel 1844. Klaus dimostrò che l'ossido di rutenio conteneva un nuovo elemento ed ottenne 6 grammi di rutenio metallico dalla parte di platino grezzo insolubile nell'acqua regia.
È possibile che già il chimico polacco Jędrzej Śniadecki avesse isolato l'elemento 44 da minerali del platino nel 1807 chiamandolo vestio, tuttavia il suo lavoro non fu mai confermato e successivamente egli ritirò la sua dichiarazione.
Disponibilità[modifica | modifica wikitesto]
Questo elemento molto raro si trova di solito in minerali di metalli del gruppo del platino nei Monti Urali e nelle Americhe. Quantità molto piccole, ma commercialmente importanti, si trovano nella pentlandite estratta a Sudbury (Ontario) e nei depositi di pirossenite in Sudafrica.
Questo metallo viene isolato attraverso un complicato procedimento chimico in cui si usa idrogeno per ridurre il rutenio ammonio cloruro e ottenere piccole quantità di polvere di rutenio, che viene poi consolidata con tecniche metallurgiche o fusa in forni ad arco elettrico in atmosfera inerte di argon.
Inoltre è possibile ottenere rutenio dal combustibile nucleare esaurito che contiene una piccola percentuale di isotopi di rutenio: il rutenio prodotto in questo modo contiene però un isotopo radioattivo (106Ru) con un'emivita di 373,59 giorni, perciò deve essere lasciato in deposito in strutture sicure per almeno 30 anni affinché possa essere smaltito pressoché completamente prima di poter mettere in commercio il metallo ottenuto.
A causa delle difficoltà legate al suo ottenimento e a causa delle sue particolari caratteristiche chimico-fisiche il rutenio è presente in commercio in quantità estremamente ridotte e questo ne giustifica il prezzo particolarmente elevato.
Composti[modifica | modifica wikitesto]
I composti del rutenio sono spesso molto simili per proprietà a quelli del cadmio ed esibiscono almeno otto stati di ossidazione diversi; i più diffusi però sono +2, +3 e +4.
Isotopi[modifica | modifica wikitesto]
Il rutenio in natura è rappresentato da sette isotopi aventi numeri di massa compresi nell'intervallo A = 96 e A = 104 e sono 96Ru (5,54%), 98Ru (1,87%), 99Ru (12,76%), 100Ru (12,6%), 101Ru (17,06%), 102Ru (31,55%) e 104Ru (18,62%).[1] Sono tutti stabili, sebbene il primo e l'ultimo abbiano modi di decadimento possibili, anche se finora non osservati.
Il 96Ru potrebbe decadere esotermicamente (674 keV per β+β+) per doppia cattura elettronica (εε)/doppia emissione di positrone (β+β+) in 96Mo (stabile),[2] l'emivita stimata è maggiore di 6,9×1019 anni.[3]
Il 104Ru potrebbe decadere esotermicamente (1301 keV) per doppia emissione di elettrone (doppio decadimento beta-) in 104Pd (stabile),[4] l'emivita stimata è maggiore di 1,9×1020 anni.[3]
Entro l'intervallo sopra menzionato abbiamo anche isotopi radioattivi: il 97Ru che decade β+ (85,67 keV), con emivita di 2,89 giorni, in 97Tc (che decade a sua volta in 97Mo, stabile);[5] il 103Ru che decade β- (763,41 keV), con emivita di 39,26 giorni, in 103Rh, stabile.[6]
Altri isotopi radioattivi al di fuori dell'intervallo sono, dapprima il 94Ru, che decade β+ (563,9 keV), con emivita di 51,83 minuti, in 94Tc (che decade a sua volta β+ in 94Mo, stabile);[7] il 95Ru, che decade β+ (1545 keV), con emivita di 1,643 ore, in 95Tc (che decade a sua volta β+ in 95Mo, stabile);[8] poi, oltre l'intervallo, il 105Ru, che decade β- (1918 keV), con emivita di 4,444 ore, in 105Rh (che decade a sua volta β- in 105Pd, stabile);[9] il 106Ru, che decade β- (39,4 keV), con emivita di 1,019 anni (371,8 giorni) in 106Rh (che decade a sua volta β- in 106Pd, stabile).[10]
I radioisotopi più longevi sono 106Ru, 103Ru e 97Ru. Altri radioisotopi hanno emivite molto più brevi, la maggior parte ha emivite di meno di 5 minuti, tranne i citati 95Ru (1,643 ore) e 105Ru (4,444 ore).
I modi di decadimento più frequenti prima del primo isotopo stabile (96Ru) consistono nella mutazione di un protone nucleare in un neutrone (ε e/o β+), o anche nella mutazione di 2 protoni in 2 neutroni (εε, εβ+, β+β+), con produzione di isotopi del tecnezio (tutti radioattivi) o, rispettivamente, del molibdeno (molti stabili).
Dopo l'ultimo isotopo stabile (104Ru) i tipi di decadimento più frequenti consistono nella mutazione di un neutrone nucleare in protone (β-), o anche nella mutazione di 2 neutroni in 2 protoni (β-β-), con produzione di isotopi del rodio o, rispettivamente, del palladio.
Precauzioni[modifica | modifica wikitesto]
Il tetrossido di rutenio (RuO4), simile al tetrossido di osmio, è molto tossico e può esplodere. Il rutenio non ha nessun ruolo biologico, ma macchia facilmente la pelle umana, può essere cancerogeno ed è soggetto a bioaccumulo nelle ossa.
Note[modifica | modifica wikitesto]
- ^ Isotope data for ruthenium-104 in the Periodic Table, su periodictable.com. URL consultato il 7 gennaio 2023.
- ^ Isotope data for ruthenium-96 in the Periodic Table, su periodictable.com. URL consultato il 7 gennaio 2023.
- ^ a b (EN) Erica Andreotti, Mikael Hult e Gerd Marissens, Study of the double beta decays of 96Ru and 104Ru, in Applied Radiation and Isotopes, vol. 70, n. 9, 1º settembre 2012, pp. 1985–1989, DOI:10.1016/j.apradiso.2012.02.042. URL consultato il 7 gennaio 2023.
- ^ Isotope data for ruthenium-104 in the Periodic Table, su periodictable.com. URL consultato il 7 gennaio 2023.
- ^ Isotope data for ruthenium-97 in the Periodic Table, su periodictable.com. URL consultato il 7 gennaio 2023.
- ^ Isotope data for ruthenium-103 in the Periodic Table, su periodictable.com. URL consultato il 7 gennaio 2023.
- ^ Isotope data for ruthenium-94 in the Periodic Table, su periodictable.com. URL consultato il 7 gennaio 2023.
- ^ Isotope data for ruthenium-95 in the Periodic Table, su periodictable.com. URL consultato il 7 gennaio 2023.
- ^ Isotope data for ruthenium-105 in the Periodic Table, su periodictable.com. URL consultato il 7 gennaio 2023.
- ^ Isotope data for ruthenium-106 in the Periodic Table, su periodictable.com. URL consultato il 7 gennaio 2023.
Bibliografia[modifica | modifica wikitesto]
- Francesco Borgese, Gli elementi della tavola periodica. Rinvenimento, proprietà, usi. Prontuario chimico, fisico, geologico, Roma, CISU, 1993, ISBN 88-7975-077-1.
- R. Barbucci, A. Sabatini e P. Dapporto, Tavola periodica e proprietà degli elementi, Firenze, Edizioni V. Morelli, 1998 (archiviato dall'url originale il 22 ottobre 2010).
Voci correlate[modifica | modifica wikitesto]
Altri progetti[modifica | modifica wikitesto]
 Wikizionario contiene il lemma di dizionario «rutenio»
Wikizionario contiene il lemma di dizionario «rutenio» Wikimedia Commons contiene immagini o altri file su rutenio
Wikimedia Commons contiene immagini o altri file su rutenio
Collegamenti esterni[modifica | modifica wikitesto]
- rutènio, su Treccani.it – Enciclopedie on line, Istituto dell'Enciclopedia Italiana.
- (EN) ruthenium, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
- (EN) Ruthenium, su periodic.lanl.gov, Los Alamos National Laboratory. URL consultato il 23 febbraio 2005 (archiviato dall'url originale il 5 aprile 2007).
- (EN) Ruthenium, su WebElements.com.
- (EN) Ruthenium, su EnvironmentalChemistry.com.
| Controllo di autorità | LCCN (EN) sh85116086 · GND (DE) 4178766-3 · BNF (FR) cb12226709p (data) · J9U (EN, HE) 987007548526805171 · NDL (EN, JA) 00569816 |
|---|

