1-Indanon
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | 1-Indanon | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C9H8O | ||||||||||||||||||
| Kurzbeschreibung |
hellgelber geruchloser Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 132,16 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||||||||
| Dichte |
1,103 g·cm−3[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
243–245 °C[1] | ||||||||||||||||||
| Löslichkeit |
| ||||||||||||||||||
| Brechungsindex |
1,561 (25 °C)[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
1-Indanon (IUPAC) ist eine chemische Verbindung aus der Gruppe der aromatischen cyclischen Ketone.
Vorkommen
[Bearbeiten | Quelltext bearbeiten]1-Indanon ist ein Oxidationsprodukt von Indan, einem Bestandteil von Kraftstoffen, Lösungsmitteln und Lacken. Es ist auch ein Metabolit von Thalidomid.[1] Die Verbindung wurde auch in Zigarettenrauch nachgewiesen.[3]
Gewinnung und Darstellung
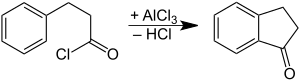
[Bearbeiten | Quelltext bearbeiten]1-Indanon kann durch Oxidation von Indan oder Inden gewonnen werden.[4] Die Verbindung kann auch durch intramolekulare Friedel-Crafts-Acylierung aus 3-Phenylpropionsäurechlorid gewonnen werden.[5][6]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]1-Indanon ist ein hellgelber geruchloser Feststoff, der schwer löslich in Wasser ist.[1] Er besitzt eine monokline Kristallstruktur mit der Raumgruppe P21/c (Raumgruppen-Nr. 14).[7][8]
Verwendung
[Bearbeiten | Quelltext bearbeiten]1-Indanon kann als Zwischenprodukt zur Herstellung von Arzneistoffen und anderen Chemikalien verwendet werden.[9][10] Das Bromderivat kann für die Synthese von Pestiziden und Antihelminthika und aromatischen Retinoiden verwendet werden. Das Chlorderivat kann zur Herstellung von Antikonvulsiva, Fungiziden und Dozapin-Analoga eingesetzt werden.[8]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e f g h i j k Datenblatt 1-Indanone, 99+% bei Alfa Aesar, abgerufen am 22. Mai 2023 (Seite nicht mehr abrufbar).
- ↑ a b David R. Lide: CRC Handbook of Chemistry and Physics. (Special Student Edition). CRC-Press, 1995, ISBN 978-0-8493-0595-5, S. 194 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Alan Rodgman, Thomas A. Perfetti: The Chemical Components of Tobacco and Tobacco Smoke. CRC Press, 2016, ISBN 978-1-4665-1552-9, S. 335 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a-HYDRINDONE. In: Organic Syntheses. Band 18, 1938, S. 47, doi:10.15227/orgsyn.018.0047.
- ↑ Heinrich Wieland: Die Praxis des organischen Chemikers. De Gruyter, 2010, ISBN 978-3-11-085128-1, S. 261 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Phuong Hoang Tran, Vy Hieu Huynh, Poul Erik Hansen, Duy-Khiem Nguyen Chau, Thach Ngoc Le: An Efficient and Green Synthesis of 1-Indanone and 1-Tetralone via Intramolecular Friedel-Crafts Acylation Reaction. In: Asian Journal of Organic Chemistry. Band 4, Nr. 5, 2015, S. 482–486, doi:10.1002/ajoc.201402274.
- ↑ J. S. Patel, D. M. Hanson: Investigation of the stark effect on the lowest triplet states of 1-indanone single crystals. In: Chemical Physics. Band 69, Nr. 3, 1982, S. 249–258, doi:10.1016/0301-0104(82)88065-8.
- ↑ a b T. Peña Ruiz, M. Fernández-Gómez, J. J. López González, A. E. Koziol, J. M. Granadino Roldán: Weak C–H⋯O and C–H⋯π hydrogen bonds in crystal 1-indanone. An structural and spectroscopic analysis. In: Journal of Molecular Structure. Band 707, Nr. 1, 2004, S. 33–46, doi:10.1016/j.molstruc.2004.05.007.
- ↑ Datenblatt 1-Indanon, ReagentPlus®, ≥99% bei Sigma-Aldrich, abgerufen am 22. Mai 2023 (PDF).
- ↑ John H. Montgomery, Thomas Roy Crompton: Environmental Chemicals Desk Reference. CRC Press, 2017, ISBN 978-1-351-68771-3, S. 445 (eingeschränkte Vorschau in der Google-Buchsuche).