Bariumsulfit
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
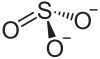
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Bariumsulfit | |||||||||||||||
| Summenformel | BaSO3 | |||||||||||||||
| Kurzbeschreibung |
weißer geruchloser Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 217,39 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte |
4,43 g·cm−3[2] | |||||||||||||||
| Löslichkeit |
sehr schwer löslich in Wasser (0,2 g·l−1)[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Bariumsulfit ist eine chemische Verbindung aus der Gruppe der Bariumverbindungen und Sulfite.
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Bariumsulfit kann durch Reaktion von Natriumsulfit mit einer Lösung von Bariumchlorid[3] oder Bariumhydroxid[4] gewonnen werden.
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Physikalische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Bariumsulfit ist ein weißer geruchloser nicht brennbarer Feststoff, der sehr schwer löslich in Wasser ist.[1] In Säuren ist es leicht löslich.[5] Er hat ein monoklines Kristallsystem mit einer Einheitszellengröße von 664,7 × 548,3 × 464,5 A und einem Winkel von 106,3°.[2] Auch eine trikline Form ist bekannt.[6]
Chemische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Bariumsulfit kann mit Wasserstoffperoxid quantitativ zu Bariumsulfat oxidiert werden.[7]
Beim Erhitzen einer Lösung von Bariumsulfit in Schwefliger Säure zersetzt sich diese unter Bildung von Bariumsulfat und einem Polythionat.[4][5]
Beim Glühen unter Luftabschluss zersetzt sich Bariumsulfit in Bariumsulfat und Bariumsulfid.[5]
Weblinks
[Bearbeiten | Quelltext bearbeiten]- IR-Spektrum (PDF; 3,0 MB)
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d Eintrag zu CAS-Nr. 7787-39-5 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 22. Januar 2012. (JavaScript erforderlich)
- ↑ a b Jean D’Ans, Ellen Lax: Taschenbuch für Chemiker und Physiker. 3. Elemente, anorganische Verbindungen und Materialien, Minerale, Band 3. 4. Auflage, Springer, 1997, ISBN 978-3-540-60035-0, S. 330. (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ D. Van Nonstrant Company: Elementary General Chemistry. 1941 (Seite 342 in der Google-Buchsuche).
- ↑ a b C. Saint-Pierre: "Sur la décomposition spontanée de divers bisulfites" in Compt. Rend. Hebd. 1872, 74, S. 52–53. Volltext
- ↑ a b c R. Abegg, F. Auerbach: Handbuch der anorganischen Chemie, Verlag S. Hirzel, Bd. 2, 1908. S. 270; Volltext
- ↑ R. S. W. Braithwaite, A. R. Kampf, R. G. Pritchard, R. P. H. Lamb: "The occurrence of thiosulfates and other unstable sulfur species as natural weathering products of old smelting slags" in Mineralogy and Petrology 1993, 47(2-4), S. 255–261. doi:10.1007/BF01161570
- ↑ A. Classen, O. Bauer: "Ueber die Anwendbarkeit des Wasserstoffsuperoxyds in der analytischen Chemie" in Berichte der deutschen chemischen Gesellschaft 1883, S. 1061–1074. Volltext



