Benutzer:Orci/Namensreaktionen/A
Zur Navigation springen
Zur Suche springen
| Entdecker | Jahr | Reagenzien | Kurzbeschreibung | Zielmolekül(e) | Quelle |
|---|---|---|---|---|---|
| Abiko-Masamune-Aldol-Reaktion | |||||
| Atsushi Abiko, Satoru Masamune | 1996 | Carbonsäureester, Aldehydre, Bor-Enolate | Aldol-Reaktion | stereoselekive β-Hydroxycarbonsäureester | [1] |
| Abramovitch-Shapiro-Tryptaminsynthese | |||||
| R. A. Abramovitch, David J. Shapiro | 1956 | Tetrahydropyridoindolone | Ringöffnung, Decarboxylierung | Tryptamine | [2] |

| |||||
| Abramow-Reaktion | |||||
| Wassili Abramow | 1954 | Carbonylverbindungen, Alkylphosphite | Phosphorylierung | Hydroxyalkylphosphonate | [3] |
| Achmatowicz-Reaktion | |||||
| Osman Achmatowicz | 1971 | Furane, Brom, Säure | Umlagerung | Dihydropyrane | [4] |

| |||||
| Adams-Decarboxylierung (Adams-Reaktion) | |||||
| Roger Adams | 1948 | Cumarine mit Carbonsäuregruppe in Position 3, Natriumhydrogensulfat, Natriumhydroxid | Decarboxylierung | Cumarine | [5] |

| |||||
| Adkins-Peterson-Reaktion | |||||
| Homer Burton Adkins, Wesley R. Peterson | 1931 | Methanol, Sauerstofff, Metalloxid-Katalysator | Oxidation | Formaldehyd | [6] |
| Adler-Phenoloxidation (Adler-Becker-Oxidation) | |||||
| Erich Adler | 1959 | ortho-Alkoxyphenole, Natriummetaperiodat | Oxidation | Spirooxirane | [7] |
| Ainley-King-Synthese | |||||
| A. D. Ainley, Harold King | 1938 | p-Anisidine, Acetessigester, Wasserstoff, Benzaldehyd, Ethyl-ε-benzamidocaproat, Bromwasserstoff, Natriumcarbonat | mehrstufige Reaktion | α-Piperidyl-4-chinolinmethanole | [8] |
| Akabori-Aminosäure-Reaktionen | |||||
| Shiro Akabori | 1931 | Aminosäuren, Zucker | oxidative Zersetzung und Abspaltung von CO2, NH3 | Aldehyde | [9] |
| Shiro Akabori | 1933 | Aminosäuren, Natriumamalgam | Reduktion in ethanolischer Salzsäure | Aldehyde | [10] |
| Albright-Goldman-Oxidation | |||||
| J. Donald Albright, Leon Goldman | 1965 | primäre/sekundäre Alkohole | Oxidation primärer Alkohole zu Aldehyden oder sekundärer Alkohole zu Ketonen | Aldehyde, Ketone | [11] |

| |||||
| Albright-Onodera-Oxidation | |||||
| J. Donald Albright, Konoshin Onodera | 1965 | Alkohole, Phosphorpentoxid, DMSO | Oxidation | Aldehyde, Ketone | [12][13] |
| Alder-En-Reaktion | |||||
| Kurt Alder | 1943 | Alkene, Verbindung mit Doppelbindung | pericyclische Reaktion von En und Enophil | [14] | |

| |||||
| Alder-Rickert-Reaktion | |||||
| Kurt Alder, Hans Ferdinand Rickert | 1936 | Cyclohexadiene, Alkine | Diels-Alder-Reaktion | polysubstituierte Aromaten | [15] |

| |||||
| Algar-Flynn-Oyamada-Reaktion | |||||
| J. Algar, J. P. Flynn, B. Oyamada | 1934 | Chalkone, Wasserstoffperoxid | ringschließende Oxidation | Flavonole | [16] |

| |||||
| Allan-Robinson-Reaktion | |||||
| J. Allan, Robert Robinson | 1924 | ortho-Hydroxyarylketone, aromatische Anhydride | Acylierung, Abspaltung einer Carbonsäure, Ringschluss | Flavone, Isoflavone | [17] |

| |||||
| Allen–Millar–Trippett-Umlagerung | |||||
| David W. Allen, Ian T. Millar, Stuart Trippett | 1969 | cyclische Phosphine, Diiodmethan, Kaliumhydroxid | Methylierung, Reaktion von Phosphor mit Hydroxid, Umlagerung unter Ringerweiterung | Phosphoroxide | [18] |

| |||||
| Alper-Carbonylierung | |||||
| Howard Alper | 1981 | cyclische Amine, Kohlenstoffmonoxid, Übergangsmetall-Katalysator (Pd, Rh, Ru, Co) | Carbonyl-Insertion unter Ringerweiterung | Lactame | [19] |
| Amadori-Umlagerung | |||||
| Mario Amadori | 1925 | Aldosylamine | Umlagerung, Teil der Maillard-Reaktion | 1-Amino-1-desoxyketosen | [20] |
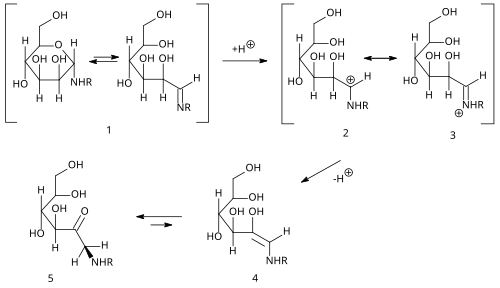
| |||||
| Andersen-Methode | |||||
| Kenneth K. Andersen | 1962 | para-Toluolsulfonsäurechlorid, Menthol, Grignard-Reagenz | Bildung des Menthyl-p-tolylsulfinates, Epimertrennung durch Kristallisation, Reaktion mit Grignard-Reagenz | enantiomerenreine Sulfoxide | [21] |
| Andrussow-Prozess | |||||
| Leonid Andrussow | 1927 | Methan, Ammoniak, Sauerstoff, Platin-Rhodium-Katalysator | katalytische Gasphasenreaktion | Blausäure | [22] |
| Anelli-Oxidation | |||||
| Pier Lucio Anelli | 1987 | Alkohole, Natriumhypochlorit, TEMPO | Oxidation | Aldehyde/Ketone | [23] |
| Angeli-Rimini-Reaktion | |||||
| Angelo Angeli, Enrico Rimini | 1896 | Aldehyde, Benzolsulfhydroxamsäure | nukleophiler Angriff, Abspaltung eines Benzolsulfinates | Hydroxamsäuren | [24][25] |

| |||||
| anionische Oxy-Cope-Umlagerung | |||||
| siehe Cope-Umlagerung | |||||
| Anschütz-Anthracen-Synthese | |||||
| Richard Anschütz | 1883 | Benzol, Bromethen, Aluminiumchlorid | Friedel-Craft-Alkylierung | Anthracen | [26] |

| |||||
| Appel-Reaktion | |||||
| Rolf Appel | 1971 | Alkohole, Triphenylphosphin, Tetrachlormethan | Bildung des Appel-Salzes aus CCl4 und PPh3, Nukleophile Substitution am Alkohol | Halogenalkane | [27] |

| |||||
| Arbusow-Reaktion (Michaelis-Arbusow-Reaktion) | |||||
| August Michaelis, Alexander Arbusow | 1898 | Phosphite, Alkylhalogenide | nukleophile Substitution | Monoalkylphosphonate | [28][29] |

| |||||
| Arduengo-Cyclokondensation | |||||
| Anthony J. Arduengo | 1991 | Glyoxal, Amine, Paraformaldehyd, Säure | cyclische Kondensation | N,N-Disubstituierte Imidazoliumsalze | [30] |
| Arens-van-Dorp-Reaktion | |||||
| Jozef Ferdinand Arens, David Adriaan van Dorp | 1947 | Carbonylverbindungen, Ethoxyacetylen; Grignard-Verbindung oder β-Chlorvinylether und Lithiumamid | Grignard-Reaktion bzw. nucleophile Eliminierung, Hydrierung, Hydratisierung | α,β-ungesättigten Aldehyde | [31] |

| |||||
| Arndt-Eistert-Homologisierung | |||||
| Fritz Arndt, Bernd Eistert | 1935 | Carbonsäurechloride, Diazomethan | Verlängerung einer Kohlenstoffkette um ein C-Atom | Carbonsäuren | [32] |

| |||||
| Asinger-Reaktion | |||||
| Friedrich Asinger | 1956 | Ketone/Aldehyde, Schwefel, Ammoniak | Mehrkomponentenreaktion | Thiazoline | [33] |

| |||||
| Aston-Greenburg-Umlagerung | |||||
| J. G. Aston, R. B. Greenburg |
1940 | α-Halogenketon | intramolekulare Wanderung einer Alkyl- oder Aryl-gruppe (Umlagerung) | Ester mit tertiärem α-Kohlenstoffatom | [34] |

| |||||
| Atherton-Todd-Reaktion | |||||
| F. R. Atherton, A. R. Todd | 1945 | Dialkylphosphite, Tetrachlormethan, Base | Bildung eines Reagenzes mit abgespaltener Methylgruppe, Deprotonierung des Phosphites, Chlorierung | Dialkylchlorphosphate | [35] |
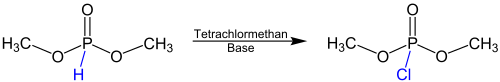
| |||||
| Auwers-Synthese | |||||
| Karl von Auwers | 1908 | Benzofurane, Aldehyde, Brom | Aldolkondensation, Bromierung einer Doppelbindung, Umlagerung | Flavonole | [36] |

| |||||
| Auwers-Inhoffen-Umlagerung | |||||
| Karl von Auwers, H.H. Inhoffen | 1921 | Dienone, Säure | Umlagerung | Phenole | [37][38] |
| Aza-Claisen-Umlagerung | |||||
| siehe Claisen-Umlagerung | |||||
| Aza-Cope-Umlagerung | |||||
| siehe Cope-Umlagerung | |||||
| Aza-Diels-Alder-Reaktion | |||||
| siehe Diels-Alder-Reaktion | |||||
| Aza-Wittig-Rektion | |||||
| siehe Wittig-Reaktion | |||||
Quellen[Bearbeiten | Quelltext bearbeiten]
- ↑ Atsushi Abiko, Ji-Feng Liu, Satoru Masamune: Concerning the Boron-Mediated Aldol Reaction of Carboxylic Esters. In: The Journal of Organic Chemistry. 61, 1996, S. 2590, doi:10.1021/jo960252b.
- ↑ R. A. Abramovitch, David J. Shapiro: 880. Tryptamines, carbolines, and related compounds. Part II. A convenient synthesis of tryptamines and β-carbolines. In: Journal of the Chemical Society. 1956, S. 4589–4592 doi:10.1039/JR9560004589.
- ↑ V.S. Abramov: In: Doklady Akademii Nauk SSSR. 1954, 95, S. 991.
- ↑ O. Achmatowicz, P. Bukowski, B. Szechner, Z. Zwierzchowska, A. Zamojski: Synthesis of methyl 2,3-dideoxy-DL-alk-2-enopyranosides from furan compounds. In: Tetrahedron. 27, 1971, S. 1973, doi:10.1016/S0040-4020(01)98229-8.
- ↑ Roger Adams, J Mathieu: A New Synthesis of Atranol (2,6-Dihydroxy-4-methylbenzaldehyde) and the Corresponding Cinnamic Acid. In: Journal of the American Chemical Society. 1948, Band 70, Nummer 6, S. 2120–2122 doi:10.1021/ja01186a037.
- ↑ Homer Adkins, Wesley R. Peterson: The oxidation of methanol with air over iron, molybdenum and iron-molybdenum oxides. In: Journal of the American Chemical Society. 53, 1931, S. 1512, doi:10.1021/ja01355a050.
- ↑ Erich Adler, Rune Magnusson, Svend E. Hansen, R. Sömme, Einar Stenhagen, H. Palmstierna: Periodate Oxidation of Phenols. I. Monoethers of Pyrocatechol and Hydroquinone. In: Acta Chemica Scandinavica. 13, 1959, S. 505, doi:10.3891/acta.chem.scand.13-0505.
- ↑ A. D. Ainley, Harold King: Antiplasmodial action and chemical constitution Part II. Some simple synthetic analogues of quinine and cinchonine. In: Proceedings of the Royal Society of London. Series B - Biological Sciences. 125, 1938, S. 60, doi:10.1098/rspb.1938.0013.
- ↑ S. Akabori. In: J. Chem. Soc. Japan. 1931, 52, S. 606.
- ↑ Shiro Akabori: Synthese von Imidazol-Derivaten aus α-Amino-säuren, I, Mitteil.: Eine neue Synthese von Desamino-histidin und ein Beitrag zur Kenntnis der Konstitution des Ergothioneins. In: Berichte der deutschen chemischen Gesellschaft. 1933, 66, 2, S. 151-158, doi:10.1002/cber.19330660214.
- ↑ J. Donald Albright, Leon Goldman: Indole Alkaloids. III.1 Oxidation of Secondary Alcohols to Ketones. In: The Journal of Organic Chemistry. Band 30, Nr. 4, 1965, S. 1107–1110, doi:10.1021/jo01015a038.
- ↑ J. Donald Albright, Leon Goldman: Dimethyl Sulfoxide-Acid Anhydride Mixtures. New Reagents for Oxidation of Alcohols. In: Journal of the American Chemical Society. 87, 1965, S. 4214, doi:10.1021/ja01096a055.
- ↑ Konoshin Onodera, Shigehiro Hirano, Naoki Kashimura: Oxidation of Carbohydrates with Dimethyl Sulfoxide Containing Phosphorus Pentoxide. In: Journal of the American Chemical Society. 87, 1965, S. 4651, doi:10.1021/ja00948a050.
- ↑ Kurt Alder, Franz Pascher, Andreas Schmitz: Über die Anlagerung von Maleinsäure-anhydrid und Azodicarbonsäure-ester an einfach ungesättigte Koh an einfach ungesättigte Kohlenwasserstoffe. Zur Kenntnis von Substitutionsvorgängen in der Allyl-Stellung. In: Berichte der deutschen chemischen Gesellschaft. 1943, 76, 1-2, S. 27-53, doi:10.1002/cber.19430760105.
- ↑ Kurt Alder, Hans Ferdinand Rickert: Zur Kenntnis der Dien-synthese. I. Über eine Methode der direkten Unterscheidung cyclischer Penta- und Hexa-diene. In: Justus Liebig's Annalen der Chemie. 524, 1936, S. 180, doi:10.1002/jlac.19365240109.
- ↑ J. Algar, J.P. Flynn. In: Proc. Roy. Irish. Acad. 1934, 42B, S. 1; T. Oyamada. In:. J. Chem. Soc. Japan. 1934, 55, S. 1256.
- ↑ James Allan, Robert Robinson: CCXC.—An accessible derivative of chromonol. In: Journal of the Chemical Society, Transactions. 1924, 125, S. 2192-2195, doi:10.1039/CT9242502192.
- ↑ David W. Allen, Ian T. Millar: The alkaline hydrolysis of some cyclic phosphonium salts: ring-opening and ring-expansion reactions. In: Journal of the Chemical Society C: Organic. 1969, S. 252, doi:10.1039/J39690000252.
- ↑ Howard Alper, Chulangani P. Perera, Farid R. Ahmed: A novel synthesis of β-lactams. In: Journal of the American Chemical Society. 103, 1981, S. 1289, doi:10.1021/ja00395a082.
- ↑ W. Amadori. Atti. reale accad. nazl. Lincei. 1925, 6, 2, S. 337
- ↑ Kenneth K. Andersen: Synthesis of (+)-ethyl -tolyl sulfoxide from (-)-menthyl (p)-toluenrsulfinate. In: Tetrahedron Letters. 3, 1962, S. 93–95, doi:10.1016/S0040-4039(00)71106-3.
- ↑ Leonid Andrussow: Über die schnell verlaufenden katalytischen Prozesse in strömenden Gasen und die Ammoniak-Oxydation (V). In: Berichte der deutschen chemischen Gesellschaft. 60, 1927, S. 2005, doi:10.1002/cber.19270600857.
- ↑ Pier Lucio Anelli, Carlo Biffi, Fernando Montanari, Silvio Quici: Fast and selective oxidation of primary alcohols to aldehydes or to carboxylic acids and of secondary alcohols to ketones mediated by oxoammonium salts under two-phase conditions. In: The Journal of Organic Chemistry. 52, 1987, S. 2559, doi:10.1021/jo00388a038.
- ↑ Angelo Angeli: Gazz. Chim. Ital. 1896, 26, 17.
- ↑ Enrico Rimini: Gazz. Chim. Ital. 1901, 31, 84.
- ↑ R. Anschütz, F. Eltzbacher: Eine neue Synthese des Anthracens. In: Berichte der deutschen chemischen Gesellschaft. 16, 1883, S. 623, doi:10.1002/cber.188301601138.
- ↑ Rolf Appel, Roland Kleinstück, Klaus-Dieter Ziehn: Neues Verfahren zur Darstellung von Isocyaniden. In: Angewandte Chemie. 1971, 83, 4, S.143, doi:10.1002/ange.19710830405.
- ↑ A. Michaelis, R. Kaehne: Ueber das Verhalten der Jodalkyle gegen die sogen. Phosphorigsäureester oder O-Phosphine. In: Berichte der deutschen chemischen Gesellschaft. 31, 1898, S. 1048, doi:10.1002/cber.189803101190.
- ↑ A. E. Arbuzov: In: J. Russ. Phys. Chem. Soc. 1906, 38, S. 687.
- ↑ Patent US5077414A: Preparation of 1,3-disubstituted imidazolium salts. Veröffentlicht am 31. Dezember 1991, Erfinder: Anthony J. Arduengo.
- ↑ J. F. Arens, D. A. van Dorp: A new method for the synthesis of α,β‐unsaturated aldehydes. Preparation of β‐methylcinnamic aldehyde, citral and β‐ionylidene acetaldehyde. In: Recueil des travaux chimiques des Pays-Bas. 1948, Band 67, Nummer 12, S. 973–979 doi:10.1002/RECL.19480671206.
- ↑ F. Arndt, B. Eistert: Ein Verfahren zur Überführung von Carbonsäuren in ihre höheren Homologen bzw. deren Derivate. In: Berichte der deutschen chemischen Gesellschaft. 1935, 68, 1, S. 200-206, doi:10.1002/cber.19350680142.
- ↑ Friedrich Asinger: Über die gemeinsame Einwirkung von Schwefel und Ammoniak auf Ketone. In: Angewandte Chemie. 1956, 68, 12, S. 413, doi:10.1002/ange.19560681209.
- ↑ J. G. Aston, R. B. Greenburg: alpha-Bromo Secondary Alkyl Ketones. I. Reaction with Sodium Alcoholates. A New Synthesis of Tertiary Acids by Rearrangement. In: Journal of the American Chemical Society. Band 62, Nr. 10, 1940, S. 2590–2595, DOI:10.1021/ja01867a003.
- ↑ F. R. Atherton, H. T. Openshaw, A. R. Todd: 174. Studies on phosphorylation. Part II. The reaction of dialkyl phosphites with polyhalogen compounds in presence of bases. A new method for the phosphorylation of amines. In: Journal of the Chemical Society. 1945, S. 660, doi:10.1039/jr9450000660.
- ↑ K. Auwers, K. Müller: Umwandlung von Benzal-cumaranonen in Flavonole. In: Berichte der deutschen chemischen Gesellschaft. 1908, 41, 3, S. 4233-4241, doi:10.1002/cber.190804103137.
- ↑ K. v. Auwers, K. Ziegler: Über Kohlenwasserstoffe der Semibenzolgruppe. In: Justus Liebig's Annalen der Chemie. 425, 1921, S. 217, doi:10.1002/jlac.19214250302.
- ↑ H. H. Inhoffen: Übergang von Sterinen in aromatische Verbindungen. In: Angewandte Chemie. 53, 1940, S. 471, doi:10.1002/ange.19400534103.
