Chiraphos
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Chiraphos | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C28H28P2 | ||||||||||||||||||
| Kurzbeschreibung |
weißer, kristalliner Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 426,47 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Chiraphos ist ein chiraler zweizähniger Chelatligand. Er gehört zur Gruppe der bidentaten chiralen Phosphinliganden. Der Name setzt sich aus den Worten chiral und phosphino zusammen.
Darstellung
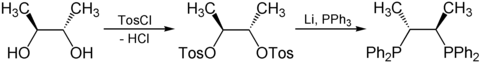
[Bearbeiten | Quelltext bearbeiten]Chiraphos kann enantiomerenrein aus kommerziell enantiomerenrein erhältlicher Weinsäure hergestellt werden. Hierzu werden zunächst die Carboxygruppen der Weinsäure zu Methylgruppen reduziert, wodurch chirales 2,3-Butandiol entsteht. Anschließend werden die Hydroxygruppen mit p-Toluolsulfonsäurechlorid (TosCl) tosyliert und damit zu besseren Abgangsgruppen. Im letzten Schritt wird mit elementarem Lithium und Triphenylphosphan die Tosylfunktionen mittels nukleophiler Substitution durch Diphenylphosphino-Gruppen ausgetauscht (Ph=Phenyl).[2]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Bei (S,S)- und (R,R)-Chiraphos handelt es sich um chirale Moleküle, die C2-Symmetrie besitzen. Die meso-Formen (R,S) und (S,R) sind achiral. Der Drehwert einer 1,5-molaren Lösung von (S,S)-Chiraphos in Chloroform bei 22 °C beträgt −191°.[1]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Chiraphos wird als chiraler Phosphinligand in der übergangsmetallvermittelten enantioselektiven Katalyse eingesetzt. Hierbei können mit Chiraphos sehr hohe Enantiomerenüberschüsse erzielt werden.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e Datenblatt (2S,3S)-(−)-Bis(diphenylphosphino)butane bei Sigma-Aldrich, abgerufen am 14. Oktober 2023 (PDF).
- ↑ M. D. Fryzuk, B. Bosnich: Asymmetric synthesis. Production of optically active amino acids by catalytic hydrogenation. In: J. Am. Chem. Soc., 99, 1977, S. 6262–6267; doi:10.1021/ja00461a014.
