Festuclavin
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
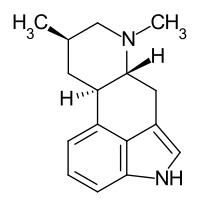
| ||||||||||
| Allgemeines | ||||||||||
| Name | Festuclavin | |||||||||
| Andere Namen |
| |||||||||
| Summenformel | C16H20N2 | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 240,3 g·mol−1 | |||||||||
| Schmelzpunkt | ||||||||||
| Löslichkeit |
| |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Toxikologische Daten | ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||
Festuclavin ist eine natürlich vorkommende chemische Verbindung. Es ist ein zur Gruppe der Clavine zählendes Alkaloid, welches von zahlreichen auf Süßgräsern parasitierenden Mutterkornpilzen und anderen Schlauchpilzen produziert wird. Sein Name leitet sich von seinem Vorkommen im mit Mutterkornpilzen infizierten Festuca rubra (Gewöhnlicher Rotschwingel) ab.
Vorkommen
[Bearbeiten | Quelltext bearbeiten]Festuclavin besitzt auf Grund seiner Schlüsselposition in der Biosynthese von Mutterkornalkaloiden vom Dihydroclavin-Typ eine recht weite Verbreitung innerhalb der Gruppe der Mutterkornalkaloide produzierenden Organismen. Ursprünglich wurde Festuclavin im Mutterkorn sowie bei befallenen Süßgräsern der Gattungen der Glanzgräser (Phalaris) und der Kammquecken (Agropyron) gefunden.[1] Neben verschiedenen Mutterkornpilzen der Gattungen Claviceps und Epichloë gelten auch die phylogenetisch weiter entfernten Vertreter der Familie Trichocomaceae, insbesondere aus den Gattungen Aspergillus und Penicillium, als Produzenten dieses Clavins.[5]
Besonders auffällig ist das Vorkommen von Festuclavin und anderen Clavinen in Windengewächsen.[6] Hier sind sie sowohl Bestandteil ihres toxischen Prinzips und der psychotropen Wirkung der rituell genutzten Windengewächsdrogen Ololiuqui (insbesondere aus Turbina corymbosa) und Tlitliltzin (Ipomoea violacea und andere Ipomoea-Arten). Für das Vorkommen von Festuclavin in Windengewächsen wird ein Befall mit Mutterkornpilzen der Gattung Periglandula verantwortlich gemacht.[7]
Biosynthese
[Bearbeiten | Quelltext bearbeiten]Die Biosynthese von Festuclavin wird durch eine Reihe von Enzymen, die durch einen Cluster sogenannter EAS-Gene (ergot alkaloid synthesis genes = Mutterkornalkaloidsynthesegene) kodiert werden, katalysiert.[8][9]
In einem ersten Reaktionsschritt wird die Aminosäure Tryptophan mit Dimethylallylpyrophosphat unter Beteiligung des Genprodukts von dmaW, der Dimethylallyltryptophansynthase, zu Dimethylallyltryptophan prenyliert. Eine Methyltransferase katalysiert die N-Methylierung zu N-Methyldimethylallyltryptophan. Der Ringschluss des C-Rings zu Chanoclavin-I erfolgt unter Katalyse der Chanoclavinsynthase. Eine Oxidation von Chanoclavin-I führt zum Chanoclavin-I-aldehyd, welches unter Beteiligung der durch das easA-Gen kodierten Chanoclavincyclase unter Ringschluss des D-Rings und unter Reduktion der Doppelbindung zum Festuclavin zyklisiert wird.[10]
Festuclavin ist zugleich der Ausgangspunkt für die Biosynthese zahlreicher weiterer Alkaloide. So leiten sich die Fumigaclavine aus Aspergillus fumigatus und weiteren Arten sowie die Dihydromutterkornalkaloide, die beispielsweise von Claviceps africana produziert werden, vom Festuclavin ab. Auf diese Weise nimmt Festuclavin eine Schlüsselposition in der Biosynthese der Dihydroclavine ein.
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Chemische und physikalische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Festuclavin ist leicht löslich in Chloroform, Ethylacetat, Aceton, Methanol, Ethanol, Pyridin, verdünnten Säuren. Seine Löslichkeit in Benzol, Toluol und Diethylether ist hingegen begrenzt. In Petrolether ist Festuclavin unlöslich.[1]
Festuclavin gibt die typischen Nachweisreaktionen auf Mutterkornalkaloide.[1] Dazu zählen insbesondere die Van-Urk-Reaktion und der Nachweis mit Kellers Reagenz.
Stereochemie
[Bearbeiten | Quelltext bearbeiten]
Festuclavin ist ein chiraler Naturstoff mit drei Asymmetriezentren. Festuclavin besitzt eine All-R-Konfiguration. Als weitere Diastereomere des Festuclavins kommen sein C-8-Epimer Pyroclavin und sein C-10-Epimer Costaclavin in der Natur vor. Ohne Bedeutung ist hingegen das C-5-Epimer.
Pharmakologie
[Bearbeiten | Quelltext bearbeiten]Festuclavin ist ein Antagonist an α1-Adrenozeptoren und 5-HT2-Rezeptoren.[11] In höherer Dosierung wirkt Festuclavin antimikrobiell und zytostatisch.[12][13]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e f Abe M, Yamatodani S: Isolation of two further water-soluble ergot alkaloid. In: J. Agr. Chem. Soc. (Japan). 24. Jahrgang, 1954, S. 501.
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ Arzneimittel-Forschung. Vol. 35, S. 1760, 1985.
- ↑ Eintrag zu Festuclavine in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM) (Seite nicht mehr abrufbar)
- ↑ Anatoly G. Kozlovsky: Ergot: The Genus Claviceps. Medicinal and Aromatic Plants – Industrial Profiles. Hrsg.: Vladimir Kren, Ladislav Cvak. CRC Press, 2004, ISBN 0-203-30419-5, Producers of ergot alkaloids out of the Claviceps genus, S. 479–499.
- ↑ Eckart Eich: Solanaceae and convolvulaceae – secondary metabolites: biosynthesis, chemotaxonomy, biological and economic significance. Springer, 2008, ISBN 3-540-74540-8, Tryptophan-derived Alkaloids, S. 213–260.
- ↑ Steiner U, Leibner S, Schardl CL, Leuchtmann A, Leistner E: Periglandula, a new fungal genus within the Clavicipitaceae and its association with Convolvulaceae. In: Mycologia. 103. Jahrgang, Nr. 5, 2011, S. 1133–1145, doi:10.3852/11-031, PMID 21558502.
- ↑ Tudzynski P, Hölter K, Correia T, Arntz C, Grammel N, Keller U: Evidence for an ergot alkaloid gene cluster in Claviceps purpurea. In: Mol Gen Genet. 261. Jahrgang, Nr. 1, 1999, S. 133–141, PMID 10071219.
- ↑ Panaccione DG: Origins and significance of ergot alkaloid diversity in fungi. In: FEMS Microbiol Lett. 251. Jahrgang, Nr. 1, 2005, S. 9–17, PMID 16112823.
- ↑ Cheng JZ, Coyle CM, Panaccione DG, O’Connor SE: Controlling a structural branch point in ergot alkaloid biosynthesis. In: J Am Chem Soc. 132. Jahrgang, Nr. 37, 2010, S. 12835–12837, doi:10.1021/ja105785p, PMID 20735127.
- ↑ Pertz H: Naturally occurring clavines: antagonism/partial agonism at 5-HT2A receptors and antagonism at alpha 1-adrenoceptors in blood vessels. In: Planta Med. 62. Jahrgang, Nr. 5, 1996, S. 387–392, PMID 8923801.
- ↑ Eich E, Eichberg D: Zur antibakteriellen Wirkung von Clavinalkaloiden und deren partialsynthetischen Derivaten. In: Planta Med. 45. Jahrgang, Nr. 7, 1982, S. 146–147, PMID 17396846.
- ↑ Glatt H, Pertz H, Kasper R, Eich E: Clavine alkaloids and derivatives as mutagens detected in the Ames test. In: Anticancer Drugs. 3. Jahrgang, Nr. 6, 1992, S. 609–614, PMID 1288732.